转基因玉米T25基体标准物质协同实验研究
2014-06-07董莲华周云龙曹应龙卢长明刘张岚
董莲华, 李 亮, 周云龙, 曹应龙,沈 平, 卢长明, 王 晶, 刘张岚
(1.中国计量科学研究院,北京 100013; 2.农业部科技发展中心,北京 100122;3.中国农科院油料作物研究所,湖北武汉 430062)
转基因玉米T25基体标准物质协同实验研究
董莲华1, 李 亮1, 周云龙2, 曹应龙3,沈 平2, 卢长明3, 王 晶1, 刘张岚1
(1.中国计量科学研究院,北京 100013; 2.农业部科技发展中心,北京 100122;3.中国农科院油料作物研究所,湖北武汉 430062)
对转基因玉米T25转化体特异性荧光定量PCR方法的关键参数进行了方法验证,选择了7家实验室采用经过验证的方法对3个水平的转基因玉米T25基体标准物质进行协同实验研究。通过比较分析各参与实验室的实验条件、标准曲线的参数,进一步证明该方法室间重复性好。经统计学分析各参与实验室的数据等精度,因此计算各实验室的总平均值做为标准物质的标准值。3个水平的基体标准物质的标准值和扩展不确定度(k=2)分别为1.17%±0.22%、2.17%±0.38%和9.81%±2.30%。
计量学;转基因玉米;T25;基体标准物质;实时荧光定量PCR
1 前 言
转基因玉米在全球范围的大面积种植,使其食用安全和环境安全问题引起了各国政府和相关国际组织的高度重视,各国纷纷出台了转基因生物安全管理相应的法规,这对转基因植物检测技术的灵敏度和准确性提出了挑战。目前我国农业部已颁布了转基因玉米定性PCR检测方法的国家标准,然而尚缺乏转基因玉米产品的标准物质,而无法保证转基因检测结果的准确、可靠和可比性,因此加快转基因玉米标准物质的研制势在必行。
转基因玉米T25为拜耳公司生产的具有草丁膦抗性的转基因玉米,该品种中Camv35s启动子与nos终止子一同控制草丁膦抗性基因PAT。PAT是来源于杆菌Bacillus amyloliquefaciens草丁膦乙酰转移酶基因,它能使草丁膦中游离氨基乙酰化而失活。PAT与已知的120多种人体蛋白无同源性。目前,美国、澳大利亚、加拿大、阿根廷、日本等国家已批准该转基因玉米在饲料中使用。为了加强对该转基因玉米的检测,美国油料化学学会(AOCS)已经研制了该玉米的叶片基因组DNA分子标准物质[1]。目前对于生物标准物质,尤其是转基因标准物质,可参考的定值方法较少,实时荧光定量PCR方法是目前可以进行转基因定量检测比较成熟的方法[2~4],本文选择多家协同定值方式对研制的基体标准物质进行协同研制,并且使用的定值方法(转基因玉米T25转化体特异性和玉米内标基因特异性定量PCR方法)是经过欧盟确认的标准方法[5],但在使用该方法定值前本文先对方法进行了验证[6],然后选择6~8家实验室采用实时荧光定量PCR方法对研制的转基因玉米T25基体标准物质进行联合定值。
2 材料与方法
2.1 材料
2.1.1 转基因玉米T25阳性和阴性材料
转基因玉米T25阳性和阴性材料由农业部科技发展中心提供;转基因玉米T25 A、B、C 3个含量水平基体标准物质:由中国农业科学院油料作物研究所研制;转基因玉米T25阳性基因组DNA,购自美国油料化学会(AOCS)标准值(转基因质量比)大于999.9 ng/μg,不确定度可以忽略(详见该标准物质证书)。
2.1.2 主要试剂
植物基因组DNA提取试剂盒、购自天根生化科技有限公司,定量PCR试剂盒购自美国ABI北京分公司。
2.1.3 特异性引物和探针
本实验所使用的引物探针均由上海英俊公司合成。其中探针5’端采用荧光标记基团FAM进行标记,3’端采用荧光淬灭基团TAMRA进行标记。具体序列参考欧盟公开发布的转基因玉米T25转化体特异性方法验证报告[5],见表1。

表1 Taqman探针实时PCR检测引物和探针序列信息
2.2 方法
2.2.1 样品DNA的提取
采用天根生化科技公司的植物DNA抽提试剂盒(离心柱型)对样品的基因组DNA进行提取,具体过程见试剂盒说明书。
2.2.2 紫外分光光度法检测提取DNA纯度
用1×TE0.1做空白采用紫外分光光度计进行测定A260、A280和A320的紫外吸收值,然后将提取的DNA溶液分别测定A260、A280和A320下的紫外吸收值。以A320作为背景吸收计算出样品DNA溶液在260 nm、280 nm处的紫外吸收值。
2.2.3 荧光染料法测定DNA浓度
为能准确测定DNA的浓度,本实验采用荧光染料法,即PicoGreen dsDNA定量试剂盒法测定提取DNA溶液的浓度。实验中使用的荧光染料P7589能特异性的结合双链DNA,因此可以特异性测定双链DNA的浓度,受单链DNA、RNA和蛋白质的影响较小。
2.2.4 实时荧光定量PCR扩增
经过纯度鉴定后提取的DNA进行实时荧光定量PCR扩增,扩增所用的引物探针及浓度见表1。扩增程序为:95℃,10 min;95℃15 s,60℃1 min,50个循环。
2.2.5 标准曲线的制作
将基因组DNA标准物质用荧光染料法测定浓度,计算溶液中含有的基因组的拷贝数,然后采用梯度稀释法对基因组DNA溶液进行稀释。分别稀释5个梯度,作为标准溶液。取5μL已稀释的基因组DNA标准溶液,按照本文第2.2.4节中描述的荧光定量PCR条件进行扩增。扩增后得到以拷贝数的对数为横坐标,以Ct值为纵坐标的标准曲线。
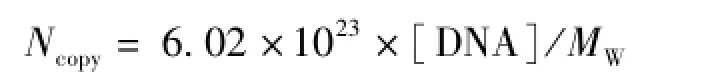
式中,[DNA]为测定的基因组溶液的质量浓度,g/L;MW为基因组的分子量大小,其中基因组大小(碱基对)为2 500×106。
定量PCR的扩增效率计算式为
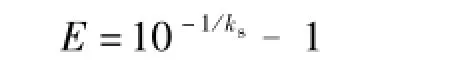
E为扩增效率;ks为标准曲线的斜率。
3 实验结果
3.1 方法验证
3.1.1 样品DNA的质量检查
根据OD260/OD280的比值,确定提取DNA的纯度,当比值为1.8~2.0之间说明样品DNA质量满足实验要求。转基因玉米T25标准物质样品提取DNAA260/A280比值均处在1.8~2.0之间,见表2,表明提取的DNA质量纯度符合要求。

表2 转基因玉米T25基因组DNA质量分析(n=5)
3.1.2 标准曲线参数
对其线性扩增效率和线性相关性进行评价。PCR扩增产生的标准曲线的斜率必须在-2.9~-3.7,线性相关系数>0.985,见表3,因此斜率和线性相关系数均满足要求[7]。
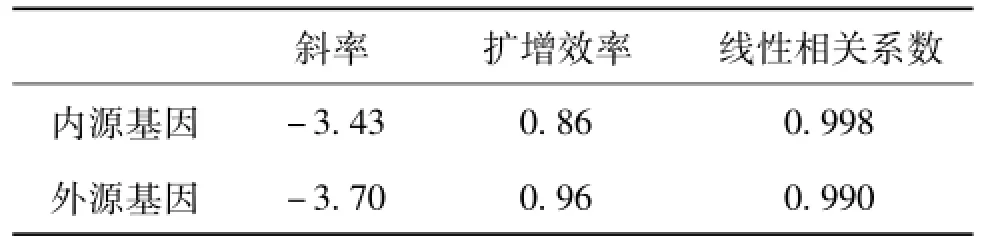
表3 转基因玉米T25内、外标准基因定量PCR扩增效率和线性相关系数
3.1.3 重复性
在对建立的转基因玉米T25定量PCR检测方法内、外标准基因的扩增效率,线性相关系数等参数进行验证后,用建立的定量PCR方法对转基因玉米T25基体A、B、C 3个梯度水平的样品进行了定量分析。结果显示,所有样品定量分析的相对标准偏差RSD在25%之内,说明转基因玉米T25定量PCR方法的重复性能够满足定量的要求[7],可用于该基体物质的定值。
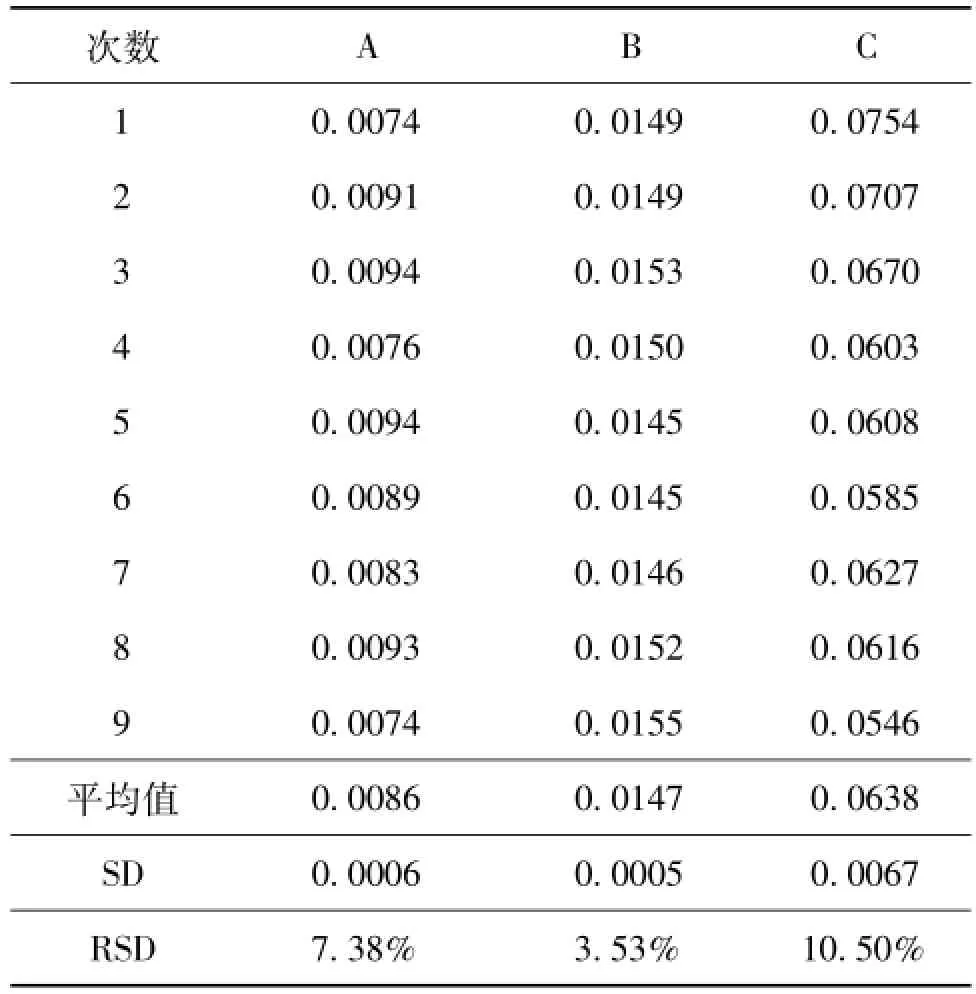
表4 转基因玉米T25定量PCR检测重复性(n=9)
3.2 协同实验验证
3.2.1 协同实验结果
上述方法经过方法验证可用于转基因玉米T25基体标准物质定值,选择有资质的实验室使用该方法对转基因玉米T25基体标准物质进行协同实验。每个参与协同实验的实验室对3个待测定样品进行3次重复测定,每次重复测定至少设置3个平行。
此次协同实验中选择了7家实验室,7家实验室使用了不同的定量PCR仪器、不同的仪器分析软件以及不同的基线设定方法。实验室使用的定量PCR仪器主要是ABI系列,Rotor-Gene 3000A和bio-rad系列定量PCR仪。基线和阈值的设置除1家实验室外,其余6家均采用自动设置。从各实验室定量PCR标准曲线参数可以看出,不同的PCR仪器均得到了较好的扩增效率和线性相关系数,进一步说明转基因玉米T25定量PCR体系适用于不同的PCR仪器,具有较好的稳定性。
各实验室定量PCR的线性相关系数和扩增效率以及定量标准曲线斜率的计算结果见表5,由表中结果可以看出,7个实验室构建的定量标准曲线的内标准基因扩增效率在0.87~0.96之间,平均值为0.93,线性相关系数均大于0.99。外标准基因扩增效率在0.83~0.93之间,平均值为0.89,线性相关系数均大于0.99。说明各家实验室所构建的转基因玉米T25定量PCR标准曲线符合定量要求,具有较好的扩增效率和线性相关系数。

表5 各实验室定量PCR的扩增效率和线性相关系数
3.2.2 标准物质量值
根据一级标准物质研制规范[8]中对采用多个实验室合作定值时数据处理要求,首先考察各实验室全部测量数据是否服从正态分布,经统计分析,3个水平的基体标准物质测定结果均服从正态分布。然后将各实验室测量结果的平均值视为一组新的数据,再对各家平均值采用格拉布斯准则进行离群值检验[9],经检验并没有发现离群值。最后用科克伦(Cochran)法检查各组数据之间是否等精度[10],经检验各家数据等精度,因此计算其总平均值及其标准偏差,所得算术平均值即为该标准物质的标准值,见表6。
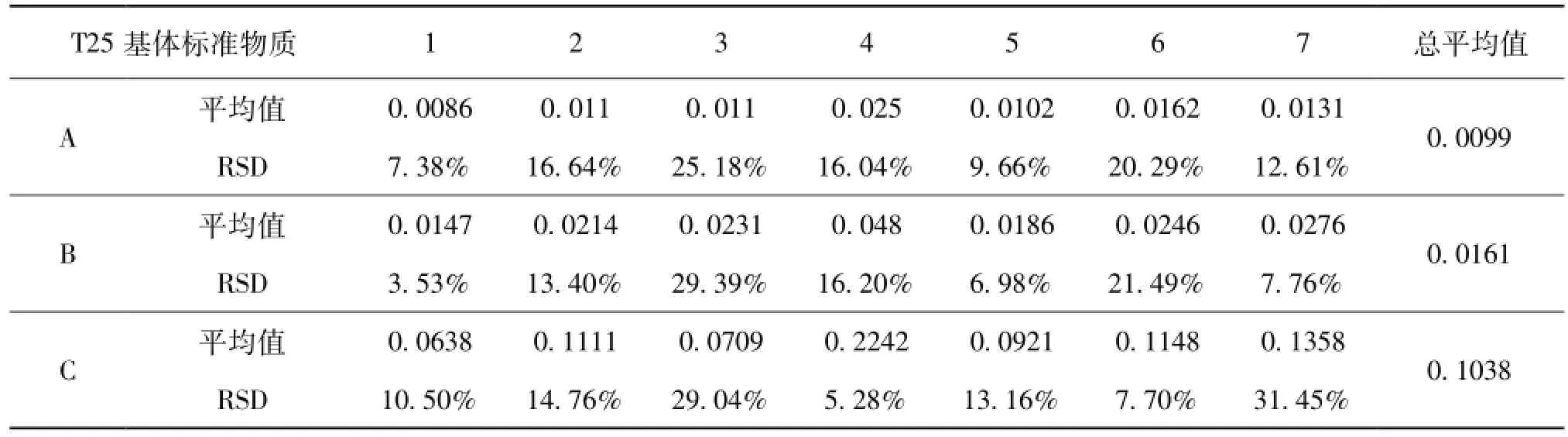
表6 多家协同实验结果
3.2.3 不确定度评定
转基因玉米T25定值结果的不确定度由两部分组成,第一部分是定值结果的A类标准不确定度uA,第二部分是定值方法的B类标准不确定度uB。
A类不确定度uA是通过测量数据的标准偏差、测量次数及所要求的置信水平按统计方法计算出的不确定度。通过分析,各实验室的数据平均值等精度,因此A类不确定度的具体计算方法为:
对标准物质的特性量进行测定时,由m个实验室进行测定,每个实验室测定平均值为测定数据服从正态分布,间等精度为
B类不确定的主要来源包括:(1)移液器带来的不确定度;(2)标准溶液系列稀释带来的不确定度;(3)标准物质引入的不确定度。由标物证书可知,标准物质的不确定度可以忽略,因此B类不确定评定仅考虑前2个因素。
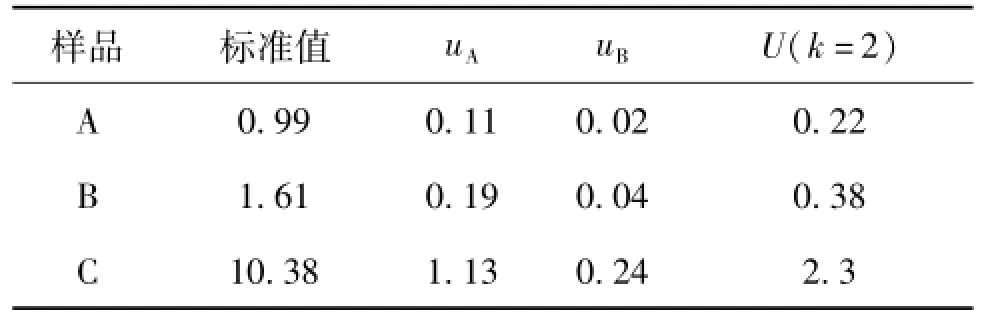
表7 转基因玉米T25基体标准物质的标准值及不确定度(%)
4 总 结
对转基因玉米T25定量PCR方法进行了方法验证研究,测试了定量标准曲线、线性相关性、PCR扩增效率、重复性等主要技术参数,经过验证,该方法满足标准物质定值要求。组织了7家实验室对转基因玉米T25 A、B、C 3个水平的基体标准物质进行了协同定值,对多家定值的数据进行了统计分析。经分析得出,转基因玉米T25 A、B、C 3个水平的转基因质量分数分别为0.99%、1.61%和10.38%,扩展标准不确定度(K=2)分别为0.22%、0.38%和2.3%。
[1] AOCS0306-H3+Certificate[EB].https://secure.aocs. org/crm/files/0306H3-Certificate.pd f,2011-08-05.
[2] Rønning SB,Vaïtilingom M,Berdal K G,etal.Event specific real-time quantitative PCR for genetically modified Bt11 maize(Zea mays)[J].EuropeanFood ResearchTechnology,2003,216(4):347-354.
[3] Holst-Jensen A,Rønning S B,Løvseth A,etal.PCR technology for screening and quantification of genetically modified organisms(GMOs)[J].Analalyticaland BioanalyticalChemistry,2003,375(8):985-993.
[4] Cankar K,Stebih D,Dreo T,etal.Critical points of DNA quantification by real-time PCR—effects of DNA extraction method and sample matrix on quantification of geneticallymodified organisms[J].BMCBiotechnology,2006,6(14):37-51.
[5] Mazzara M,Grazioli E,Savini C,etal.Event-specific method for the quantitation of maize line T25 usin realtime PCR,validation report[R].EUR 21826 EN,2005.
[6] 于亚东.化学分析的方法确认[M].北京:中国计量出版社,2009.
[7] ENGL.Definition of minimum performance requirements for analyticalmethods of GMO testing[R].EUR 23696 EN,2008.
[8] JJG 1006—94,一级标准物质技术规范[S].
[9] ISO Guide 35:2006,Reference materials—General and statistical princip les for certification[S].
[10] JJF 1343—2012,General and statistical principles for characterization of referencematerials[S].
Characterizing on Genetically Modified T25 Maize Line Matrix Reference Material
DONG Lian-hua1, LILiang1, ZHOU Yun-long2, CAO Ying-Long3,SHEN Ping2, LU Chang-ming3, WANG Jing1, LIU Zhang-lan1
(1.National Institute of Metrology,Beijing100013,China;
2.Science and Technology Development Center,Ministry of Agriculture,Beijing 100122,China;
3.Oil Crops Research Institute of Chinese Academy of Agricultural Science,Wuhan,Hubei430062,China)
To validate the key parameters of the real time PCR method for GM maize T25,7 different laboratories are chosen to assign the reference values of three different GM content matrix reference materials by using the same method.Although different types of instruments are used by different labs,the standard curve generated by each lab is comparable which indicated that thismethod shows a good reproductablity.After statistically analyzing the data gained from seven labs,the totalmeans are assigned to be the reference values.The reference values and expanded uncertainties(k=2)for threematrix GM referencematerial are 1.17%±0.22%,2.17%±0.38%and 9.81%±2.30%.
Metrology;Geneticallymodified maize;T25;Matrix referencematerial;Real time quantitative PCR
TB99
A
1000-1158(2014)01-0087-05
10.3969/j.issn.1000-1158.2014.01.18
2011-09-05;
2013-05-20
国家转基因生物新品种培育科技重大专项(2008ZX08012-003);科技支撑项目(2008BAK41B01)
董莲华(1981-),河北涞水,中国计量科学研究院助理研究员,博士,主要从事微生物转基因核酸标准物质研究。lianhuadong@gmail.com
