克雅二氏病研究与诊断进展
2014-06-07陈文武成克定姬新颖1
何 敏,陈文武,成克定,姬新颖1,*
(1.河南大学医学院抗体药物河南省工程实验室,河南开封475004;2.河南护理职业学院内科,河南安阳455001; 3.河南大学第一附属医院神经内科,河南开封475001)
克雅二氏病研究与诊断进展
何 敏1,2,陈文武3,成克定3,姬新颖1,3*
(1.河南大学医学院抗体药物河南省工程实验室,河南开封475004;2.河南护理职业学院内科,河南安阳455001; 3.河南大学第一附属医院神经内科,河南开封475001)
克雅二氏病(Creutzfeldt-Jakob disease,CJD)是朊粒(prion)类疾病在人类中最常见的病种,与其他常见的传染病不同的是,这个疾病不是由类似于含有基因的病毒或细菌的病原造成的疾病,而是由变构蛋白朊粒直接造成的疾病。尽管如此,它的公共健康的意义很大。因为朊粒在常规消毒情况下是不被灭活的。这类患者的朊粒会通过输血、手术或其他途径把病原传给他人,加上疾病发病的潜伏期长,很难马上被发现,给临床诊断造成很大困难。目前诊断主要限于临床表现及晚期的影像检查和组织学检查,特异性也比较低。早期和主动的、特异性的诊断方法一直是此领域的热点和亟待攻克的难题。近年来,克雅二氏病的研究和诊断有很大进展,因此,对目前国内外关于克雅二氏病的研究和诊断作一综述,特别是目前在世界少数国家出现的Real-time quaking-induced conversion(简称RT-QuIC,此处翻译为“实时震动诱导转化”)作了详细介绍。
克雅二氏病;朊粒;实时震动诱导转化;诊断
1 朊粒类疾病
朊粒类疾病(prion diseases)通常称之为传染性海绵状脑病(transmissible spongiform encephalopathies,TSE)。是一类人和动物均能患病的疾病。但在不同种属上有不同的名称,如我们熟知的疯牛病(mad cow disease)是牛所患的一种朊粒类疾病,而在羊身上就叫瘙痒症(scrapie)[1]。在人类中朊粒类疾病有多种,象散发型CJD(sporadic CJD,最常见),医源型CJD(Iatrogenic CJD),家族型CJD,恶性家族型失眠症(fatal familial insomnia,FFI)等[2]。河南是在中国发现首例FFI的省份,对中国朊粒类疾病的研究做出了重要贡献。目前公认所有朊粒类疾病都是由朊蛋白(prion protein,Pr P)的构相异常(misfolding)造成的朊蛋白凝集和纤维化,使中枢神经细胞中毒和死亡,并使大脑组织形成空泡样病变[3]。具体的发病机制细节尚待研究。CJD的临床症状主要是患病个体的快速的记忆缺失和运动失常,不久即死亡。因疾病的潜伏期较长,病史不易追踪,又容易与其他常见的神经变性型疾病混淆,从发病到死亡时间又较短,临床上难以做出明确的诊断。
2 CJD
CJD是朊粒类疾病在人类中最常见的表现,最早由两位德国医生Creutzfeldt和Jakob在上世纪二十年代发现,但当时他们尚未把病因搞清楚。直到上世纪八十年代,prion(朊粒,源于proteinaceous infectious particle,蛋白类传染颗粒)被诺贝尔奖获得者Stanley B.Prusiner发现,并证明是引起CJD的病原。根据传染途径和基因分析,目前把CJD分为以下几种:iatrogenic CJD(iCJD,医源性CJD),是由于患者因使用过含有prion的生物制剂,或经过外科器械消毒不善的手术操作传染而得病(prion不宜在常规消毒下灭活)[4];variant CJD(vCJD,CJD变种),是经牛的prion发病的,如在疯牛病区域生活过或吃过疯牛病病牛的肉,这个媒体报道最多,但患病者极少。中国没有发现疯牛病,也没有vCJD的报道。另外还有朊粒蛋白基因PRNP基因异常造成的家族型或基因型CJD(fCJD或gCJD)。但CJD最常见的种类是sporadic CJD(sCJD,散发型CJD),占所有CJD的80~90%,发病率为百万分之一到二,是非遗传性的,散发性的朊粒类疾病,由PNRP基因突变,或正常的prion蛋白不明原因的自动转化造成的CJD。恶性家族型失眠症(fatal familial insomnia, FFI)也是PRNP基因异常造成的遗传性疾病[5]。
3 CJD的常规研究和诊断方法
因CJD和其他朊粒造成的疾病被一致认为都是由朊粒所致,CJD的研究和诊断大都集中在朊粒上。朊粒实际上是一种正常的细胞编码的朊蛋白(通称Pr Pc,Cell type Pr P,细胞型朊蛋白)变构形成的具有极强传染性和抵抗力的搔痒病朊蛋白(PrPsc, Scrapie type Pr P,因最早发现于羊搔痒症)。这种变构的机制尚不十分清楚,但这种现象十分明显,而且体外就可以模拟。变构后的蛋白由以α螺旋为主要结构的Pr Pc变为以β片层为主要结构的PrPsc。Pr Psc对蛋白酶酶消化极不敏感,可用免疫印迹法(Western blotting)在患病脑组织中证实并用于CJD的最终诊断和分类[3],见图1。

图1 两例散发型CJD(S)和一例CJD变种(V)脑组织在免疫印迹测试中的不同表现。D为双糖基化,M为单糖基化,N为无糖基化条带。1,2A,2B为按条带对CJD的分型。(摘自参考文献3)。
另外,因CJD的主要病理表现是脑组织的空泡样病变及prion蛋白沉积,组织学检查脑组织以确诊是非常必要的。除空泡样病变外,造成的蛋白凝集和纤维化也可以作为诊断的依据[3],见图2。
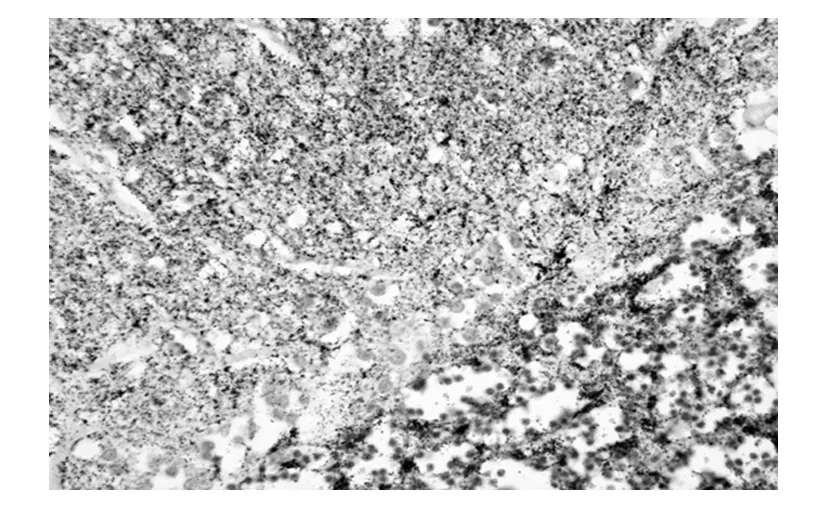
图2 CJD脑组织中的点状朊粒蛋白沉集(摘自参考文献3)。
随着对CJD研究的深入,发现基因突变在CJD中很普遍,基因和分子生物学检测(如PCR)也可作为CJD诊断和分类的依据[5],见图3。
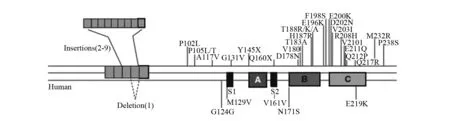
图3 人类朊粒蛋白基因序列变化造成的氨基酸变化一览。其中M129V(129位的氨基酸methionine变成valine)较常见(摘自参考文献5)。
CJD的临床表现并不完全一致,一般来讲患者的临床表现有进展性、致命性脑病变的症状和体征,象记忆力缺失,小脑型失调和震颤,锥体和锥体外表现等。sCJD患者大都年龄比较大(平均年龄65岁),病期短(平均4 mon即死去),而vCJD平均年龄较小(26岁),病期稍长(平均13 mon死去)。另外在诊断CJD时遗传和家族史也可以作为参考。这类患者的脑电图有典型特征(每秒出现一次三期复合图形)。利用脑部的特殊影像方法,如DWI(Diffusion-weighted imaging)或FLAIR(Fluid attenuation inversion recovery),可看到大脑皮层和基底节的病变[6-7]。根据上述临床特征和检查结果,可作出疑似CJD的诊断。如有组织学、免疫学和基因学的证据,可作出CJD的诊断。不难看出这些诊断方法大都限于患者晚期甚则患者死亡后。利用脑组织做诊断也受到许多限制,再加上朊粒具有极强的传染性,脑组织的检查和操作要求也非常慎重。同样,因基因突变的表现非常多样和复杂,基因学检查实施起来也不是立竿见影,对不常见的基因突变,一下子能找到基因突变的位置也比较困难。
近些年,临床上根据CJD发病造成的的快速脑组织病变的特点,利用脑脊液的多种生物标志物的变化作为CJD诊断的辅助证据,如蛋白tau,14-3-3和S100都会发生不同的量的变化,可以用酶联免疫或免疫印迹法检测[8-10],其中14-3-3应用较广泛,在CJD发病中被破坏的细胞释放到脑脊液中的量增加,其结果也较可靠。脑脊液的样品收集要比脑组织容易得多,可在活体患者上收集,是一大优点,但这些生物标志物的检测和采取的手段中很难找到特异性最强的Pr Psc,目前它们只能和临床表现、脑电图以及放射影像学诊断一起作为辅助诊断的依据[10-11]。
我国的CJD监测网络已初步形成,由中国CDC统一负责和领导,监测网络已包括中国的大部分省份[12-14]。诊断指标包括临床检查及实验室检查。14-3-3检测已作为常规。我国克雅氏病的基础研究居世界前列[15-16]。
4 朊粒类疾病及CJD的研究和诊断进展
为增加朊粒类疾病及CJD检测的敏感性和特异性,近些年来出现了Protein-Misfolding Cyclic Amplification(PMCA,此处翻译为“蛋白变构循环扩大法”)。见图4A、B所示。

图4 蛋白变构循环扩大法(PMCA)。A为操作示意,B为潜在原理(摘自参考文献17)。
PMCA是利用CJD患者大脑组织匀浆,与不含有具有传染性朊粒的正常脑组织或合成的正常细胞型朊蛋白进行孵育,并进行循环式的超声震荡,这样正常的蛋白就会被转化成对蛋白酶抵抗的朊粒蛋白,这些朊粒蛋白产物能接着转化其他的正常构象的朊蛋白[17]。这样朊蛋白在多轮震荡后会越产越多,多到可以用免疫印迹法检测。因此方法有巨大的放大作用,极少量的脑组织就可放大并产生出用免疫印迹法很容易检测到的蛋白酶抵抗蛋白。目前此方法已趋于成熟,但它本身操作起来不是很容易,通量也不够,常规检测受到巨大限制。因为要取得结果需要反复用超声震荡,并最终用免疫印迹去证实。后来有人把正常脑组织换成重组的细胞型Pr P蛋白,对PMCA改善了不少,但超声震荡和最终用免疫印迹法做诊断仍使此方法的通量和动态学观察受到限制。利用患病的脑组织作为反应的“种子”(seeds)在动物朊粒类疾病诊断上较可行,可在人身上发生的CJD的诊断上要活体采样,安全和操作难度很大。
几年前以美国国家卫生研究院(NIH)为代表的的研究团队对朊粒类疾病及CJD检测有突破性进展,他们利用仓鼠朊粒疾病模型263K脑匀浆为“种子”,用快速振匀法替代超声震荡,并使用大肠杆菌人工表达的仓鼠细胞型朊蛋白作为“底物”(substrate),在含有多孔的振匀器(shaker)上操作,这样一次检测就可测试多个样品,这样自动化较高的振匀器替代了超声震荡。他们把此方法叫做quaking-induced conversion(简称QuIC,“震动诱导转化”)。虽然免疫印迹法仍作为最终的诊断结果,但此方法与PMCA比较有巨大改善,见图5。
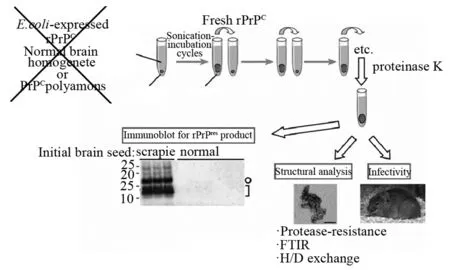
图5 震动诱导转化示意图(摘自参考文献17)。
NIH团队不久就对QuIC作了进一步的改进,他们用具有快速振匀功能的多孔板释读器(plate reader)代替了振匀器,并利用朊蛋白沉淀小体(amyloid)在形成过程中能吸收颜料thioflavin T并造成光谱吸收的变化的现象,在QuIC反应中加入thioflavin T,并用释读器实时监测荧光吸收变化[17-18],见图6。他们把此方法称之为“实时震动诱导转化”(Real-time quaking-induced conversion)。因此方法省去了免疫印迹,又能在96孔板上测试,不需要超声震荡(自动定时快速振匀即可),操作上简便了许多,通量也提高了。NIH团队后来利用仓鼠脑脊液作为“种子”,取代了脑组织匀浆,成功取得了RT-QuIC的测试成功[18],这提示了脑脊液可以作为检测样品,并为这个方法的临床应用提供了科学依据。他们也报道了仓鼠嗅觉神经能向鼻腔散播朊粒,并可用RT-QuIC
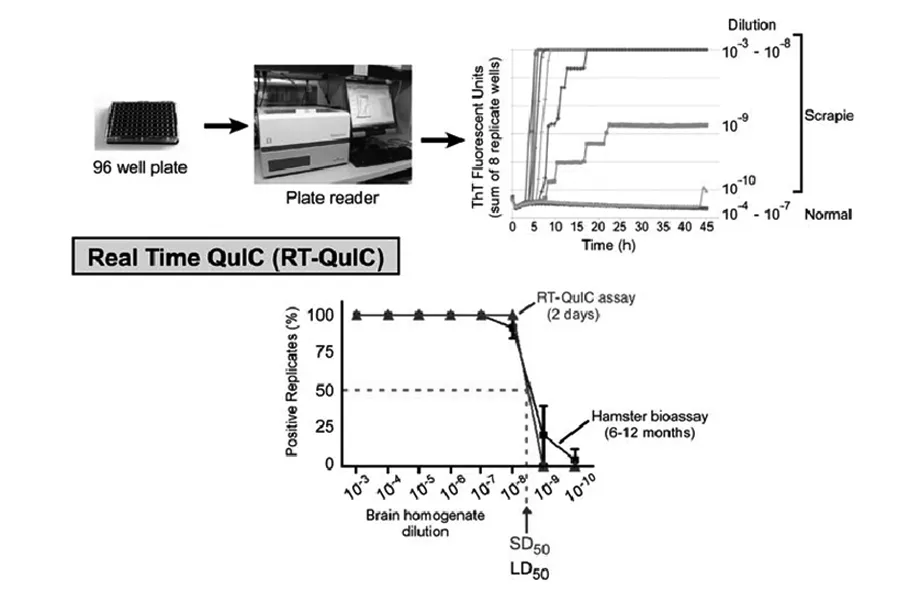
图6 实时震动诱导转化示意(摘自参考文献17)。
检测鼻腔分泌物证实朊粒的存在[19]。后来的澳大利亚和英国的科学家利用了脑脊液作为“种子”,利用合成的仓鼠蛋白作为底物,应用于不同类的克雅氏病患者样品的测试,取得了初步的成功[20-21]。目前RTQuIC被公认是最有希望的检测克雅氏病的方法,具有很高的灵敏度和特异性。目前多个国家正在努力使此方法标准化。此方法的关键是拿到功能性强,纯度又高的Pr P,这对容易沉淀和凝集的PrP来说是一个挑战,但相信通过大家共同努力,一个特异性高、敏感性强的克雅氏病的诊断方法将诞生。
[1]Liberski,P.P.Historical overview of prion diseases:a view from afar[J].Folia Neuropathol,2012,50(1):1-12.
[2]Imran,M.,and Mahmood,S.An overview of human prion diseases[J].Virol.J,2011,30(8):559.
[3]Silkorska,B.,et al.Creutzfeldt-Jakob disease-Chapter 6 [J].Nurodegenerative Disease,2012,34(1):76-90.
[4]Will,R.G.Acquired prion disease:iatrogenic CJD,variant CJD,kuru.Br[J].Med.Bull,2003,66(3):255-265.
[5]Colby,D.W.,and Prusiner,S.B.Prions.Cold Spring Harb Perspect[J].Biol.2011,3(1):a006 833.
[6]Lou,X.,Ma,et al.Diffusion-weighted magnetic resonance imaging in diagnosis of Creutzfeldt-Jakob disease[J].Chin.Med.J.(Engl),2006,119(15):1 242-1 247.
[7]Letourneau-Guillon,L.,Wada,et al.Imaging of prion diseases[J].J.Magn.Reson.Imaging,2012,35(5): 998-1 012.
[8]Coulthart,M.B.,Jansen,G.H.,et al.Diagnostic accuracy of cerebrospinal fluid protein markers for sporadic Creutzfeldt-Jakob disease in Canada:a 6-year prospective study[J].BMC Neurol,2011,22(11):133.
[9]Satoh,K.,Tobiume,et al.Establishment of a standard 14-3-3 protein assay of cerebrospinal fluid as a diagnostic tool for Creutzfeldt-Jakob disease[J].Lab.Invest,2010, 90(11):1 637-1 644.
[10]Matsui,Y.,Satoh,K.,Miyazaki,et al.High sensitivity of an ELISA kit for detection of the gamma-isoform of 14-3-3 proteins:usefulness in laboratory diagnosis of human prion disease[J].BMC Neurol,2011,22(11):120.
[11]Zerr,I.,Schulz-Schaeffer,W.J.,et al.Current clinical diagnosis in Creutzfeldt-Jakob disease:identification of uncommon variants[J].Ann.Neurol,2000,48(3):323-329.
[12]Shi,Q.,Gao,C.,Zhou,W.,et al.Surveillance for Creutzfeldt-Jakob disease in China from 2006 to 2007[J]. BMC Public Health,2008,18(8):360.
[13]石琦,高晨,陈操,等.2009年中国克雅氏病监测病例特征分析[J].疾病监测,2010,25(8):766-769.
[14]Gao,C.,Shi,Q.,Tian,C.,et al.The epidemiological, clinical,and laboratory features of sporadic Creutzfeldt-Jakob disease patients in China:surveillance data from 2006 to 2010[J].PLoS One,2011,6(8):e24 231.
[15]Chen,C.,Shi,Q.,Zhang,B.Y.,et al.The prepared tau exon-specific antibodies revealed distinct profiles of tau in CSF of the patients with Creutzfeldt-Jakob disease [J].PLoS One,2010,5(7):e11 886.
[16]Wang,X.,Shi,Q.,Xu,K.,et al.Familial CJD associated Pr P mutants within transmembrane region induced Ctm-Pr P retention in ER and triggered apoptosis by ER stress in SH-SY5Y cells[J].PLoS One,2011,6(1): e14 602.
[17]Orru,C.D.,Caughey,B.Prion seeded conversion and amplification assays[J].Top.Curr.Chem,2011,305: 121-133.
[18]Wilham,J.M.,Orru,C.D.,Bessen,R.A.,et al.Rapid end-point quantitation of prion seeding activity with sensitivity comparable to bioassays[J].PLoS Pathog,2010, 6(12):e100 121.
[19]Bessen,R.A.,Shearin,H.,Martinka,S.,et al.Prion shedding from olfactory neurons into nasal secretions[J]. PLoS Pathog,2010,6(4):e100 083.
[20]Atarashi,R.,Satoh,K.,Sano,K.,et al.Ultrasensitive human prion detection in cerebrospinal fluid by real-time quaking-induced conversion[J].Nat.Med,2011,17(2): 175-178.
[21]Peden,A.H.,McGuire,L.I.,Appleford,N.E.,et al. Sensitive and specific detection of sporadic Creutzfeldt-Jakob disease brain prion protein using real-time quakinginduced conversion[J].J.Gen.Virol,2012,93(Pt 2): 438-449.
[责任编辑 段金卯]
Progress in the study on and diagnosis of Creutzfeldt-Jakob Disease(CJD)
HE Min1,2,CHEN Wenwu3,CHENG Keding3,JI Xinying1,3*
(1.Henan Provincial Key Laboratory for Antibody Drug Engineering,Kaifeng,Henan 475004,China;2. Henan Provincial Vocational College for Nursing,Anyang,Henan 455000,China;3.The First Affiliated Hospital,Henan University,Kaifeng,Henan 475001,China)
Creutzfeldt Jakob disease(CJD)is the most common type of disease caused by prion.Different from other type of infectious diseases,this disease is caused by pathogens that contain genetic elements,such as viruses or bacteria.It is caused directly by a deformed protein called prion.Even so,the disease has important impact in public health,since prion can't be destroyed in routine sterilization procedures.The prion from CJD patients can be transferred through blood transfusion,surgery,and other approaches.The disease has a long latent phase,and is hard to be identified.This causes a big problem in clinical diagnosis.The current diagnosis involves clinical signs,imaging,and histology with low specificity.Early and active diagnosis with high specificity is urgently needed. There are some big developments in the diagnosis of CJD in recent years.This paper summarizes the progress in this area domestically and internationally,especially the recently developed real time quaking induced conversion(RTQuIC)in details.
Creutzfeldt Jakob disease(CJD);prion;realtime quaking induced conversion(RTQuIC);prion disease diagnosis
R749.1
A
1672-7606(2014)02-0145-05
2014-09-12
何敏(1964-),女,河南林州人,副教授,从事分子生物学教学与科研工作。
*通讯作者:姬新颖(1963-),男,河南开封人,博士,教授,硕士生导师,从事分子生物学教学与科研工作。
