缩氨基硫脲衍生物JOH-1对K562细胞增殖的影响
2014-06-07范红义姬汴生
刘 路,范红义,张 昀,姬汴生
(1.河南大学药学院,河南开封475004;2.河南大学天然药物与免疫重点实验室,河南开封475004)
缩氨基硫脲衍生物JOH-1对K562细胞增殖的影响
刘 路1,范红义1,张 昀1,姬汴生2
(1.河南大学药学院,河南开封475004;2.河南大学天然药物与免疫重点实验室,河南开封475004)
目的 探讨JOH-1对体外培养人白血病K562细胞株增殖的影响。方法 以JOH-1为研究对象,采用细胞体外培养技术,MTT法和台盼蓝拒染法检测JOH-1对K562细胞株增殖抑制。结果 不同浓度的JOH-1作用于K562细胞12、24、48 h后对K562细胞的增殖有抑制作用,且呈剂量和时间依赖性;生长曲线显示JOH-1使K562细胞的生长受到明显抑制。结论 JOH-1对体外培养人白血病K562细胞株的增殖有显著抑制作用,且呈剂量和时间依赖性。
JOH-1;K562细胞;增殖抑制;影响
席夫碱(Schiff base)是分子中具有碳氮双键结构的亚胺基或烷亚胺基化合物,具有抗菌、抗病毒、抗肿瘤等生物活性。由取代基的不同,席夫碱可分为多种类型。缩氨基硫脲类及其金属配合物作为席夫碱的重要组成部分,因其结构中包含S、N等杂原子,其生物活性表达更加明显[1-2]。通过对N(4)-位取代基和金属离子的优化,可得到结构更加稳定、生物活性更强的缩氨基硫脲类化合物。我们的实验观察缩氨基硫脲衍生物JOH-1对体外培养K562细胞株的抗增殖作用,初步探讨其作用机理,为进一步的研究打下基础。
1 材料与方法
1.1 药品与试剂
JOH-1来自由河南大学化学化工学院;RPMI 1640培养基购自美国Gibco公司;溴化-(4,5-二甲基-2-噻唑基)2,5-二苯基四氮唑(MTT)、二甲基亚砜(Dimethyl sulfoxide,DMSO)、十二烷基硫酸钠(sodium dodecylsulphate,SDS)、台盼蓝(Trypan Blue)、Hepes购自美国Sigma公司;Triton X-100购自华美生物工程公司;胎牛血清(fetal bovine serum, FBS)购自杭州四季青生物工程材料有限公司;其他试剂均为市售分析纯。
1.2 细胞培养
将K562细胞(购自中科院上海生化细胞所)接种在体积分数为10%胎牛血清的RPMI 1640培养液中, 37℃、体积分数为5%CO2条件下培养,每2~3天传代一次,收集状态良好的对数生长期细胞用于实验[3]。
1.3 MTT法检测JOH-1对K562细胞活力的影响
收集对数生长期K562细胞接种于96孔板,每孔保持5 000~8 000个细胞,加入终浓度为0.1、1.0、10.0、30.0、50.0μmon/L的JOH-1;经过12、24、48 h培养后,将MTT(5 g/L)10μL加入各孔,再经4 h培养后每孔各加入100 g/L SDS 100μL,37℃过夜,酶标仪570 nm处记录OD值(A570),按照公式“细胞抑制率=(1-实验组吸光度/对照组吸光度)×100%”求得细胞抑制率[4-6]。
1.4 台盼蓝拒染法绘制K562细胞的生长曲线
收集对数生长期K562细胞,加培养液将细胞浓度稀释至1×105/m L,接种于96孔板,分别加入终浓度为1、10、30μmon/L的JOH-1,经过24、48、72 h培养后,4 g/L台盼蓝染色,光学显微镜下用细胞计数板进行活细胞计数,按照所得数据绘制出K562细胞的生长曲线[7-8]。
1.5 数据分析
2 结果
2.1 MTT法检测JOH-1对K562细胞生长的影响
如表1所示,经12、24、48 h作用后,除0.1μmon/L浓度外,各浓度JOH-1均使K562细胞的增殖受到抑制,且抑制作用呈现剂量依赖性及时间依赖性。
表1 JOH-1作用12、24、48 h后对K562细胞增殖的影响(±s,n=3)
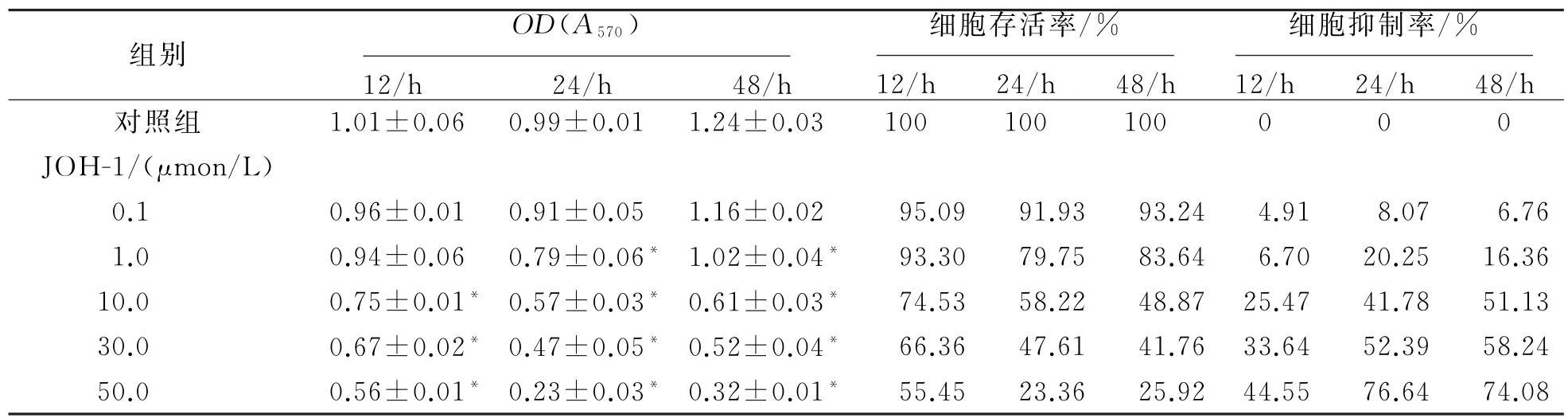
表1 JOH-1作用12、24、48 h后对K562细胞增殖的影响(±s,n=3)
注:与对照组比较,*P<0.05。
组别 OD(A570) 12/h 24/h 48/h细胞存活率/% 12/h 24/h 48/h细胞抑制率/% 12/h 24/h 48/h对照组 1.01±0.06 0.99±0.01 1.24±0.03 100 100 100 0 0 0 JOH-1/(μmon/L) 0.1 0.96±0.01 0.91±0.05 1.16±0.02 95.09 91.93 93.24 4.91 8.07 6.76 1.0 0.94±0.06 0.79±0.06*1.02±0.04*93.30 79.75 83.64 6.70 20.25 16.36 10.0 0.75±0.01*0.57±0.03*0.61±0.03*74.53 58.22 48.87 25.47 41.78 51.13 30.0 0.67±0.02*0.47±0.05*0.52±0.04*66.36 47.61 41.76 33.64 52.39 58.24 50.0 0.56±0.01*0.23±0.03*0.32±0.01*55.45 23.36 25.92 44.55 76.64 74.08
2.2 生长曲线法检测JOH-1对K562细胞生长的影响
如图1所示,不同浓度JOH-1对K562细胞存活率曲线显示,药物可明显抑制K562细胞的生长,且抑制作用呈现剂量依赖性及时间依赖性。
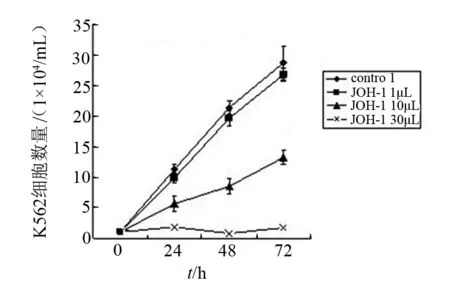
图1 台盼蓝方法测定JOH-1对K562细胞的抗增殖作用
3 讨论
缩氨基硫脲同其他席夫碱类化合物一样具有-N=CH-基团,其结构中包含N、S等杂原子,具有较为明显的抗菌、、抗结核、抗病毒、抗疟疾和抗肿瘤等多种生物活性[9-10]。S、N等杂原子作为给体与金属离子配位,形成了各种缩氨基硫脲金属配合物。近十几年研究[11]发现,大多数缩氨基硫脲金属配合物相对于配体本身拥有更好的生物活性。一般认为缩氨基硫脲抗癌活性的产生是基于其对增殖期细胞DNA复制的干扰。而部分金属离子,如Cu、Zn、Fe等,其配合物能够对某些肿瘤细胞的增殖、分化和凋亡产生影响[12-14]。当缩氨基硫脲与金属离子螯合后,脂溶性发生变化,生成的配合物更易被输送到靶位[15-16],从而表达出更加明显的生物活性。
我们实验的对象JOH-1是缩氨基硫脲的苯吡啶衍生物与Zn所形成的配合物。实验表明,随着作用时间的延长,JOH-1对K562细胞的抑制作用明显增加,说明该生长抑制作用具有时间依赖性; 0.1μmon/L的JOH-1给药组与正常组相比没有显著性差异,但随着JOH-1浓度的增加,其对K562细胞的抑制作用明显增加,说明该生长抑制作用具有剂量依赖性。我们实验的结果对研究JOH-1及其他缩氨基硫脲衍生物的抗肿瘤作用和机制具有一定的意义。
[1]王澈,侯鹏,李崧,等.席夫碱及其金属配合物的合成及生物活性研究进展[J].化学通报,2009,72(4):334-340.
[2]张恭孝,杨荣华.席夫碱金属配合物的研究进展[J].山东化工,2004,33(3):14-18.
[3]鄂征.组织培养与分子细胞学技术[M].第一版.北京:北京出版社,2001:133.
[4]张连阳,张胜本.肿瘤化学治疗敏感性和抗药性[M].成都:四川科学技术出版社,1996:56.
[5]N A Monteiro-Riviere,A O Inman,L W Zhang.Limitations and relative utility of screening assays to assess engineered nanoparticle toxicity in a human cell line[J].Toxicology and Applied Pharmacology,2009,234(1):222-235.
[6]Jörg We y`ermann,Dirk Lochmann,Andreas Zimmer.A practical note on the use of cytotoxicity assays[J].International Journal of Pharmaceutics,2005,288(1):369-376.
[7]程璟侠,樊宏英,赵瑞君.家蝇幼虫抗菌肽对K562细胞膜的质量浓度阈值作用[J].中国媒介生物学及控制杂志, 2012,23(1):42-47.
[8]Young Sun Kim,So Young Sohn,Chang No Yoon.Screening test data analysis for liver disease prediction model using growth curve[J].Biomedecine&Pharmacotherapy, 2003,57(10):482-488.
[9]杨怡.Schiff碱生物功能配合物的合成及活性研究进展[J].天津化工,2013,27(1):1-3.
[10]Garcia-Tojal J,Garcia-Orad A,Diaz A A,et al.Biological activity of complexes derived from pyridine-2-carbaldehyde thiosemicarbazone:structure of[Co(C7H7N4S)2] [NCS][J].J Inorg Biochem,2001,84(3/4):271-278.
[11]朱巧军,戴荣斌,李勤喜,等.1,5-二(2-羟基苯亚甲基)-二氨基硫脲与银配合物的合成、表征及抗癌活性研究[J].无机化学学报,2001,17(6):911-916.
[12]Lukmantara A Y,Kalinowski D S,Kumar N,et al.Synthesis and biological evaluation of substituted 2-benzoylpyridine thiosemicarbazones:novel structure-activity relationships underpinning their anti-proliferative and chelation efficacy[J].Bioorg Med Chem Lett,2013, 23(4):967-974.
[13]Alan P da Silvaa,Manuele V Martinia,Cecília M de Oliveira,et al.Antitumor activity of(-)-alpha-bisabololbased thiosemicarbazones against human tumor cell lines [J].Eur J Med Chem,2010,45(7):2 987-2 993.
[14]Daniela Buac,Sara Schmitt,George Ventro,et al.Dithiocarbamate-Based Coordination Compounds as Potent Proteasome Inhibitors in Human Cancer Cells[J].Mini Rev Med Chem,2012,12(12):1 193-1 201.
[15]EPahontu E,Fala V,Gulea A,et al.Synthesis and characterization of some new Cu(II),Ni(II)and Zn(II)complexes with salicylidene thiosemicarbazones:antibacterial, antifungal and in vitro antileukemia activity[J].Molecules,2013,18(8):8 812-8 836.
[16]Serda M,Kalinowski D S,Mrozek-Wilczkiewicz A,et al. Synthesis and characterization of quinoline-based thiosemicarbazones and correlation of cellular iron-binding efficacy to anti-tumor efficacy[J].Bioorg Med Chem Lett, 2012,22(17):5 527-5 531.
[责任编辑 姬 荷]
Effect of JOH-1,a thiosemicarbazide derivative,on the proliferation of K562 cells
LIU Lu1,FAN Hongyi1,ZHANG Yun1,JI Biansheng2
(1.Pharmacy College,Henan University,Kaifeng,Henan 475004,China;2.The Key Laboratory of Natural Drug and Immune Engineering,Henan University,Kaifeng,Henan 475004,China)
Objective To investigate the impact of JOH1 on the proliferation of K562 cells.Methods The suppression of K562 cells growth was detected by MTT assay and trypan blue exclusion.Results JOH1 inhibited the proliferation of K562 cells in dose and time dependent manner.The growth curve showed that the growth of K562 cells was inhibited.Conclusion JOH1 can obviously inhibit the proliferation of K562 cells,in a time and dose dependent manner.
JOH1;K562 cells;Proliferation inhibition;infection
R723.7
A
1672-7606(2014)02-0123-03
2014-02-15
刘路(1979-),男,河南开封人,讲师,从事肿瘤药理学的教学和科研工作。
