局部注射BDNF对压力性尿失禁模型大鼠LPP及EUS内BDNF的影响*
2014-06-07马翠王志莲郝敏
马翠 王志莲 郝敏
流行病学调查显示,我国尿失禁的总患病率为30.9%,其中压力性尿失禁(stress urinary incontinence,SUI)患病率为18.9%,占总患病率的61%[1],并且随着人口老龄化,发病人数有所增加。目前SUI发病类型逐渐趋向混合、复杂化,并成为全球关注的新高发疾病[2]。
SUI发生时盆底神经发生退行性变化,SUI的女性可见阴部神经对尿道横纹肌和盆底肌肉的传导延迟及对尿道外括约肌失神经支配。大量的动物实验证实,阴部神经损伤与SUI的症状有直接的因果关系[3]。目前SUI的治疗方法有多种,但是从根本上改善神经肌肉的病理生理的治疗方式却并不多见。神经科学研究已经表明,神经营养因子是调节神经生长和存活的一类蛋白质。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是目前研究较多的一种神经营养因子,它对神经元有促进修复再生及支持、营养、保护的作用。研究发现,BDNF可以提高神经元轴突切断术后的存活。本研究旨在探讨阴部神经损伤后局部注入BDNF对压力性尿失禁模型大鼠漏尿点压力的影响及尿道外括约肌内BDNF表达的影响,为SUI的非手术治疗提供线索。
1 材料与方法
1.1 动物及分组 健康雌性SD大鼠40只,鼠龄6周,体重240~280 g。造模成功大鼠为36只,按照随机数字表法分为三组:BDNF组、生理盐水组、假损伤组各12只。三组大鼠一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 主要试剂与仪器 重组人脑源性神经营养因子(ProSpec-Tany)、兔抗鼠BDNF抗体(博奥森公司)、SABC(兔IgG)试剂盒(博士德公司);BL-420生物机能实验系统、BI-2000医学图像分析系统(成都泰盟科技有限公司)。
1.3 方法
1.3.1 模型建立与处理 卵巢切除+阴道扩张建立大鼠SUI模型[4-5]。造模2周后进行尿动力学检查及喷嚏实验。测定结束后,造模成功后大鼠按照随机数字表法分为三组,分离PN,用持针器夹住PN两次,每次持续30 s。BDNF组随后用10 μL微量加样器注入2 μL BDNF于神经损伤部位,丝线缝合[6],随后第4、6、8天分别于标记部位再次进行注射。生理盐水组也同样损伤PN后局部注入生理盐水,量及方法同上。假损伤组分离PN未损伤。注射2周后进行尿动力学检查[7]。
1.3.2 标本采集 处死大鼠,取出尿道括约肌组织,用无菌生理盐水冲洗后用4%多聚甲醛缓冲溶液固定24 h,行HE染色和免疫组化染色。
1.3.3 图像分析 显微镜观察免疫反应阳性的细胞在肌肉中的分布,BDNF蛋白免疫反应阳性物质呈棕黄色。应用BI-2000医学图像分析系统分析BDNF阳性反应灰度。阳性反应强度用积分光密度值表示。
1.4 统计学处理 采用SPSS 17.0软件对所得数据进行统计分析,LPP数据及积分光密度数值用(s)表示,采用单因素方差分析,LSD-t法进行组间比较,以P<0.05为差异有统计学意义。
2 结果
阴部神经损伤后2只大鼠在实验中死亡,BDNF组及生理盐水组各1只,最后进入统计数据的为34只。
2.1 三组HE染色结果的比较 生理盐水组(图C)与假损伤组(图A)相比,尿道全层变薄,结构不明显,肌层萎缩,肌纤维断裂及横纹肌致密程度明显下降。BDNF组(图B)与假损伤组(图A)相比,肌纤维疏松程度差异不显著。
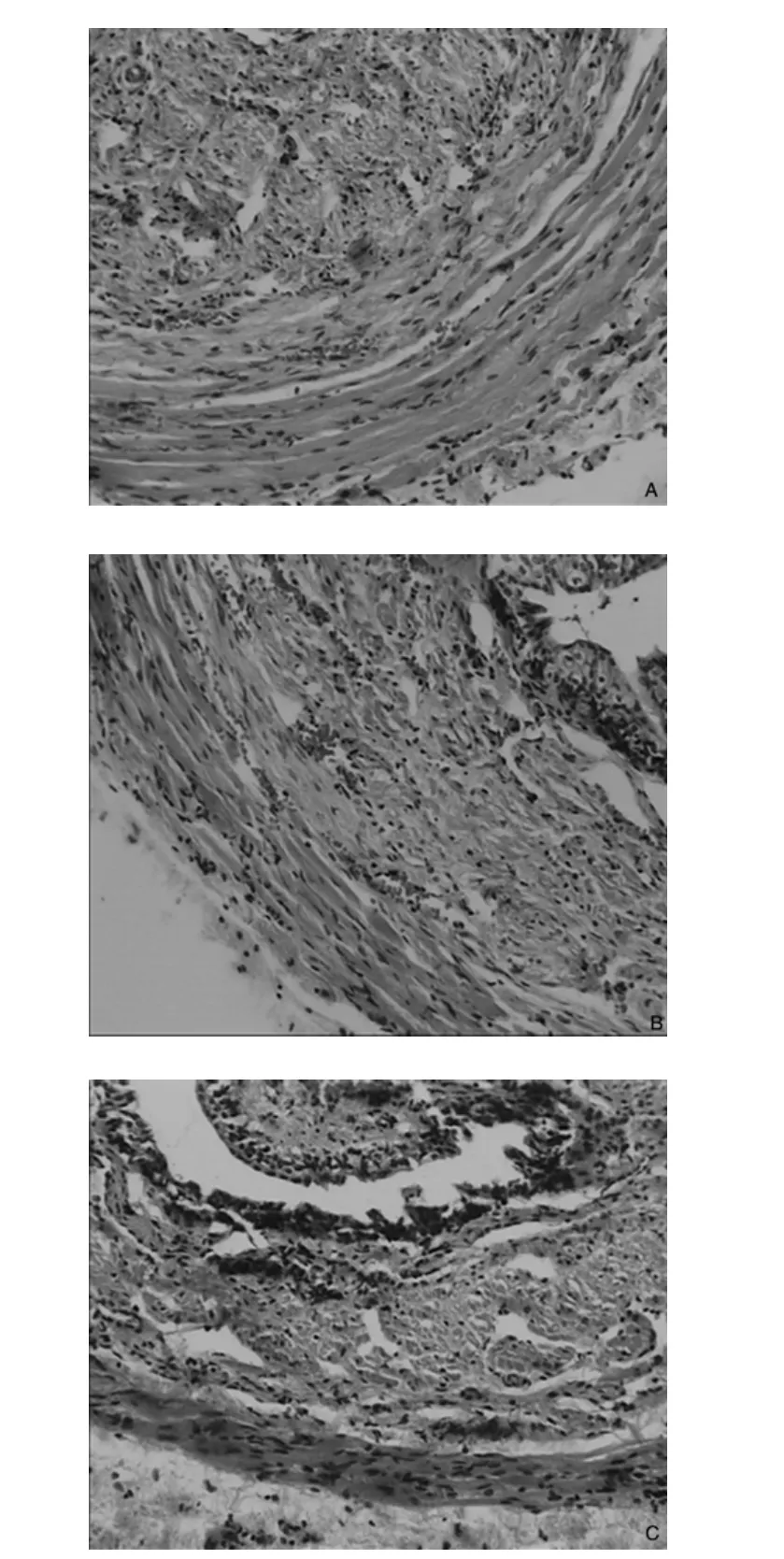
图1 大鼠尿道组织HE染色结果(HE×100)
2.2 三组尿动力学检查结果和免疫组化结果的比较 PN损伤后,统计学分析显示,生理盐水组LPP明显低于BDNF组和假损伤组,差异均有统计学意义(P<0.05);而BDNF组与假损伤组比较差异无统计学意义(P>0.05)。免疫组织化学染色阳性区域显色为棕黄色至棕褐色。通过图像分析系统得到积分光密度值,积分光密度数值与BDNF含量成正比。免疫组化结果显示,假损伤组括约肌内BDNF含量低,与BDNF组及生理盐水组比较差异均有统计学意义(P<0.05),BDNF组与生理盐水组括约肌内BDNF含量比较差异无统计学意义(P>0.05),见表2。
表2 三组尿动力学检查结果和免疫组化结果的比较(s)
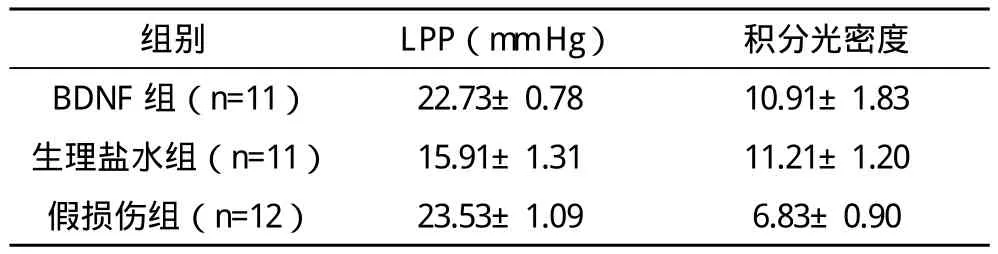
表2 三组尿动力学检查结果和免疫组化结果的比较(s)
组别 LPP(mm Hg)积分光密度BDNF 组(n=11)22.73±0.78 10.91±1.83生理盐水组(n=11)15.91±1.31 11.21±1.20假损伤组(n=12)23.53±1.09 6.83±0.90
3 讨论
压力性尿失禁有“社交癌”之称,严重影响女性的社交活动并能引起心理障碍,给家庭和国家医疗服务增加了沉重的经济负担[8]。盆底神经退行性变化或失神经支配的肌纤维逐渐纤维化的神经损伤学机制与SUI的发病密切相关。引起盆底功能障碍的原因有妊娠、阴道分娩等。有学者研究发现,80%经阴道分娩的女性存在阴部神经损伤和盆底肌去神经支配现象。妊娠、阴道分娩使盆底肌过度扩张,牵拉神经纤维引起严重损伤,这会使其支配的肌肉发生去神经改变,如肌肉萎缩、角型化,无去神经支配的肌肉则代偿性肥大。如果肌肉获得再神经支配,则肌纤维恢复正常大小,但是同型纤维聚集变得明显,而无再神经支配的纤维逐渐被纤维化取代。治疗压力性尿失禁的方法除手术方法外,目前正在探索非手术治疗方法。尿道高活动性或盆腔器官脱垂是可以通过手术进行治疗的引起压力性尿失禁的机械性病因,但手术治疗多以改善临床症状为目的[9]。对于括约肌损伤,目前认为最佳的治疗方式为注射填充剂、物理治疗、再生疗法,例如干细胞治疗。但是在阴部神经损伤存在的情况下,针对神经再生的治疗可能是更为有利的治疗方法[10-11]。
LPP统计学分析显示,生理盐水组LPP低于BDNF组和假损伤组,差异均有统计学意义(P<0.05),提示BDNF在神经损伤修复方面有作用。BDNF组漏尿点压力低于假损伤组,可能与BDNF剂量或注入时间及神经恢复时间有关,但是差异无统计学意义(P>0.05)。实验中发现损伤阴部神经后大鼠漏尿点压力比大鼠造模成功后漏尿点压力有所下降,提示阴部神经损伤与大鼠压力性尿失禁有关。
BDNF是神经营养因子家族重要成员之一,具有促进神经细胞生长、分化和损伤细胞修复的作用,并且能够有效地阻止多种神经元的死亡。BDNF可防止损伤神经元乙酰胆碱转移酶减少和促进神经细胞轴突的再生,同时增加靶细胞及神经元细胞本身合成BDNF及增强BDNF逆轴索运输到胞体发挥营养作用,这有利于重建突触联系及促进运动神经元存活。外源性BDNF可改善运动神经纤维传导速度及腹侧神经根轴突髓磷脂变性,从而保护运动神经元。
本研究显示,生理盐水组与假损伤组相比,尿道全层变薄,肌纤维排列较为稀疏,肌层萎缩,肌纤维断裂及横纹肌致密程度有所下降。BDNF组与假损伤组相比,肌纤维疏松程度差异不显著,推测BDNF对损伤PN的修复有作用。假损伤组BDNF表达含量低于BDNF组及生理盐水组,差异均有统计学意义(P<0.05),证实大鼠周围神经损伤后神经支配靶器官内源性BDNF表达上调[12]。这提示妊娠、分娩等因素造成的盆底神经失支配在一段时间后会有某种程度的恢复或许与盆底神经靶器官BDNF表达增加有关。
免疫组化显示,假损伤组BDNF含量最低,与BDNF组及生理盐水组比较差异均有统计学意义(P<0.05),这提示局部神经损伤后靶器官内BDNF含量增加。BDNF组与生理盐水组比较,BDNF组内BDNF含量少于生理盐水组,但是差异无统计学意义(P>0.05),可能与BDNF促进神经再生有关。根据研究,BDNF应该可以应用于压力性尿失禁发生时的盆底神经损伤,尤其是压力性尿失禁发生初期,如果及时进行损伤神经的修复,肌纤维失神经支配后的一系列变化就可能不会发生。因此,BDNF的治疗可能可以改善PN损伤后神经肌肉节制机制的功能恢复。
实验表明,局部补充神经营养因子对于促进神经再生是有效的,这为压力性尿失禁的治疗提供参考依据。但是局部注射BDNF有一定的局限性,例如注射部位及剂量均不易掌握,因此可以利用微型渗透泵来为神经损伤部位提供匀速、均量的持续营养,这有待于进一步研究。
[1]Zhu L,Lang J,Liu C,et al.The epidemiological study of women with urinary incontinence and risk factors for stress urinary incontinence in China[J].Menopause,2009,16(4):831-836.
[2]Lifford K L,Townsend M K,Curhan G C,et al.The epidemiology of urinary incontinence in older women:incidence,progression,and remission[J].Journal of the American Geriatrics Society,2008,56(7):1191-1198.
[3]戴毓欣,朱兰,郎景和.盆腔器官脱垂相关因素研究进展[J].中国实用妇科与产科杂志,2009,25(5):392-394.
[4]Cannon T W,Wojcik E M,Ferguson C L,et al.Effects of vaginal distension on urethral anatomy and function[J].BJU Int,2002,90(4):403-407.
[5]Kuo H C.Effects of vaginal trauma and oophorectomy on the continence mechanism in rats[J].Urol Int,2002,69(1):36-41.
[6]Damaser M S,Broxton-King C,Ferguson C,et al.Functional and neuroanatomical effects of vaginal distention and pudendal nerve crush in the female rat[J].J Uro,2003,170(3):1027-1031.
[7]Stach-Lempinen B,Hakala A L,Laippala P,et al.Severe depression determines quality of life in urinary incontinent women[J].Neurourol Urodyn,2003,22(6):563-568.
[8]朱兰,郎景和,刘春燕,等.我国成年女性尿失禁患病状况的流行病学研究[J].中华妇产科杂志,2009,44(10):776-779.
[9]Ostergard D R.Ostergard’s urogynecology and pelvic floor dysfunction[M].Lippincott Williams & Wilkins,2008:225-262.
[10]Latthe P M,Foon R,Khan K.Nonsurgical treatment of stress urinary incontinence (SUI):grading of evidence in systematic reviews[J].BJOG:an International Journal of Obstetrics & Gynaecology,2008,115(4):435-444.
[11]Carr L K,Steele D,Steele S,et al.1-year follow-up of autologous muscle-derived stem cell injection pilot study to treat stress urinary incontinence[J].International Urogynecology Journal,2008,19(6):881-883.
[12]Omura T,Sano M,Omura K,et al.Different expressions of BDNF,NT3,and NT4 in muscle and nerve after various types of peripheral nerve injuries[J].Journal of the Peripheral Nervous System,2005,10(3):293-300.
