聚乙二醇/β谷甾醇双接枝壳聚糖共聚物纳米粒的体外释放与体内分布考察
2014-06-07凌柏
凌 柏
(江苏省盐城市第一人民医院药剂科,江苏 盐城 224001)
近年来,纳米技术在医药领域得到了广泛的应用,以高分子材料包裹化学治疗药物制成载药纳米粒可以达到缓释、靶向给药的目的,减少药物的毒副作用[1]。如用脂质体包裹阿霉素,已在临床上得到了应用,但脂质体本身靶向分布不理想,且包封率低、稳定性差。因此,寻找更佳的载体材料是目前的一个研究热点。两亲性聚合物能在水性介质中通过自组装方式形成纳米粒子。该纳米粒具有独特的核壳结构,适合作为疏水性药物的载体;并且由于增强了渗透性和阻留效应,能在肿瘤病变部位富集,实现对肿瘤组织的“被动靶向性”,用作抗肿瘤药物的载体时能增加药物疗效,降低药物毒副作用。壳聚糖[2]是目前已知的天然多糖中唯一的碱性多糖,具有无毒性、无刺激性、无免疫原性、可降解性及优良的生物相容性,同时由于它含有某些有助于细胞黏附和保持细胞分化功能的信息,因此,壳聚糖及其衍生物已广泛应用于纳米给药载体[3-11]。本研究中以β谷甾醇为疏水组分、聚乙二醇(PEG)为亲水组分接枝至壳聚糖,制备了一种新型壳聚糖衍生物——PEG/β谷甾醇双接枝壳聚糖(PSC),在水中PSC可自组装形成以β谷甾醇为疏水核心、PEG为亲水外壳的核-壳结构的纳米粒。PEG是亲水柔性大分子,在纳米粒外层形成的亲水层可减弱血浆蛋白的吸附,减少肝、脾中巨噬细胞的吞噬,使纳米粒在血液中具有“长循环”能力,而“长循环”能力是实现主动靶向的前提。β谷甾醇是人体需要的物质,具有很好的安全性和生物相容性,同时还可抑制胆固醇的吸收,维持胆固醇水平,降低动脉粥样硬化的可能性。本研究中主要对PSC纳米粒的自组装性能及体内组织分布进行了初步的探索与评价。
1 仪器与试药
F-4600型荧光分光光度计(日本Olympus公司);DF-Z型集热力磁力加热搅拌器,KQ-ZOOKD型高频率数控超声清洗器(昆山超声仪有限公司);SHZ-82型旋转气浴恒温振荡器(上海比朗仪器有限公司);SCMO旋转蒸发仪(上海中生科技有限公司);冷冻干燥机(北京博医康实验仪器有限公司);85-1型恒温磁力搅拌器(常州国华仪器有限公司);MIKRO-200R型高速冷冻离心机(德国Hettich);XW-80A型微型旋涡混合仪(上海泸西分析仪器厂有限公司)。
PSC(实验室自制);聚乙二醇1000(PEG1K,西陇化工股份有限公司,CP,批号为120315);聚乙二醇2000(PEG2K,西陇化工股份有限公司,CP,批号为120730);香豆素-6,罗丹明B(上海紫一试剂厂,AR,批号为 20130225);丁二酸酐(CP,≥99.0%,批号为 T20100412);β 谷甾醇(>75.0% ,批号为 A1203123);叶酸,四氢呋喃(THF,≥99.0%,批号为 T20111028);N,N-二甲基甲酰胺(DMF,批号为 T201110511);草酰氯(阿拉丁,CP,≥98.0%,批号为T200880325);氢化钙(阿拉丁,AR,批号为C1201027);甲烷磺酸(阿拉丁,99.0%,批号为39004);乙酸乙酯,甲醇,无水乙醇等其他试剂均为分析纯。
2 方法与结果
2.1 PSC及其纳米粒制备
PSC:将PEG1K及PEG2K溶于二氯甲烷,加入丁二酸酐及DMF,加热回流12 h;旋转蒸干后,加入乙酸乙酯重结晶2次,沉淀析出时抽滤,滤饼晾干得羧化PEG;将羧化PEG溶于二氯甲烷,加入草酰氯,回流反应12 h,旋转蒸干得PEG酰氯。将β谷甾醇溶于二氯甲烷,加入丁二酸酐及DMF,加热回流12 h。旋干,加入蒸馏水搅拌,抽滤,滤饼干燥得羧化β谷甾醇;将羧化β谷甾醇溶于二氯甲烷,加入草酰氯,回流反应12 h,旋干,即得β谷甾醇酰氯。将壳聚糖溶于甲烷磺酸,先后加入β谷甾醇酰氯与PEG酰氯,50℃搅拌2 h,冰浴下加入适量蒸馏水终止反应,混合液转入透析袋(截留相对分子质量3 500)透析至中性,抽滤,滤液冻干,即得PSC。
空白和载香豆素-6的PSC纳米粒:取适量PSC样品,分散于水中,室温搅拌2 h,冰浴下以脉冲式超声仪超声20 min(输出功率100 W,工作2 s,间歇2 s),即得空白PSC纳米粒悬液。取适量PSC与香豆素-6,溶解于乙醇中,搅拌30 min,装入透析袋(截留相对分子质量3 500)透析12 h,即得载香豆素-6的PSC纳米粒悬液。
2.2 临界聚集浓度(CAC)测定
采用稳态荧光探针法,考察PSC纳米粒在水溶液中的CAC。将PSC分散于水中,超声溶解,稀释至不同质量浓度(1.0×10-3~1.0 ×10-1g/L),备用。精密量取 50 μL 芘的甲醇溶液(6.0 ×10-4mol/L),置5 mL容量瓶中,氮气吹干。精密量取5 mL不同浓度的纳米粒悬液,分别加至吹干的容量瓶中,超声1 h。激发波长λex=337 nm,激发波长狭缝宽度5 nm,发射波长狭缝宽度10 nm,以荧光分光光度计记录各样品的发射光谱。以样品在发射波长为384 nm和373 nm波长处荧光强度的比值 I384/I373对样品质量浓度 C(g/L)的对数值logC作图,计算PSC纳米粒的CAC值。结果见图1。芘是一种脂溶性荧光探针,在极性环境中的荧光极弱,而在非极性环境中的荧光很强,故当水中有纳米粒或疏水结构域生成时,芘分子自发由水相向疏水结构域转移,其荧光强度显著增加。由图 1 可见,在低质量浓度时,PSCI384/I373值为 1.9~2.2,与芘在水中的比值接近,且变化不大;当质量浓度逐渐增大时,I384/I373突然降低,变化的转折点所对应的质量浓度为PSC的CAC。计算得PSC的CAC值为0.02 g/L,低于许多两亲性小分子物质的临界胶束浓度。
2.3 载药量与包封率测定

图1 芘发射光谱 I384/I373与PSC质量浓度的关系
精密称取一定量的PSC与香豆素-6(质量为 M0),溶解于乙醇中,搅拌30 min,装入透析袋(截留相对分子质量3 500)透析12 h,将得到的载香豆素-6的PSC纳米粒悬液用0.45 μm微孔滤膜过滤,精密测定滤液体积 V。取0.5 mL滤液,与4.5 mL甲醇混匀,超声5 min,12 000 r/min,离心10 min,上清液用荧光分光光度计测定香豆素-6的荧光强度,根据标准曲线得到香豆素-6浓度 C。另取1 mL滤液,冷冻干燥后精密称定质量 M。计算载药量(loading capacity,LC)和包封率(encapsulation efficiency,EE),LC(%,w/w)=[(C×V×10)/(M×V)]×100%,EE(%,w/w)=[(C×V×10)/M0]×100%。结果PSC纳米粒对香豆素-6的包封率为75%,载药量为3.3%,表明透析法可有效将香豆素-6载入纳米粒内核。
2.4 PSC纳米粒体外释放行为考察
以疏水性荧光物质香豆素-6为模型药物,采用透析法制备载香豆素-6的PSC纳米粒,以pH=7.4的磷酸盐缓冲液(PBS)为释放介质,考察其体外释放行为。
标准曲线绘制:将香豆素-6稀释成质量浓度分别为0.024 4,0.012 2,0.006 1,0.004 1,0.003 1,0.001 5,0.001 2 μg/mL 的甲醇溶液,采用荧光分光光度计(λex=446 nm,λem=510 nm,λex和λem的狭缝宽度均为10 nm)测定不同质量浓度香豆素-6溶液的荧光强度,绘制标准曲线,线性回归方程为 Y=169 991 X+7.26,R2=0.999 7(n=7)。结果表明,香豆素 -6 质量浓度在0.001 2~0.024 4 μg/mL范围内与荧光强度呈良好线性关系。
方法专属性考察:在相同条件下(λex=446 nm,λem=510 nm,λex和λem的狭缝宽度均为10 nm),用荧光分光光度计检测空白PSC纳米粒溶液与释放介质,考察对香豆素-6的测定是否有干扰。结果在相同荧光光度计测定条件下,PSC空白纳米粒及释放介质PBS对香豆素-6的测定无干扰。
释放度测定与释放曲线绘制:采用透析法漏槽条件考察载药胶束的体外释放情况。将载香豆素-6的PSC纳米粒溶液装入透析袋(截留相对分子质量3 500),再浸入装有PBS(pH=7.4)100 mL的烧杯中,置恒温振荡器中,37℃,100 r/min振摇。分别于 15 min,30 min,1 h,2 h,3 h,4 h,6 h,8 h,10 h,12 h,24 h 时将释放介质全部取出,更换新鲜的PBS 100 mL;同时,从取出的100 mL释放介质中精密吸取10 mL,用乙酸乙酯萃取3次,合并3次的有机层,旋转蒸发器挥干溶剂,残渣用5 mL甲醇溶解后用荧光分光光度计检测。根据标准曲线计算出每个时间点的释放量,得累积释放量及累积释放率,以时间为横坐标、累积释放率为纵坐标作香豆素-6的释放曲线图,见图2。可见,载香豆素-6的PSC纳米粒在30 min累积释放率约为23%,4 h约为56%,8 h约为68%,24 h约为98%,呈现出先突释后缓释的特点,具有一定的缓释能力。
2.5 载药PSC纳米粒组织分布考察
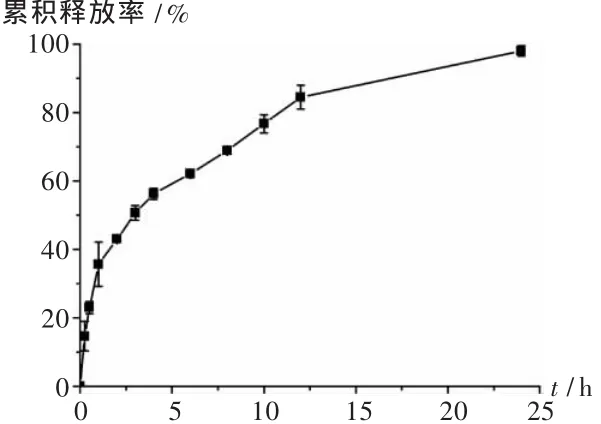
图2 载香豆素-6的PSC纳米粒释放曲线图(n=3)
药品准备:将100 mg PSC1K溶于2.5 mL乙醇中,并加入5 mg香豆素,搅拌30 min,装入10 cm的透析袋中(截留相对分子质量3 500),透析12 h,过滤,冷冻干燥,取干燥品配成质量浓度为5 g/L的溶液。载药PSC2K纳米粒的处理方法相同。
给药设计及样本制作:取昆明小鼠18只(雌性,平均体重为18 g),随机分为6组,每组3只。前3组小鼠尾静脉注射载药PSC1K纳米粒溶液0.3 mL,后3组小鼠尾静脉注射载药PSC2K纳米粒溶液0.3 mL。于给药后1,4,8 h摘眼球取血,置以1%肝素抗凝的EP管中。随即颈椎脱臼处死小鼠,迅速取出心、肝、脾、肺、肾、脑,生理盐水洗去残余血液,去除多余结缔组织,滤纸吸干,称重后装入EP管。所有样品均置冰箱内保存,备用。
样本处理与检测:取各组织样品0.1 g(不足0.1 g的按实际质量),加0.7 mL生理盐水匀浆;匀浆液中加入2.8 mL甲醇,涡旋5 min,14 000 r/min离心 10 min;取上清0.2 mL用甲醇稀释10倍后荧光分光光度计检测。
标准曲线绘制:配置质量浓度为 0.001~0.03 μg/mL 的香豆素甲醇溶液,用荧光分光光度计测定不同溶液的荧光强度。以香豆素甲醇溶液质量浓度对荧光强度进行线性回归分析,绘制标准曲线。香豆素线性回归方程为 Y=299 680X+94.672,R2=0.999 4。
组织分布:PSC1K溶液和PSC2K溶液经小鼠尾静脉注射后,以不同时间各组织中香豆素-6的含量来评价制剂在小鼠体内的组织分布。结果见图3。可见,PSC1K纳米粒尾静脉注射后,在各个组织的分布量于1 h达峰值,之后随着时间的延长药物分布量呈下降趋势。给药1 h时,各组织中肺的药物分布量最高,其次是肝、脾;PSC2K纳米粒尾静脉注射后,在各组织的分布量在1 h达峰值,之后随时间的延长药物分布量呈下降趋势。给药1 h时,各组织中心的药物分布量最高,而在2 h时心的药物分布量迅速降低。

图3 纳米粒小鼠体内的组织分布直方图
3 讨论
由图1可见,本试验中合成的PSC具有较小的CAC值,说明PSC纳米粒具有较强的势力学稳定性。用药时,即使被血液稀释到很低的浓度,依然能保持纳米粒结构,避免了药物的泄漏,保障了用药安全。
PSC1K溶液和PSC2K溶液经小鼠尾静脉注射,以不同时间各组织中香豆素-6的含量来评价制剂在小鼠体内的组织分布,了解载药PSC1K纳米粒及载药PSC2K纳米粒小鼠体内的组织分布情况(图3)。本试验发现,PSC1K纳米粒尾静脉注射后,在各个组织的分布量在1 h达峰值,之后随着时间的延长呈下降趋势;给药1 h时,各组织中肺的药物分布量最高,其次是肝、脾。这可能是由于PSC纳米粒带正电,与肺黏膜表面的负电荷基团相互作用,导致肺中药物分布量较高。肝、脾作为单核细胞吞噬系统的主要器官,对注射入体内的微小粒子具有吞噬作用,因此这两个组织中药物分布量也较高。肾与心的药物分布量很低,表明PSC纳米粒给药不会造成肾毒性和心脏毒性。与此同时,PSC2K纳米粒尾静脉注射后,与PSC1K相似,在各个组织的分布量在1 h达峰值,之后随着时间的延长呈下降趋势;给药1 h时,各组织中心的药物分布量最高,而在2 h时心脏的药物分布量迅速降低,这可能是由于残留在心脏的血液未被清洗干净,而血中的药物分布量较高所致。PSC2K在肺、肝、脾中的分布量较高,但与PSC1K相比,其被肝、脾摄取的量下降,这可能是因为PSC2K修饰了更长的PEG链,对避免被单核细胞吞噬系统吞噬具有更强的保护作用。值得注意的是,PSC2K与PSC1K相比,在脑部的药物分布量显著提高,一方面可能是由于PSC2K的循环时间更长,另一方面可能相对分子质量为2 000的PEG更容易与血脑屏障的细胞膜融合而使纳米粒跨血脑屏障。
总之,本试验成功地考察了新型两亲性壳聚糖衍生物PSC在水中自组装形成纳米粒的性能及组织分布。PSC作为一种新型的载药胶束,在水中可自组装成纳米粒;临界聚集浓度为0.02 g/L,具有较强的稳定性;载药量为3.3%,包封率为75%,能够有效包载香豆素,显著增加其溶解度。载香豆素-6的PSC纳米粒在30 min累积释放率约为23%,4 h约为56%,8 h约为68%,24 h累积释放率约为98%,表现为先突释后缓释的特点,具有一定的缓释能力。载药PSC纳米粒在肺部浓度较高,可能由于其荷正电与负电性的肺黏膜相互作用造成;由于巨噬细胞的吞噬在肝、脾中浓度也较高,修饰较长链的PEG可减少被肝、脾的吞噬;同时,修饰较长链PEG的纳米粒比修饰短链PEG的纳米粒在脑部的分布有所增加;两种PSC纳米粒在肾、心中分布均较少。上述结果表明,PSC胶束作为疏水性的抗癌药物载体,具有良好的发展前景。
[1]吉顺莉,张春燕,戈延茹.纳米载药系统的研究进展[J].中国药业,2010,19(14):82 - 83.
[2]蒋挺大.壳聚糖[M].第2版.北京:化学工业出版社,2006:12.
[3]Liu WG,Sun SJ,Zhang X,et al.Self- aggregation behavior of alkylated chitosan and its effect on the release of a hydrophobic drug[J].J Biomater Sci Polymer Edn,2003,14(8):851 - 859.
[4]Liu CG,Desai KGH,Chen XG,et al.Linolenic acid - modified chitosan for formation of self- assembled nanoparticles[J].J Agric Food Chem,2005,53(2):437-441.
[5]Zhang J,Chen XG,Li YY,et al.Self- assembled nanoparticles based on hydrophobically modified chitosan as carriers for doxorubicin[J].Nanomedicine,2007,3(4):258 - 265.
[6]Lee KY,Jo WH,Kwon IC,et al.Structural determination and interior polarity of self-aggregates prepared from deoxycholic acid-modified chitosan in water[J].Macromolecules,1998,31(2):378 - 383.
[7]Wang YS,Liu LR,Jiang Q,et al.Self-aggregated nanoparticles of cholesterol-modifiedchitosan conjugate as a novelcarrier of epirubicin[J].Eur Polym J,2007,43(1):43 - 51.
[8]Kim K,Kwon S,Park JH,et al.Physicochemical characterizations of self-assembled nanoparticles ofglycolchitosan-deoxycholic acid conjugates[J].Biomacromolecules,2005,6(2):1 154 - 1 158.
[9]Park JH,Kwon S,Nam JO,et al.Self- assembled nanoparticles based on glycol chitosan bearing 5β - cholanic acid for RGD peptide delivery[J].J Control Release,2004,95(3):579 - 588.
[10]Zhang C,Ping QN,Zhang HJ,et al.Preparation of N -alkyl-O -sulfate chitosan derivatives and micellar solubilization of taxol[J].Carbohyd Polym,2003,54(4):137 - 141.
[11]Sajeesh S,Sharma CP.Novel pH responsive polymethacrylic acid - chitosan - polyethylene glycol nanoparticles for oral peptide delivery[J].J Biomed Mater Res B,2006,76B(2):298 - 305.
