基因工程菌发酵表达核苷磷酸化酶条件的优化
2014-11-08黄炯威莫世艺梁剑锋刘桂祯
黄炯威,莫世艺,刘 宁,梁剑锋,刘桂祯
(1.开平牵牛生化制药有限公司,广东 江门 529339;2.厦门大学生命科学院,福建 厦门 361000)
核苷类似物的合成主要有化学合成法、碱基修饰法和生物转化法3种方法[1],前两者工艺步骤多、反应条件苛刻、周期长、总收率偏低、成本居高不下,而酶法具有反应条件温和、反应专一性强、副反应少、产物容易分离纯化等优点。核甘磷酸化酶已被广泛用于酶法合成抗肿瘤、抗病毒的核苷类似物[2]。核苷磷酸化酶可分为嘌呤核苷磷酸化酶(PNPase,EC2,4,2,1)和嘧啶核苷磷酸化酶(PyNPase,EC2,4,2,2)[3]。此酶能可逆地催化核苷(或脱氧核苷)磷酸化反应[4]。利用核苷磷酸化酶已成功合成了阿糖腺苷(Ara2A)、2'- 脱氧腺苷(2'- Deoxyade nosine,dAR)、三氮唑核苷(Ribavirin)、5-氟尿苷(5-FUR)等。但利用含有核苷磷酸化酶的天然菌株合成核苷类药物存在酶量小的缺点,构建基因工程菌的方法可从根本上解决酶量问题。本实验室获得了2株含嘌呤核苷磷酸化酶与嘧啶核苷磷酸化酶基因的工程菌,对产酶条件进行了详尽地研究。通过优化工程菌的产酶条件,现1 L发酵液可得2 g以上的酶蛋白,解决了酶的来源问题,为酶法合成核苷类似物提供了坚实的基础。
1 材料与方法
1.1 材料
BMR-A50U型50 L发酵罐(上海傲中生物工程设备有限公司);JY92-11N型超声波细胞粉碎机(宁波新艺超声设备有限公司);VE-180型电泳槽(上海天能公司),WD-9413B型凝胶成像分析仪(北京六一仪器厂)。菌种Gne01(PNPase工程菌)、菌种Gne02(PyNPase工程菌)为本实验室自有;异丙基硫代半乳糖苷(IPTG,Merck公司);培养基为LB培养基;其他检测用试剂为国产分析纯。
1.2 方法[5]
培养方法(摇瓶):在500 mL三角瓶中装入60 mL含单磷酸卡那霉素的LB培养基,按2%的量接入种子液,在适宜温度培养一定时间后加入IPTG诱导蛋白表达,培养完成后收获菌体。
菌体测定方法:取一定量的发酵液置离心管中,以4 000 r/min的速率离心10 min,倒出上清液,称量离心沉淀的菌体质量,计算出单位发酵液中菌体的质量。
总蛋白测定方法:收获的菌体用超声波粉碎机破碎,以4 000 r/min的速率离心15 min,取上清液为待测样品,以牛血清白蛋白(BSA)配制标准蛋白溶液,按考马斯亮蓝(Bradford)法制作标准曲线及检测样品的蛋白含量。
表达量测定方法:取蛋白测定样品进行SDS-PAGE电泳,再进行凝胶成像扫描分析,结合总蛋白测定结果可计算出目标蛋白表达量。
50 L发酵罐发酵方法:根据摇瓶培养试验结果,设计了L9(34)的正交试验方案,其中选择了培养温度、诱导开始时间、诱导浓度和诱导时间为主要考察因素进行条件优化,研究50 L发酵罐的最佳发酵条件。
2 结果
2.1 酶表达影响因素考察
诱导时间:接种后,在摇瓶培养4 h时加入0.4 mmol/L的IPTG诱导,然后继续培养10 h,每1 h取样检测菌体量和蛋白表达量,结果见图1。可见,菌体在诱导后继续快速生长,到诱导后8 h菌体量和蛋白表达量达最高,时间再长菌体量和蛋白表达量都会有小幅度下降,因此诱导后培养8 h菌体量和蛋白表达量均达到了高水平。
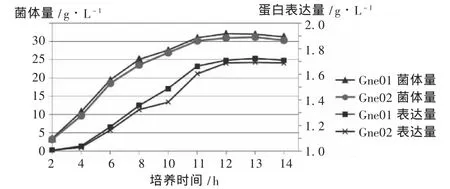
图1 不同诱导时间对菌体量和蛋白表达量的影响
诱导时机:接种后,在摇瓶培养 2,3,4,5,6 h时分别加入0.4 mmol/L的IPTG诱导,继续培养8 h,培养完成后检查菌体量和蛋白表达量,结果见图2。可见,诱导时机对菌量和表达量有较明显的影响,诱导太早会明显影响菌体生长,从而影响蛋白的表达,诱导太晚虽然对菌体量影响不明显,但明显降低了蛋白表达量。因此,最佳的诱导时机是在培养4 h时进行诱导。
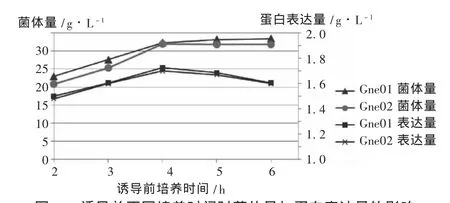
图2 诱导前不同培养时间对菌体量与蛋白表达量的影响
起始pH:配制不同起始pH的LB培养基,按2%的量接入种子液,在32℃培养4 h后加入IPTG诱导蛋白表达,再培养8 h后收获菌体检测菌体量和蛋白表达量,结果见图3。可见,试验范围内培养基起始pH的变化对菌体量和蛋白表达量的影响比较轻微,其中以起始pH在7.0~7.2为最佳条件。
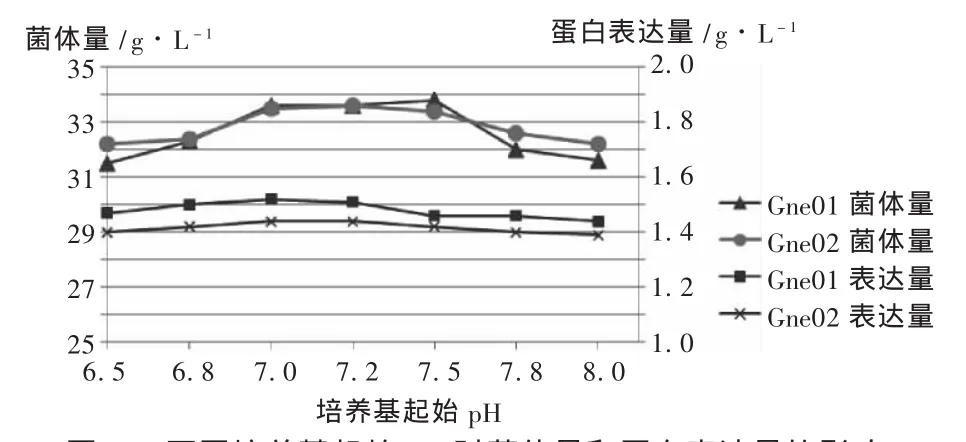
图3 不同培养基起始pH对菌体量和蛋白表达量的影响
培养温度:接种后分别在 28,30,32,35,37 ℃培养 4 h,诱导后再培养8 h后收获菌种,检测菌体量和目标蛋白表达量,结果见图4。可见,培养温度对菌体量和蛋白表达量均有影响,在一定范围内,温度越高菌体量越大,蛋白表达量越多,但温度越高表达蛋白时越容易形成包涵体,因此培养温度在30℃时为最佳条件。

图4 不同培养温度对菌体量和蛋白表达量的影响
诱导剂浓度:摇瓶接种后在32℃培养4 h,分别加入0.25,0.3,0.35,0.4,0.45,0.5 mmol/L IPTG 诱导,再培养 8 h 收获菌体,检测菌体量和蛋白表达量,结果见图5。可见,诱导剂浓度对菌体量和蛋白表达量影响比较明显,诱导剂浓度的提高可令表达量明显升高,当诱导剂达到0.4 mmol/L及以上时,蛋白表达量不再明显升高,但随诱导剂浓度升高菌体量有一定程度的下降,因此诱导浓度为0.4 mmol/L时菌体量和蛋白表达量可达到较理想的水平。

图5 不同诱导浓度对菌体量与蛋白表达量的影响
2.2 50 L发酵罐发酵条件优化(正交试验)
本试验采用 L9(34)正交试验方案,其中培养温度选择了30,32,35℃ 3个水平,诱导开始时间选择了3,4,5 h 3个水平,诱导浓度为 0.3,0.4,0.5 mmol/L 3 个水平,诱导时间为 8,9,10 h 3个水平,通过正交试验以较少的试验次数来研究50 L发酵罐的最佳发酵条件。试验结果见表1和表2。可见,4个考察因素中诱导浓度对表达量影响最大,其次是培养温度,影响最小的是诱导时间,为避免因温度高导致表达蛋白形成包涵体,最终确定50 L发酵罐的最佳反应条件是培养温度32℃,接种4 h后加入0.4 mmol/L IPTG诱导,诱导时间为9 h。

表1 Gne01菌种50 L罐发酵正交试验结果(n=9)

表2 Gne02菌种50 L罐发酵正交试验结果(n=9)
3 讨论
通过摇瓶培养试验考察了Gne01和Gne02 2个基因工程菌发酵条件,除了考察温度、pH等条件外,也重点考虑了外源蛋白表达的诱导时机、诱导剂的浓度和诱导时间等条件。由于外源蛋白的表达通常会抑制菌体生长,因此发酵条件优化非常重要。本次考察的2个基因工程菌蛋白表达条件试验中,诱导剂浓度和诱导的开始时间最重要,培养温度和诱导时间也对结果有较明显的影响,而培养基起始pH的影响较弱。
为进一步优化工程菌发酵条件,为核苷磷酸化酶的工业化生产应用进行更深入研究,根据摇瓶试验结果设计了正交试验方案进行50 L发酵罐的发酵工艺优化研究。结果显示,各研究因素中对结果影响由大到小依次为诱导剂浓度、培养温度、诱导时机和诱导时间。50 L发酵罐的最佳条件为起始pH为7.0~7.2,于32℃培养4 h,加入终浓度为0.4 mmol/L IPTG诱导9 h后收获菌体,每升发酵液可得2 g以上的较高水平的酶蛋白表达量,达到了工业化生产要求。
[1]樊华伟,傅绍军,邵志宇,等.核苷类药物酶法合成研究进展[J].生物技术通讯,2005,16(11):690 -692.
[2]张文伟,冯胜彦.生长温度对核苷磷酸化酶的影响[J].氨基酸和生物资源,1999,21(1):27-29.
[3]魏元刚,倪孟祥,葛亚文,等.来源于产气肠杆菌的嘧啶核苷磷酸化酶基因在大肠杆菌BL21中的表达[J].药物生物技术,2007,14(2):94-98.
[4]闫蓬勃,邱蔚然,丁庆豹.核苷磷酸化酶的产酶条件优化的研究[J].药物生物技术,2001,8(2):83-85.
[5]姜立春,罗 英,韩文君,等.嘧啶核苷磷酸化酶基因工程菌发酵条件的优化[J].生物技术通讯,2007,18(3):252 -254.
