人胰腺癌CD133+/ABCG2+肿瘤细胞亚群筛选及耐药性研究*
2014-06-04史坚强陈太平张国强曹根宝吴述良仇海燕
史坚强,陈太平,张国强,季 昶,曹根宝,吴述良,张 清,崔 磊**,仇海燕
(1.中国人民解放军第86医院外二科,安徽 马鞍山 243100 2.江苏大学附属医院普外科,江苏 镇江 212001)
胰腺癌恶性程度极高,确诊后生存率很低,是美国癌症病死亡原因的第四位或第五位,占胃肠道癌症死亡的1/5[1]。由于胰腺位于腹膜后,症状、体征的不明显和不典型使之难以得到早期治疗,临床治疗效果差[2],总的5年生存率仅为5%左右。目前,手术切除癌肿是治疗早期胰腺癌唯一有效的根治方法,而放化疗等综合性治疗的效果均不满意。因此,分子水平研究原发性胰腺癌的发生、发展和复发、转移及耐药性机制,已成为当今胰腺癌研究中的热点和难点。本研究拟利用流式细胞仪分选(FCM Sorting)技术从原代胰腺癌组织中分选出CD133+/ABCG2+的细胞群,并且通过相关实验来检测分析其特异性指标,从而确定该群细胞在胰腺癌发生、发展和转移中的作用,为后续肿瘤化疗药物的筛选提供有效模型。
1 材料与方法
1.1 CD133+/ABCG2+人胰腺癌亚群细胞的筛选:无菌条件下收集胰腺癌患者手术中切除的肿瘤组织,用PBS清洗组织2次,剪去除组织中的坏死组织等,将肿瘤组织浸泡于青霉素(1000U/mL)和链霉素(1000U/mL)混合液中10min。弃去浸泡液,将肿瘤组织剪成直径1mm的组织小块,然后加入5倍体积的胰酶消化液(0.25%胰酶含0.02%EDTA),于37℃环境下震荡消化30min。随后,加入5倍体积的含10%胎牛血清的细胞完全培养基加以终止,上下颠倒震荡使细胞脱落,过200目筛网,于1500r/min离心5min。收集细胞沉淀,加入100μL预冷的PBS缓冲液,随后加入rabbit anti-human CD133-FITC和rabbit anti-human ABCG2-PE monoclonal antibodies(eBioscience生物科技有限公司)各4μL,并于4℃环境中避光孵育30min。利用流式细胞仪(BD FACSAria,BD Bio-science,CA,USA)将CD133+/ABCG2+和CD133-/ABCG2-分选出来,并悬浮于无血清的干细胞培养基[DMEM/F12,10ng/mLbasic fibroblast growth factor(bFGF),10 ng/mL epidermal growth factor(EGF),5μg/mL insulin和0.5%bovine serum albumin(BSA),上述试剂均购于Sigma-Aldrich试剂公司]中,在37℃、5%CO2的环境中培养。
1.2 RNA抽提与实时荧光定量PCR(qRT-PCR)检测:按Tr-Izol Reagent说明书的步骤,抽提各组细胞的Total RNA,并且利用ReverTra Ace M-mLVReverse Transcriptase和寡核苷酸引物Oligo(dT)18经RT-PCR生成对应的cDNA。测定其浓度,-20℃保存。以上述反转录获得的cDNA作为模板,在Eppendorf RealPlex4(Eppendorf CO.,LTD)上,利用两步法进行qRT-PCR,根据相对定量法(mRNA的相对变化量Ratio=2-ΔΔCt︱ ΔΔCt=[ΔCt_CD133+/ABCG2+-ΔCt_CD133-/ABCG2-])计算目标片段的扩增比例。扩增产物以2%的Agrose Gel电泳进行分析。检测中设立空白对照(blank control),均以ddH2O作为模板,各样本设立3个重复,以18SrRNA作为内参。
1.3 免疫荧光(IF)鉴定:各组细胞用 PBS(0.02 moL/L,pH7.4)清洗2次,然后用4%多聚甲醛溶液常温下固定20min固定液,用封闭液(0.02mol/L PBS中加入0.2%Triton-100和5%正常山羊血清)在37℃下封闭60min。弃封闭液,用PBST(0.02mol/L PBS中加入0.2%Triton-100)漂洗3次,每次5min。弃废液,加入一抗(rabbit anti-human Oct3/4 antibody;rabbit anti-human Nanog antibody;Santa Cruz公司),于37℃下孵育45min。反应完毕后,用PBST漂洗3次,每次10min,然后加入荧光标记二抗(goat anti-rabbit Cy3-conjection antibody;Santa Cruz公司)及DAPI,于37℃下避光孵育45 min。反应结束后,用PBST漂洗3次,用50%丙三醇封片,荧光显微镜观察拍照。
1.4 软琼脂(Soft Agar)克隆集落形成实验:在42℃水浴中,将存储浓度为1.2%的低熔点琼脂糖与2×细胞完全培养基以1:1(v/v)混合,形成终浓度0.6%的底层琼脂,取1.4mL加入6孔板的一个孔中。待完全凝固后,取对数期细胞吹打成单细胞悬液,并调细胞浓度为2×104/mL。再将存储浓度为0.6%的低熔点琼脂糖与2×细胞完全培养基以1:1(v/v)混合,形成终浓度为0.3%的上层琼脂,取1.0mL上层琼脂与0.1mL细胞悬液充分混匀,加入已有下层琼脂的6孔板中,待其凝固后,置于37℃、5%CO2的细胞培养箱中培养3周,计算细胞克隆集落形成率。
1.5 MTT比色法检测肿瘤干细胞耐药性:各组细胞接种于96孔细胞培养板中(密度为2×103)。在药物组孔中分别加入30nmoL/μL的顺铂和35nmoL/μL的吉西他滨,而阴性对照组中分别加入等体积的PBS缓冲液,置于37℃,5%CO2环境中分别培养24,48,96h。在检测前的 4h 加入 MTT 20μL(5mg/L),继续培养4h。离心去上清且加入DMSO溶解沉淀。用酶标仪在490nm处读取所对应的吸光度值(D490),设立3个复孔,取其平均值。测得各孔吸光度数值,利用公式:(1-实验组D值/对照组D值)×100%,计算出药物对于细胞的增殖抑制率。
1.6 Western blot检测:收集各组细胞,根据 Western blot Kit说明书中的步骤,抽提各组细胞的总蛋白,利用Lowry法测定总蛋白浓度,以每个泳道20μg浓度的蛋白样品上样,经30%变性SDS-PAGE电泳后,利用半干电转化法将蛋白转移至PVDF膜上,经过封闭、一抗(稀释倍数1:1000)孵育、PBST洗脱、HRP标记的二抗(稀释倍数1:500)孵育、PBST再洗脱等步骤后,ECL化学发光及X光片暴光,并且经定影显影处理,获得清晰条带。利用BandScan软件分析各条带的A值。
1.7 裸鼠致瘤实验:收集各组细胞、离心、收集沉淀,利用冰预冷的PBS重悬细胞,调整至细胞密度为10000/μL。取2只裸鼠(购自上海斯莱克实验动物中心),分别于背部皮下组织注射20μL细胞悬液,其中1只注射CD133+/ABCG2+细胞,另1只注射CD133-/ABCG2-细胞。所有裸鼠均饲养于相同的环境(SPF级)中,每周观察一次背部瘤体形成情况。
1.8 亚硫酸氢钠处理及甲基化特异性PCR(MS-PCR)鉴定ABCG2启动子甲基化:抽提各组细胞的基因组 DNA,并按CpGeno-meTM DNA Modification Kit说明书的步骤完成基因组DNA的体外修饰。取各组细胞重亚硫酸盐修饰后的基因组DNA(2μL)作为模板,同时在PCR管中分别加入上下游引物(0.01nmoL)各0.5μL、2 × HotStart Taq PCR MasterMix 10μL 及ddH2O7μL,使得MS-PCR总反应体系为20μL。根据引物序列及PCR反应过程及温度进行MS-PCR检测。PCR反应完成后,其产物进行1.5%琼脂塘凝胶检测,并且利用BandScan软件分析各条带的A值。
2 结果
2.1 CD133+/ABCG2+亚群细胞高表达干细胞标志:本研究中,我们共收集了3例胰腺癌患者的手术切除肿瘤组织(编号为:PC1-PC3),都为胰腺导管腺癌,病理分期为Ⅱ期。通过胰酶消化和流式细胞分选技术,我们从胰腺癌组织中获取了CD133+/ABCG2+的细胞亚群。经过流式细胞仪检测发现,在胰腺癌原代细胞中,CD133+/ABCG2+细胞亚群所占的比例非常小,而绝大多数肿瘤细胞为CD133-/ABCG2-细胞(占总细胞数的)。原代的CD133+/ABCG2+和CD133-/ABCG2-均以无血清培养基在体外进行悬浮培养(suspended cultured),当传代至第9代的时候,CD133-/ABCG2-出现大量的死亡细胞,而CD133+/ABCG2+细胞成团生长,其中细胞颗粒小且密集,折光度好,显示出非常好的生长状态(图1)。我们利用qRT-PCR检测了各类细胞群干细胞生物标志(bio markers)表达情况,实验结果表明,CD133+/ABCG2+细胞群较CD133-/ABCG2-细胞群高表达SoX2、Oct4等干细胞标志(图2)。同时,Western blot和免疫荧光(IF)检测也同样显示了CD133+/ABCG2+细胞群较CD133-/ABCG2-细胞群高表达干细胞生物标志(图3)。实验证实,CD133+/ABCG2+细胞群具有典型的干细胞特性。
2.2 CD133+/ABCG2+亚群细胞在体外增殖能力明显增强且具有高侵袭性:选择第7代的细胞,每2d统计一次细胞的增殖数量,连续计算10d,统计结果表明,CD133+/ABCG2+细胞亚群自第4天起出现明显的增殖趋势,而CD133-/ABCG2-亚群细胞至第6天才进入增殖期。结果表明,CD133+/ABCG2+亚群细胞具有很强的自我增殖能力(图4)。同时,细胞克隆形成实验证实,CD133+/ABCG2+亚群细克隆形成能力明显高于CD133-/ABCG2-亚群细胞(图4)。
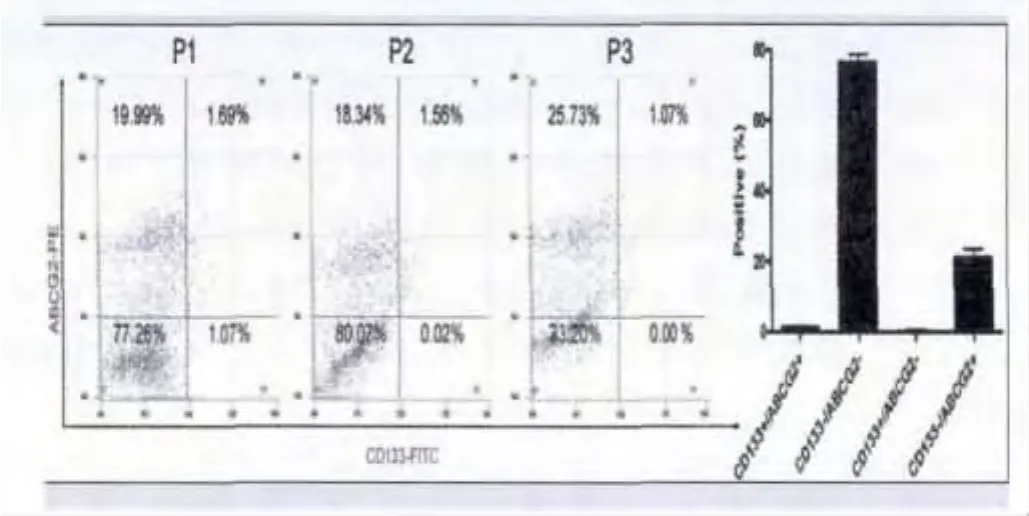
图1 CD133+/ABCG2+的细胞亚群
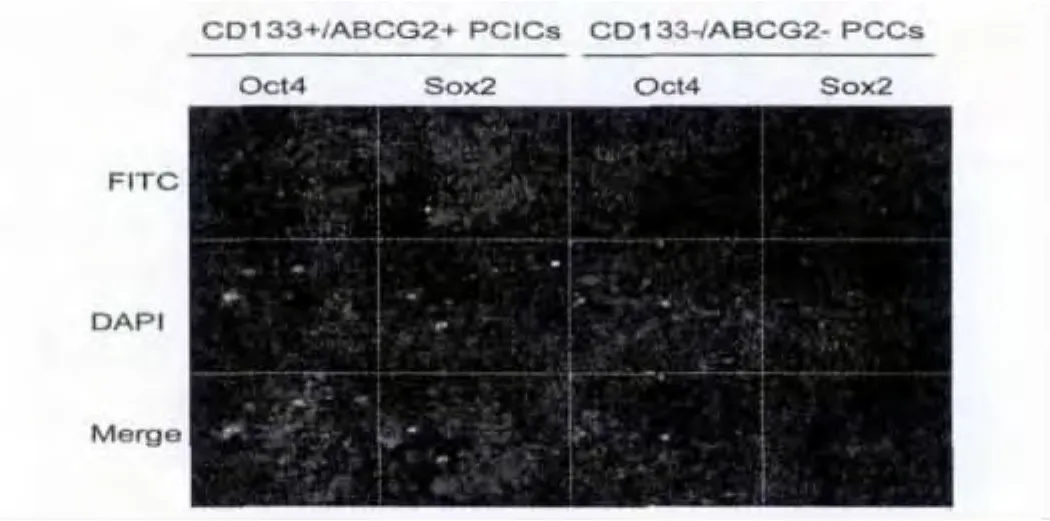
图2 CD133+/ABCG2+细胞群较CD133-/ABCG2-细胞群高表达SoX2、Oct4等干细胞标志
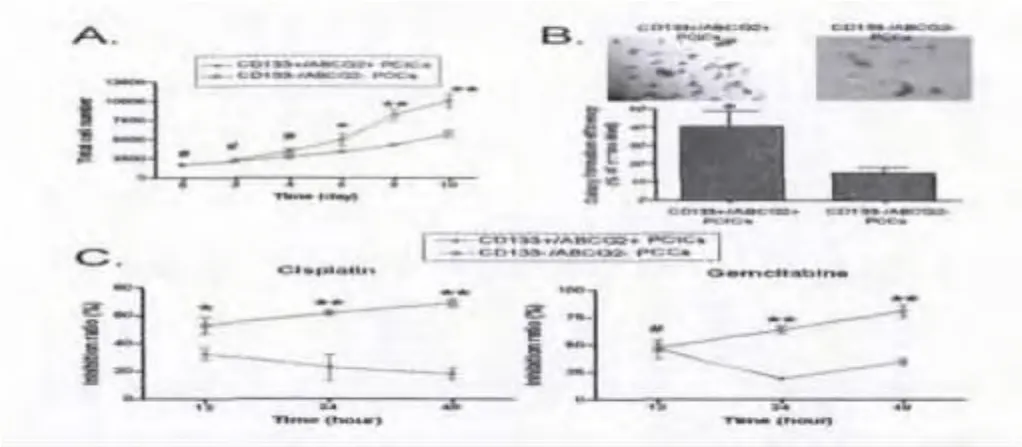
图3 A:0到10d不同组别胰腺癌亚群细胞的体外增殖检测(MTT);B:不同细胞亚群软琼脂集落形成;C:不同细胞对顺铂和吉西他滨耐受性的MTT检测
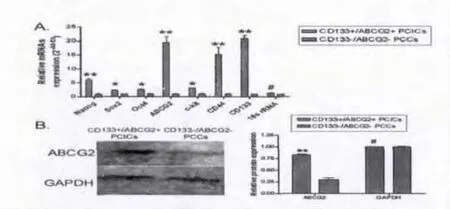
图4 A:qRT-PCR检测结果;B:Western blot检测结果。*P<0.05,**P <0.01,#P >0.05,n=3。
2.3 CD133+/ABCG2+亚群细胞具有高耐药性:MTT实验结果显示,在顺铂或吉西他滨药物刺激下,CD133-/ABCG2-细胞呈现出显著的增殖抑制现象,其增殖抑制强度与化疗药物刺激时间的长短具有明显的相关性(图4)。而CD133+/ABCG2+细胞对于顺铂或吉西他滨均表现出很好的耐受性,在各个时间点上,其增殖抑制率均显著低于CD133-/ABCG2-细胞。结果证实,CD133+/ABCG2+亚群细胞具有较高肿瘤细胞化疗药物耐受性。
2.4 CD133+/ABCG2+亚群细胞具有高致瘤性:选取少量的细胞(约为10000/μL)接种于裸鼠背部皮下。大约在8周之后,CD133+/ABCG2+细胞接种鼠的背部可以观察到有明显的瘤体产生,而接种CD133-/ABCG2-细胞的裸鼠背部相同位置上并未发现有瘤体。继续饲养2周,CD133+/ABCG2+细胞接种鼠的瘤体不断长大,而接种CD133-/ABCG2-细胞的裸鼠背部仍然未发现有瘤体长出(图5)。裸鼠体内成瘤实验说明,CD133+/ABCG2+细胞具有典型的肿瘤干细胞强致瘤性的特征。

图5 左:CD133-/ABCG2-细胞亚群注射组;右:CD133+/ABCG2+细胞亚群注射组;
2.5 多耐药基因ABCG2启动子区域在CD133+/ABCG2+亚群细胞中呈现去甲基化状态:两组细胞的基因组DNA经重亚硫酸盐处理后,以ABCG2启动子区甲基化和非甲基化特异性引物进行MS-PCR检测。实验结果显示,在CD133+/ABCG2+亚群细胞中,ABCG2非甲基化引物PCR结果呈现出阳性条带,而在CD133-/ABCG2-亚群细胞中,ABCG2非甲基化扩增的PCR产物则无明显条带,提示CD133+/ABCG2+细胞亚群中,ABCG2启动子区域存在去甲基化现象(图6)。该实验证实,CD133+/ABCG2+胰腺癌细胞中,由于ABCG2启动子去甲基化而导致其高表达,使其具有较强的化疗耐药性。该研究中,利用5-Aza-CdR(10μmol/L)处理细胞,作为MS-PCR检测的阴性对照。
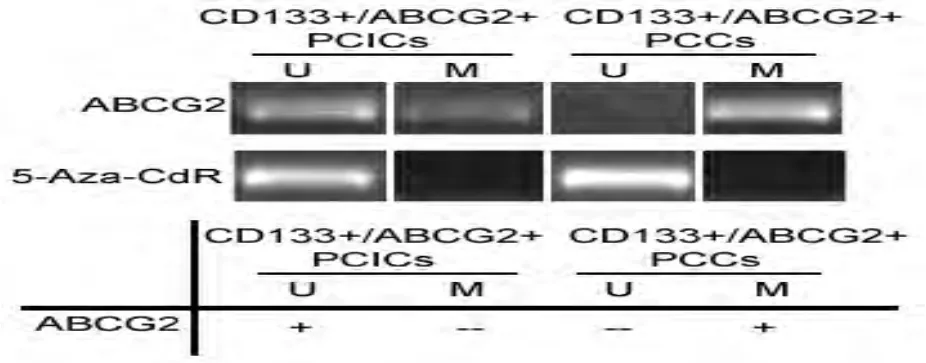
图6 ABCG2基因启动子区域CpG岛甲基化修饰检测
3 讨论
肿瘤学传统观点认为,肿瘤中每个瘤细胞都具有无限增殖和形成克隆瘤灶的的能力,但具体哪个瘤细胞能够形成新瘤灶是随机的。而现在颇受关注的“肿瘤干细胞(Cancer Stem Cell)学说”则对此种观点提出挑战。该学说认为,肿瘤组织中存在着一小群肿瘤干细胞(或起始细胞);其单个细胞即可发展为肿瘤,具有干细胞自我更新和多向分化能力等特征。此种学说还认为,肿瘤干细胞是恶性肿瘤形成的起始细胞,维持着肿瘤的生长,可能是肿瘤复发、转移、耐药机制的根源[3,4]。
利用流式细胞术来分选出具有特定分子标志的细胞群体是筛选肿瘤干细胞的经典方法。肿瘤学研究发现,肿瘤干细胞来源于一群边缘细胞群(Side Population,SP)[5,6],亦称之为侧群细胞。1996年Goodle等利用流式细胞术研究骨髓细胞的细胞周期时发现,经过Hoechst33342染色后并非所有的细胞都可发出蓝色荧光,而有大约不到0.1%的细胞并未被染料着色。然而,这群细胞却高度表达干细胞的标记sca1+/Lin-[7]。相关研究同时还指出,SP细胞之所以能够不被Hoechst33342染色,是由于其高度表达ABCG2蛋白。ABCG2蛋白全称为ATP结合G蛋白偶联超家族泵蛋白成员,其存在可以将一些小分子染料(Hoechst33342、罗丹明123等)及化疗药物等物质通过离子交换形式泵出细胞外,以避免这些物质对细胞生理生化活动的干扰。由此可见,在肿瘤细胞中,ABCG2蛋白的表达情况与肿瘤耐药性具有密切的联系;而肿瘤干细胞之所以高度耐药,与其细胞膜上ABCG2蛋白的过度表达关系密切[8]。
本试验中,利用流式细胞仪分选(FCM Sorting)技术从原代胰腺癌组织中分选出CD133+/ABCG2+的细胞群,并且通过细胞体外增殖实验、耐药性实验、软琼脂克隆形成实验、荧光定量PCR及Western Blotting分析其耐药性、干细胞标志、肿瘤克隆形成率及迁徙特性,结果表明该亚群细胞高表达干细胞标志物(如:Oct4、SoX2),和普通胰腺癌细胞相比,具有更强的侵袭性和克隆形成能力以及更强的化疗耐药性。另外裸鼠体内成瘤实验表明该亚群细胞具有更强的体内成瘤能力。随后,通过DNA甲基化检测证实,多耐药(multi-drug resistant)基因ABCG2启动子差异性甲基化是导致该细胞呈现出化疗药物耐受性的重要原因。
[1]Cartwright T,Richards DA,Boehm KA.Cancer of the pancreas:are we making progress A review of studies in the US oncology research network[J].Cancer Control,2008,15(4):308-313.
[2]吴庭安.吉西他滨联合希罗达治疗晚期胰腺癌的疗效比较[J].河北医学,2010,16(6):700-703.
[3]Bonnet D,Dick JE.Human acute myeloid leukaemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J].Nature Med,1997,3(7):730-743.
[4]Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA,2003,100(7):3983-3988.
[5]Haraguchi N,Utsunomiya T,Inoue H,et al.Characteriza-tion of a side population of cancer cells from human gastrointestinal system[J].Stem Cells,2006,24(3):506-513.
[6]Kondo T,Setoguchi T and Taga T.Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line[J].Proc Natl Acad Sci USA ,2004,101(3):781-786.
[7]Goodell MA,Brose K,Paradis G,et al.Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo[J].Exp.Med,1996,183(4):1797-1806.
[8]Hussain SZ,Strom SC,Kirby MR,et al.Side population cells derived from adult human liver generate hepatocytelike cells in vitro[J].Dig Dis Sci,2005,50(10):1755-1763.