注射用头孢地嗪钠生物安全性检查标准研究
2014-06-04张良蒲旭峰张德波
张良,蒲旭峰,张德波
(成都市药品检验所,成都 610045)
头孢地嗪是由德国发明的世界上第一个具有免疫增强功能的第三代头孢菌素,其通过抑制细菌细胞壁的合成发挥杀菌作用,对革兰阳性菌、阴性菌均有抗菌活性,对β内酰胺酶、头孢菌素酶和青霉素酶极稳定,临床主要用于链球菌属、肺炎球菌等敏感菌所致的肺炎、支气管炎、咽喉炎、扁桃体炎、肾盂肾炎、尿路感染、淋菌性尿道炎、胆囊炎、胆管炎、妇科感染、败血症及中耳炎等。《中国药典》2010年版二部收载了头孢地嗪钠及其制剂-注射用头孢地嗪钠[1,2]。本研究是考查四川制药制剂有限公司生产的仿制新药注射用头孢地嗪钠的生物安全性质量是否达到《中国药典》要求,并起草安全性检查标准[3-11],为其新药申报提供依据。
1 实验材料
1.1 药品
由四川制药制剂有限公司提供的注射用头孢地嗪钠,规格:1.0g,批号:121201、121202、121203;规格:2.0g,批号:121201、121202、121203。
1.2 试剂
鲎试剂:标示灵敏度(λ)0.25EU/mL,规格:0.1mL/支,批号:1108291;标示灵敏度(λ)0.125 EU/mL,规 格:0.1mL/支,批 号:1210121、1209231,湛江安度斯生物有限公司生产。标示灵敏度 (λ)0.25EU/mL,规 格:0.1mL/支,批 号:11111112;标示灵敏度(λ)0.125EU/mL,规格:0.1 mL/支,批号:12082812,福州新北生化工业有限公司生产。细菌内毒素检查用水,规格:50mL/支,批号1211020,含细菌内毒素<0.003EU/mL,湛江安度斯生物有限公司生产。细菌内毒素工作标准品(冻干)效价 160EU/支,规格10支/盒,批号150601-201174,中国药品生物制品检定所提供。氯化钠注射液,规格:500mL,批号:120713104,四川美大康佳乐有限公司生产。
1.3 动物
昆明种小鼠100只,清洁级,体质量17~21g,雌雄各半,雌性无孕;日本大耳白兔,普通级,体质量2.14kg,雄性,均由四川省实验动物专委会养殖场提供。实验动物生产许可证号:SCXK(川)2008-14。鼠和兔的全价颗粒饲料,由四川省实验动物专委会养殖场提供,其质量符合GB14924.1-2001《实验动物配合饲料通用质量标准》。小鼠雌雄分开饲养,每笼5只;日本大耳白兔在标准兔笼中单独饲养,动物使用许可证号:SYXK(川)2008-103。
2 方法与结果
2.1 异常毒性检查
2.1.1 小鼠LD50测定 采用Bliss法测定,取本品1批(1.0g,121203),用氯化钠注射液溶解并配制成0.110g/mL、0.130g/mL、0.153g/mL、0.180 g/mL、0.212g/mL的供试液;选取体质量为19~21g的小鼠,随机分为5组,每组10只,雌雄各半,静脉注射0.8mL/只测定。
测定结果:LD50(半数致死量):5.9403g/kg,X50(半数致死对数剂量):0.7738,SX50(标准误):0.0192,LD50的95%可信限(L95):5.4462~6.4791 g/kg。
回归方程Y:Y=-5.1185+13.0763×log(D),即:测得本品LD50=5.94g/kg;LD50的95%可信限为5.45~6.48g/kg。
2.1.2 异常毒性检查剂量设定 《中国药典》2010年版二部附录XIX M《化学药品注射剂安全性检查法应用指导原则》中对异常毒性限值设定,建议限值采用小于LD50可信限下限的1/4~1/8作为检查剂量,因此本品异常毒性检查限值可设定在1/4LD50~1/8LD50之间,即1.36 ~0.68g/kg。《中国药典》2010年版二部收载的“注射用头孢地嗪钠”异常毒性检查,供试液为0.1g/mL,按静脉法给药,即给药剂量为2.5g/kg,约相当于本品LD50的95%可信限下限的1/2。因此本品异常毒性检查剂量设定为药典标准中规定的剂量2.5g/kg。
2.1.3 异常毒性检查供试液的溶血与凝聚考查
取家兔心脏血,脱纤,离心洗涤至上清液不显红色,取分离红细胞用0.9%氯化钠注射液配成2%的混悬液备用。取本品加氯化钠注射液溶解并配制成0.1g/mL的溶液,依法操作。
结果:阴性和阳性管均成立,供试品管上层液与供试液颜色对照管(第4管)的溶液颜色接近,供试液未引起溶血与凝聚作用。即本品异常毒性检查的供试液不会引起溶血与凝聚作用。
2.1.4 异常毒性检查试验 取3批样品(规格2.0 g),分别加氯化钠注射液溶解并配制成0.1g/mL的溶液。取健康合格,体质量为17~20g的昆明种小鼠15只,雄性,分为3组,按静脉注射法分别给予相应的供试液,每只小鼠给药0.5mL,给药时间5 s,给药后立即观察(见表3)。
表3结果显示:给药后产生毒性反应的动物能在2min内完全恢复正常,给药后观察72h内均未出现死亡,且无异常现象。
2.1.5 异常毒性检查质量标准 试验表明,本品可以建立药典规定的异常毒性检查标准,给药剂量设定为2.5g/kg。取本品,加氯化钠注射液制成0.1 g/mL的溶液,依法检查(《中国药典》2010年版二部附录XIC),按静脉注射法给药。
2.2 细菌内毒素检查
2.2.1 鲎试剂灵敏度复核 以细菌内毒素检查用水溶解内毒素工作标准品,并配制成含内毒素2.0 λ、1.0λ、0.5λ、0.25λ系列浓度的溶液,依法进行加样操作。每一浓度平行做4支,同时用细菌内毒素检查,用水做2支阴性对照,记录结果,并按式λC=antilg(∑X/4)计算λC值(见表4)。
表4结果表明:每一批鲎试剂灵敏度测得值均在0.5~2.0λ范围内,符合要求。复核的鲎试剂可按标示灵敏度值使用。
2.2.2 样品内毒素限值(L)的确定 本品临床[用法用量]:静脉注射,1.0g溶于4mL注射用水,或2.0g溶于10mL注射用水中,于3~5min内注射;静脉滴注,1.0g或2.0g溶于40mL注射用水、生理盐水或林格氏液中,20~30min内输注(摘自本品临床使用说明书)。故本品临床使用的最大剂量为2.0g/(60kg·1h)计
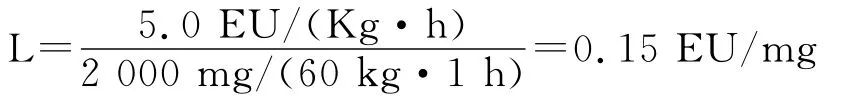
本品临床使用需用注射用水、生理盐水或林格氏液溶解,溶解液中含有一定内毒素;同时参考《中国药典》2010年版二部“注射用头孢地嗪钠”细菌内毒素检查标准,为了临床用药安全,将本品内毒素限值定为L=0.10EU/mg。
2.2.3 干扰试验预试验 取样品1批(规格1.0g,批号:121202),用细菌内毒素检查用水配制成10 mg/mL、5mg/mL、2.5mg/mL、1.25mg/mL、0.625mg/mL、0.3125mg/mL一系列浓度的供试液,依法操作进行试验(见表5)。
预试结果显示:本品供试液配制成>1.25mg/mL浓度可能对内毒素与鲎试剂的反应有抑制性干扰作用;供试液配制成≤1.25mg/mL浓度对反应可能无干扰。
2.2.4 供试品干扰试验 取本品规格为1.0g的样品3批,加细菌内毒素检查用水溶解并分别制成2.5mg/mL、1.25mg/mL浓度的供试液,然后分别用供试液和细菌内毒素检查用水分别复溶鲎试剂,各分为4列,每列4支。2种溶液复溶的鲎试剂的4列安瓿中相同方法分别加入含细菌内毒素工作标准品2.0λ、1.0λ、0.5λ、0.25λ的4种浓度溶液,同时各设阴性对照管2支,37℃恒温进行反应60min。观察结果,并按Es=antilg(∑X/4),Et=antilg(∑X/4)计算Es和 Et(见表6、表7)。
表6显示:3批样品配制成2.5mg/mL浓度,用湛江安度斯生产的鲎试剂试验,Es、Et均在0.5~2.0λ之间,且Et/Es=1,表明2.5mg/mL 浓度供试液对反应完全无干扰作用;用福州新北生产的鲎试剂试验,Es、Et均在0.5~2.0λ之间,但Et/Es=2,表明2.5mg/mL浓度供试液对反应有一定的抑制性干扰作用。
表7显示:3批样品配制成1.25mg/mL浓度,用湛江安度斯生产的鲎试剂进行试验,结果Es、Et均在0.5~2.0λ之间,且 Et/Es=1,表明1.25 mg/mL浓度供试液对反应完全无干扰作用;用福州新北生产的鲎试剂试验,Es、Et均在0.5~2.0λ之间,Et/Es<2,表明1.25mg/mL浓度供试液对反应基本无干扰作用。
2.2.5 细菌内毒素检查质量标准 取本品,用细菌内毒素检查用水配制成含头孢地嗪≤1.25mg/mL的溶液,依法检查(《中国药典》2010年版二部附录XI E),头孢地嗪中含内毒素的量<0.10EU/mg。2.2.6 样品内毒素验证检查 取供试品3批(规格2.0g),用细菌内毒素检查用水溶解并配制成浓度1.25mg/mL,用λ=0.125EU/mL鲎试剂(批号:1209231),按起草标准进行检查。每批试验取鲎试剂8支,每支加入0.1mL细菌内毒素检查用水溶解后,其中2支加入0.1mL供试液作为供试品管,2支加入用细菌内毒素检查用水配制的2.0λ内毒素工作标准品液0.1mL作为阳性对照管,2支加入细菌内毒素检查用水0.1mL作为阴性对照管,2支加入0.1mL供试品阳性对照溶液(用同1支内毒素工作标准品配制成的含2.0λ浓度的内毒素及含供试品的溶液)作为供试品阳性对照管。加完样分别轻轻混匀,垂直放入(37±1)℃试管恒温仪中,保温60min,取出,缓缓倒转180°,观察结果。结果实验均成立,供试品管呈阴性;3批样品的细菌内毒素检查符合规定。
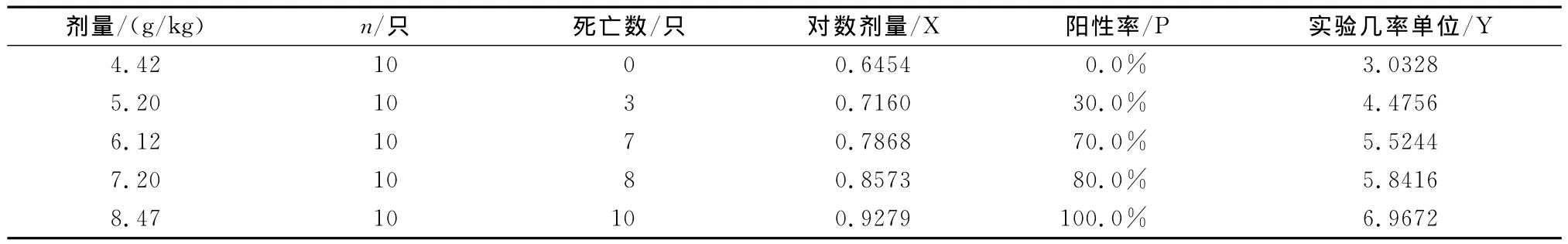
表1 注射用头孢地嗪钠LD50测定数据列表

表2 异常毒性检查供试液溶血与凝聚考查

表3 注射用头孢地嗪钠异常毒性检查结果

表4 鲎试剂灵敏度复核结果
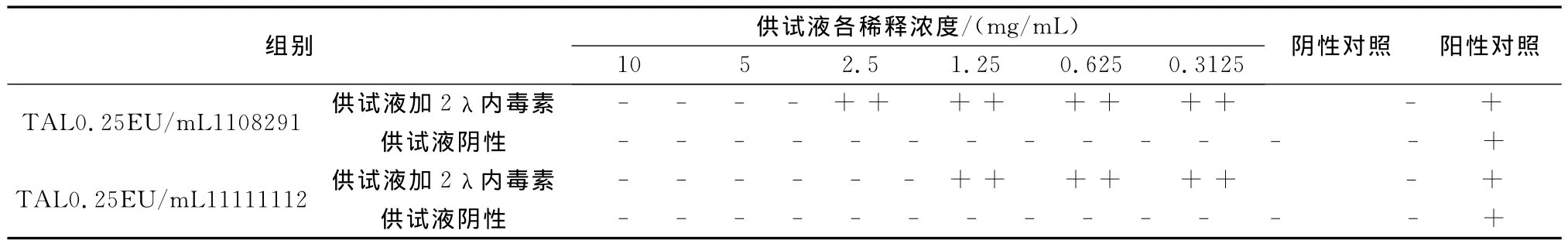
表5 注射用头孢地嗪钠细菌内素检查干扰试验预试结果

表6 注射用头孢地嗪钠细菌内毒素检查干扰试验结果(1)

表7 注射用头孢地嗪钠细菌内毒素检查干扰试验结果(2)
3 讨论
为了起草本品异常毒性标准,试验首先测定了本品半数致死量(LD50),根据LD50确定异常毒性检查剂量。测定本品LD50时发现,本品毒性与供试液浓度有较大关系,给予小鼠产生明显毒性的剂量,如果把供试液浓度减小,增加给药体积,动物的毒性反应明显减轻。
在设定异常毒性检查剂量时,根据标准从严的原则,设定为药典标准中收载品种规定的剂量2.5 g/kg。
对异常毒性检查的供试液进行溶血与凝聚考查,是为了考查供试液是否会引起强烈的溶血与凝聚作用,以避免异常毒性检查时动物发生的反应是由于供试液有较强的溶血与凝聚作用引起。
《中国药典》2010年版二部收载的注射用头孢地嗪钠细菌内毒素检查标准为:取本品,依法检查(《中国药典》2010年版二部附录XI E),头孢地嗪中含内毒素的量<0.10EU。本研究在起草标准时,明确了供试液浓度应≤1.25mg/mL,可避免实际检验工作的麻烦甚至错误。
由于《中国药典》2010年版二部中注射用头孢地嗪钠生物安全性检查标准只收载了异常毒性与细菌内毒素。因此,本研究未对降压物质等其他生物安全性检查标准进行研究。
[1]国家药典委员会.中国药典:二部[S].北京:中国医药科技出版社,2010:Appendix 98-212.
[2]国家药典委员会.中国药典:二部[S].北京:中国医药科技出版社,2010:The varieties 178-180.
[3]中国药品生物制品检定所.中国药品检验标准操作规范:2010年版[M].北京:中国医药科技出版社,2010,287.
[4]马剑文,韩永平,沈克温,等.现代药品检验学[M].北京:人民军医出版社,1994,834-836.
[5]张伟.关于中国药品标准化战略若干问题的思考[J].中国药品标准,2014,15(1):3-9.
[6]吴伟群,张德波.加替沙星氯化钠注射液细菌内毒素检查法研究[J].四川省卫生管理干部学院学报,2005,23(3):196-197.
[7]肖佳音,王春雨,刘海疆,等.盐酸吉西他滨注射液细菌内毒素检查法的可行性研究[J].中国药品标准,2014,15(1):39-45.
[8]周继春.氨茶碱注射液细菌内毒素检查方法的建立[J].中国药品标准,2013,14(1):38-40.
[9]张德波.利福平注射液生物安全性检查标准研究[J].中国现代应用药学,2013,30(5):514-518.
[10]李展,周继春.注射用硫普罗宁细菌内毒素检查法的建立[J].中国药品标准,2012,13(3):203-205.
[11]张德波.布洛芬细菌内毒素检查法研究[J].中国现代应用药学,2012,29(3):261-264.
