长江口海域悬浮颗粒有机物的稳定氮同位素季节分布与关键生物地球化学过程
2014-06-01于海燕俞志明宋秀贤刘丽丽曹西华袁涌铨
于海燕,俞志明,宋秀贤,刘丽丽,曹西华,袁涌铨
(1.中国科学院海洋研究所海洋生态与环境科学重点实验室,山东青岛 266071;2.中国科学院大学,北京 100039)
长江口海域悬浮颗粒有机物的稳定氮同位素季节分布与关键生物地球化学过程
于海燕1,2,俞志明1*,宋秀贤1,刘丽丽1,2,曹西华1,袁涌铨1
(1.中国科学院海洋研究所海洋生态与环境科学重点实验室,山东青岛 266071;2.中国科学院大学,北京 100039)
对2010年2、5、8、11月份长江口海域水体中的悬浮颗粒物进行稳定氮同位素分析。根据不同季节、不同区域内悬浮颗粒有机物的稳定氮同位素组成(δ15Np)值的变化研究水体中氮的迁移、转化等生物地球化学过程,揭示其环境行为,从而对该海域的氮循环机制进行探索。研究发现:长江口海域悬浮颗粒物的稳定氮同位素组成具有较宽的分布范围,δ15Np值分布范围为-1.1‰~8.6‰,具有明显的时空分布特点,反映了不同程度的陆源输入和氮的生物地球化学过程的影响。其中,2月份生物反应较弱,δ15Np分布体现了陆源和海源的混合特征;5月和11月份上层水体δ15Np随叶绿素a升高而降低,指示了生物的同化吸收作用;8月和11月δ15Np和总溶解无机氮呈现极显著正相关关系,说明该海域发生了氮的矿化再生。
氮稳定同位素;同化;矿化;硝化
1 引言
20世纪60年代以来,氮稳定同位素技术已被广泛应用于海洋学的研究[1];在海洋氮循环和海洋生物地球化学研究中,氮同位素有着不可替代的独特作用。悬浮颗粒有机物中稳定氮同位素组成的变化可以示踪氮的来源[2],判断氮的生物地球化学过程[3—5]。因此,利用悬浮颗粒有机物的δ15Np方法来研究海水体系中氮的迁移、转化等环境生物地球化学过程,揭示其环境行为,具有重要的科学意义和现实意义。
长江口的泥沙主要来自上游,多年平均输沙量为3.95亿t,年最大输沙量达6.78亿t[6]。长江输送的颗粒物质入海后,发生一系列迁移、转化,对氮的生物地球化学循环和河口生态环境产生重要影响。因此,研究长江口海域悬浮颗粒有机氮的来源、分布及其影响过程十分重要。近年来,关于长江和长江口地区颗粒有机物氮的来源、分布、δ15Np的分布特征及其对物源和沉积动力过程的指示等方面的研究较多[5,7—11],但对长江口不同区域悬浮颗粒有机氮的生物地球化学过程的综合分析较少[12—13],且多集中在对长江口表层海域进行研究,并未对深层海域发生的氮的生物地球化学过程进行探讨。长江口水文条件复杂,不同的区域水体中颗粒有机物的组成、影响条件等差异较大;通过比较分析悬浮颗粒物δ15Np在不同区域的分布及其变化特点,我们可以在一定程度上获得较详细的氮的来源和生物地球化学过程信息。
因此,本研究在2010年2、5、8、11月份对长江口海域进行了4个航次的调查,分析不同区域内悬浮颗粒物δ15Np的时空分布,研究影响其δ15Np变化的主要生物地球化学特征,从而对该海域的氮循环机制进行初步探索。
2 方法
2.1 采样站位
本研究的调查海域共设13个站位(如图1所示)。标记9、10、11、12、13、14的断面为断面A,21、22、23、24、25、26、27的断面为断面B。21号站靠近口门,且盐度通常小于1,故21号站用于代表口门内站位;9、10、22、23号站用于代表最大浑浊带;11、12、13、14、24、25、26、27站代表外海区。
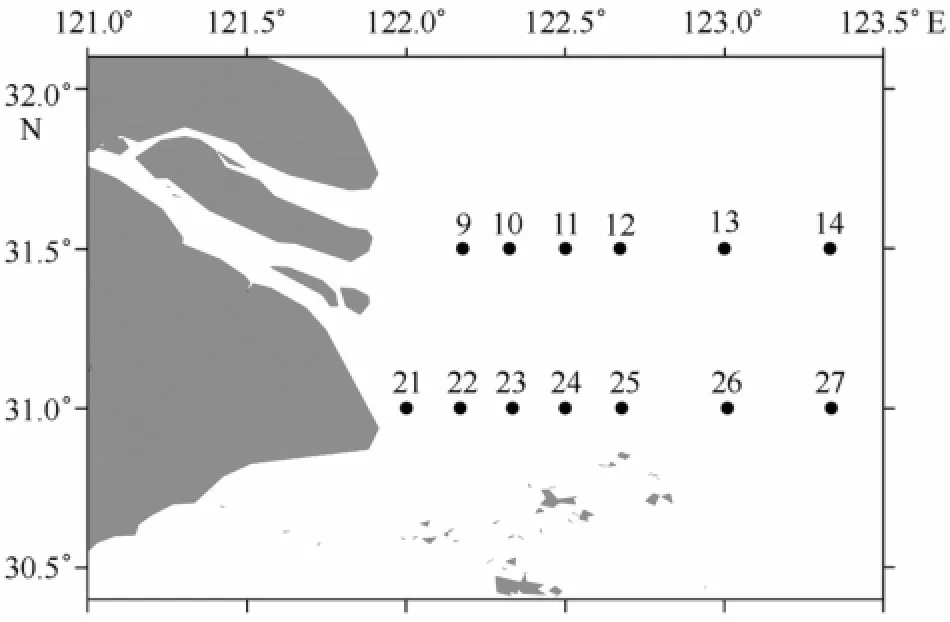
图1 长江口海域调查站位
2.2 样品采集
分别于2010年的2、5、8、11月,开展共4个航次的调查。在断面A、断面B各站位分别取表层、5 m、10 m、20 m、30 m、底层的样品。调查内容包括温度(T)、盐度(S)、溶解氧(DO)、硝酸盐(NO-3)、铵盐(NH+4)、亚硝酸盐(NO-2)、叶绿素a(Chl a)、悬浮颗粒态稳定氮同位素组成(δ15Np)。营养盐水样用经450℃高温灼烧过的GF/F滤膜过滤各站位海水,滤液装入100 m L聚乙烯瓶,加氯仿固定后冷冻保存。叶绿素a样品是将水样经450℃高温灼烧过的GF/F滤膜过滤,然后将滤膜置于冰箱中冷冻保存。δ15Np样品用450℃预处理过的GF/F滤膜过滤水样,然后将该滤膜在-20℃冷冻保存。
2.3 样品测定
硝酸盐、铵盐、亚硝酸盐浓度采用SKALAR SAN++SYSTEM营养盐流动分析仪测定,检测限为0.14μmol/L。溶解氧采用碘量滴定法现场测定,检测精度为7×10-5mg/L。叶绿素a的测定是将滤膜用丙酮萃取后,采用分光光度法测量[14],检测限为0.01 mg/m3。
δ15Np的测定方法:将滤膜在60℃下恒温烘干36 h,冷却至室温后取足量的悬浮颗粒物用锡箔包裹,然后通过自动进样盘送入元素分析仪-同位素质谱仪联机(flash EA1112+Finnigan MAT.Con HoⅢ)进行测量。δ15N测量误差为±0.2‰。
3 结果和讨论
3.1 长江口海域δ15Np的时空分布特征
2010年长江口海域4个季度的δ15Np垂直分布范围为-1.1‰~8.6‰,总体平均值为4.6‰。由表1可以看出,该结果与2005年和2006年长江口的调查结果相似,在文献报道值范围之内,与国外其他一些河口的δ15Np分布水平较一致。
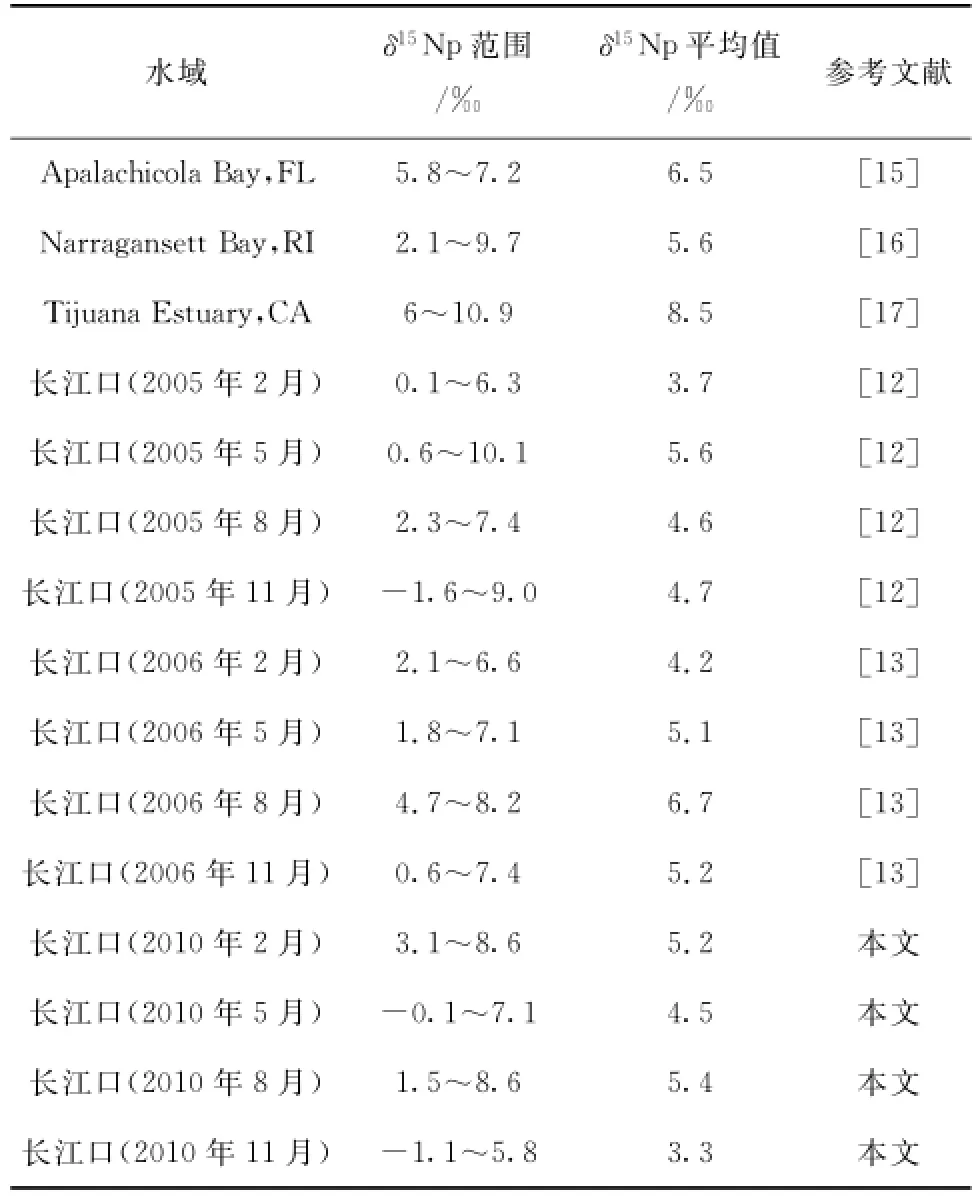
表1 长江口海域与其他水域水体中悬浮颗粒物的δ15Np值比较
长江口海域悬浮颗粒物的氮稳定同位素值在不同季节、不同区域、不同深度呈现不同的分布特点,如图2,图3,图4和表2所示。
2月份,水体中悬浮颗粒物δ15Np分布在3.1‰~8.6‰之间,平均为5.2‰(见表1)。δ15Np空间分布规律明显,随深度增加而增加。δ15Np高值主要分布在底层水域;低值主要分布在表层水域,分别在断面A的口门附近和断面B的外海区表层(图2)。从离散程度来看,2月份δ15Np的离散度最低(图3,图4,表2);从整体分布水平来看,2月份的δ15Np分布范围与8月份类似,比5月份和11月份要高。
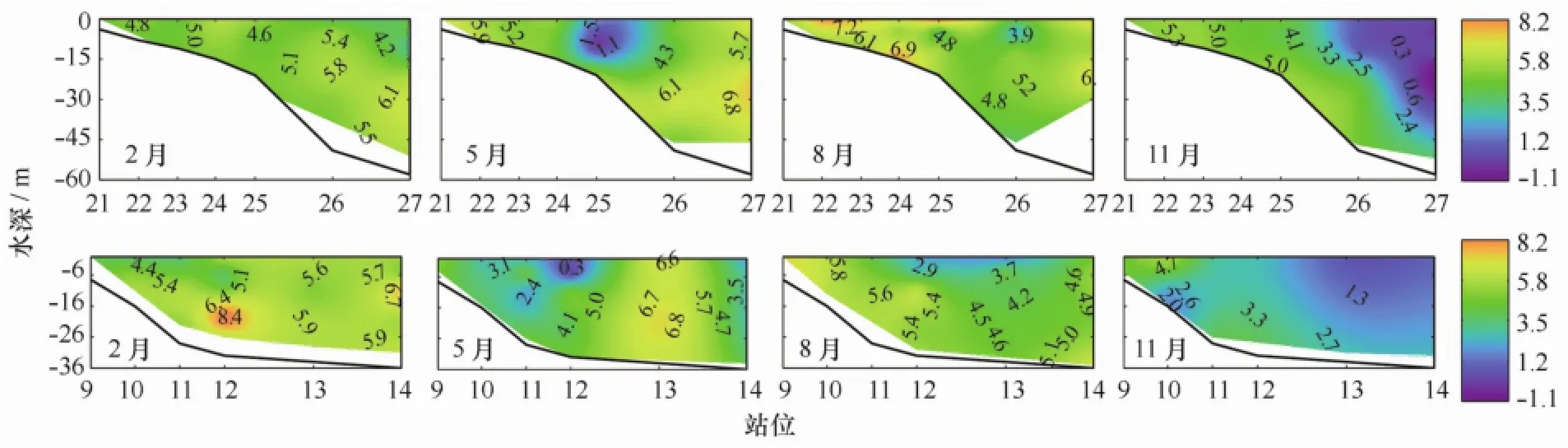
图2 2010年长江口海域不同季节水体中悬浮颗粒物δ15Np的空间分布(‰)特征
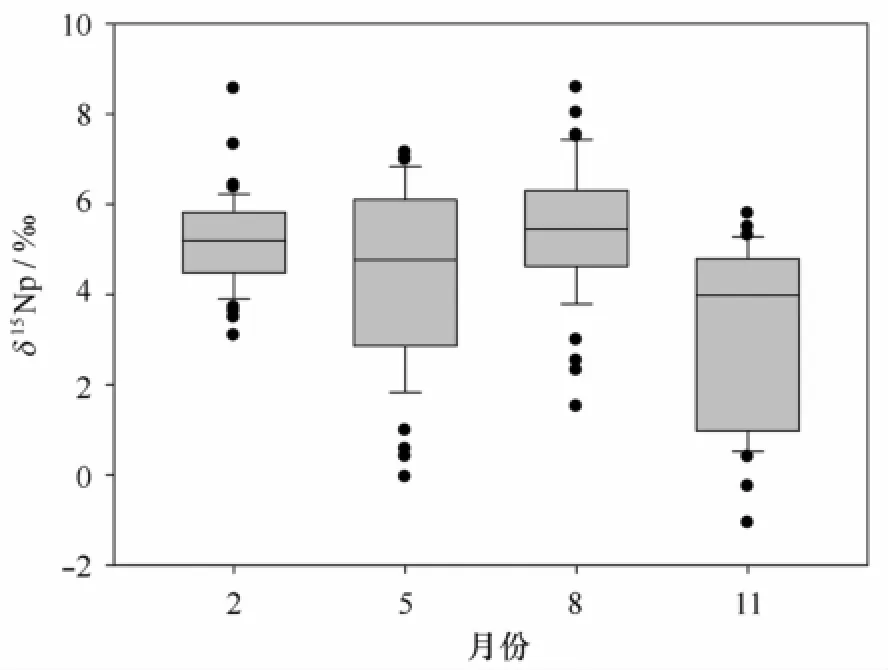
图3 2010年长江口水体悬浮颗粒物δ15Np的季节变化

图4 2010年各季节长江口水域表层(白色)和底层(灰色)悬浮颗粒物δ15Np的分布

表2 2010年长江口各区域水体中悬浮颗粒物的δ15N平均值(‰)及标准偏差(括号内为标准偏差)
5月份,水体中悬浮颗粒物δ15Np分布在-0.1‰~7.1‰之间,平均为4.5‰(见表1)。断面A的δ15Np空间分布呈现沿口门向外先升高后降低的趋势,而断面B的δ15Np空间分布呈现沿口门向外先降低后升高的趋势(图2)。较低的δ15Np值分布在靠近浑浊带的外海区。从离散程度来看,5月份δ15Np的离散度较高(图3),表层离散度明显高于底层离散度(图4),外海区离散程度高于浑浊带(表2);从整体分布水平来看,5月份的δ15Np分布范围较广,比2月份和8月份要低,比11月份要高(图3)。
8月份,水体中悬浮颗粒物δ15Np分布在1.5‰~8.6‰之间,平均为5.4‰(见表1)。断面A的δ15Np低值区分布在外海的上层水域,而近岸水域和外海底部水体都是δ15Np高值区。断面B的δ15Np值整体分布要高于断面A,表层和底层水体均未出现δ15Np低值区(图2)。从离散程度来看,8月份δ15Np的离散度较低(图3),表层离散度明显高于底层离散度(图4);从整体分布水平来看,8月份的δ15Np分布范围较广,与2月份类似,比5月份和11月份要高(图3)。
11月份,水体中悬浮颗粒物δ15Np分布在-1.1‰~5.8‰之间,平均为3.3‰(见表1)。δ15Np的空间分布规律呈现出自近岸到外海,自底层到表层降低的趋势(见图2)。较低的δ15Np值分布在远离浑浊带的外海区。从离散程度来看,11月份δ15Np的离散度较高(见图3,图4),外海区的离散程度高于浑浊带(见表2);从整体分布水平来看,11月份的δ15Np值最低,分布范围较广(见图3)。
3.2 长江口海域的氮的来源和循环过程
3.2.1 氮的来源
不同来源的氮δ15Np本底值范围不同,相关研究表明,大气沉降中的氮和农业化肥中氮的δ15Np值较低(分别为-12‰~5‰、-3‰~3‰)[18-19],而工业以及生活污水中的氮的δ15Np值较高(5‰~9‰)[20-21]。从表1中可以看出,不同季节长江口海域水体中δ15Np相对其他海域均较低,说明长江口海域氮的主要来源是农业化肥和大气沉降氮,而工业与生活污水输入氮相对较低。这一推论与沈志良等[22]对长江及长江口河水和雨水分析后得出的长江流域氮主要来源于化肥和大气沉降的结论一致。也与宋飞等[12]通过对长江口海域表层海水的δ15Np特征进行分析后得到的结论一致。
δ15Np值是不同氮来源及其发生的氮分馏作用的综合反映[23-24]。2月份,河口区生物作用较弱,悬浮颗粒物的组成主要来自陆源和海源,其稳定氮同位素值在一定意义上可以反映不同的物源信息。陆源有机质的δ15Np分布多在2.7‰附近[25-26],而海源有机质的δ15Np较高,平均值约为6.5‰[27]。如图5所示,2月份长江口海域水体中δ15Np与盐度具有良好的线性关系(R=0.419 7,p<0.01)。δ15Np从河口到外海逐渐增加,体现了不同物源贡献程度的差异。从河口到外海,悬浮颗粒物中陆源有机质的影响减小,而海源的影响增大。
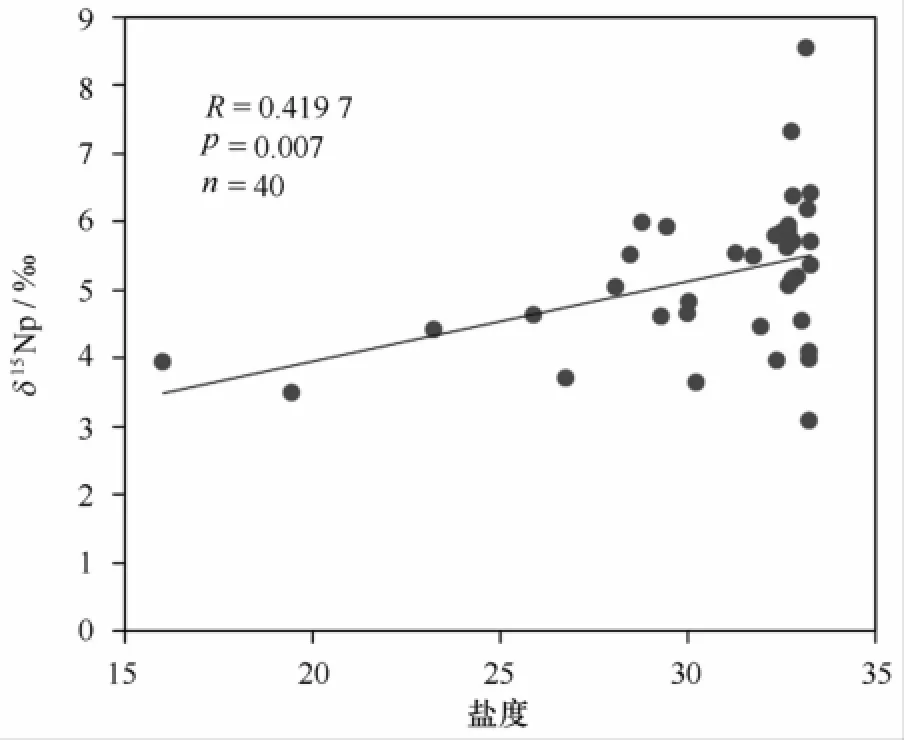
图5 2010年2月长江口水体悬浮颗粒物的δ15Np随盐度变化趋势
3.2.2 同化吸收
5月和11月长江口表层悬浮颗粒物的δ15Np随Chl a升高而降低(图6),呈现极显著负相关关系。这支持春季和秋季长江口水域表层主要发生了生物的同化吸收作用。因为同化吸收过程中,生物优先利用较轻的14N营养盐,使得δ15Np降低[28]。从图2可看出,5月和11月δ15Np低值分布区不同,5月15Np低值分布在靠近浑浊带的外海区,而11月15Np低值分布在远离浑浊带的外海区。造成这种现象的原因可能与盐度有关。刘秀娟等[13,29]通过对长江口表层悬浮颗粒物δ15Np特征及硝酸盐δ15N特征进行研究,也发现了5月和11月长江口表层发生了生物的同化吸收作用。

图6 2010年5月和11月长江口上层(0~5 m)悬浮颗粒物的δ15Np随Chl a变化趋势
3.2.3 矿化再生和硝化作用
长江口海域各季节底部水体的δ15Np均较上层水体的δ15Np高(见图2)。造成这种现象的原因,一是因为表层水体发生了生物的同化吸收作用;二是因为底部水体发生了氮的矿化再生过程。表层和底部水体不同的氮生物地球化学过程,主要是由于表层和深层海水中光照、温度及DO等水文条件的不同造成的。氮的矿化再生是将颗粒有机氮转化为溶解有机氮,最终转化为铵盐释放到水体中。在此过程中,由于14N优先被转化,因此剩余的颗粒物δ15Np会升高。已有研究发现长江口海域硝化作用的存在[30—31]。硝化作用将铵盐转化为亚硝酸盐进而转化为硝酸盐[32]。因此,在研究氮的再生时,需考虑总溶解无机氮与颗粒有机氮的关系。长江口海域8月和11月δ15Np和总溶解无机氮呈现极显著正相关关系(图7),说明该海域发生了氮的矿化再生。

图7 2010年8月和11月长江口水体悬浮颗粒物的δ15Np随DIN变化趋势
4 结论
长江口海域悬浮颗粒物的稳定氮同位素组成具有较宽的数值范围,δ15Np值分布范围为-1.1‰~8.6‰,与国外其他一些河口的δ15Np分布水平较一致。该区域δ15NpX值具有明显的时空分布特点,其变化趋势与陆源输入和水体中存在的氮的生物地球化学过程有关。
其中,2月份生物反应较弱,δ15Np分布体现了陆源和海源的混合特征;5月和11月份表层水体δ15Np随叶绿素a升高而降低,指示了生物的同化吸收作用;8月和11月δ15Np和总溶解无机氮呈现极显著正相关关系,说明该海域发生了氮的矿化再生。
[1]Altabet M.Isotopic tracers of the marine nitrogen cycle:Present and past[J].Marine organic matter:biomarkers,isotopes and DNA,2006:251—293.
[2]Mariotti A,Lancelot C,Billen G.Natural isotopic composition of nitrogen as a tracer of origin for suspended organic-matter in the scheldt estuary[J].Geochimica Et Cosmochimica Acta,1984,48(3):549—555.
[3]Ostrom E,Macko S,Deibei D,et al.Seasonal variation in the stable carbon and nitrogen isotope biogeochemistry of a coastal cold ocean environment[J].Geochimica Et Cosmochimica Acta,1997,61(14):2929—2942.
[4]Voss M,Nausch G,Montoya JP.Nitrogen stable isotope dynamicsin the central Baltic Sea:influenceof deep-water renewal on the N-cycle changes[J].Marine Ecology-Progress Series,1997,158:11—21.
[5]Zhou J,Wu Y,Zhang J,et al.Carbon and nitrogen composition and stable isotope as potential indicators of source and fate of organic matter in the salt marsh of the Changjiang Estuary,China[J].Chemosphere,2006,65(2):310—317.
[6]俞志明,沈志良.长江口水域富营养化[M].北京:北京科学出版社,2011:549.
[7]吴莹,张再峰.长江悬浮颗粒物中稳定碳,氮同位素的季节分布[J].海洋与湖沼,2002,33(5):546—552.
[8]刘敏,侯立军,许世远,等.长江口潮滩有机质来源的C,N稳定同位素示踪[J].地理学报,2005,59(6):918—926.
[9]周俊丽.长江口湿地生态系统中有机质的生物地球化学过程研究[D].上海:华东师范大学,2005.
[10]Wu Y,Dittmar T,Ludwichowski K,et al.Tracing suspended organic nitrogen from the Yangtze River catchment into the East China Sea[J].Marine Chemistry,2007,107(3):367—377.
[11]余婕,刘敏,许世远,等.长江口潮滩有机质稳定碳同位素时空分布与来源分析[J].地理研究,2008,27(4):847—854.
[12]宋飞,宋秀贤,俞志明.长江口海域表层水体颗粒有机物δ15N的分布特征[J].海洋与湖沼,2007(06):521—528.
[13]刘秀娟,俞志明,宋秀贤,等.长江口海域悬浮颗粒有机物的稳定氮同位素分布及其生物地球化学意义[J].海洋科学,2010(01):11—17.
[14]Parsons R,Maita Y,Lalli M.Manual of chemical and biological methods for seawater analysis[M].Pergamon,1984.
[15]Cole L,Valiela I,Kroeger K,et al.Assessment of a delta N-15 isotopic method to indicate anthropogenic eutrophication in aquatic ecosystems[J].Journal of Environmental Quality,2004,33(1):124—132.
[16]Mc Kinney R A,Nelson W G,Charpentier M A,et al.Ribbed mussel nitrogen isotope signatures reflect nitrogen sources in coastal salt marshes[J].Ecological Applications,2001,11(1):203—214.
[17]Kwak T,Zedler J.Food web analysis of southern California coastal wetlands using multiple stable isotopes[J].Oecologia,1997,110(2):262—277.
[18]Russell K,Galloway J,Macko S,et al.Sources of nitrogen in wet deposition to the Chesapeake Bay region[J].Atmospheric Environment,1998,32(14):2453—2465.
[19]Kreitler C,Browning L.Nitrogen-isotope analysis of groundwater nitrate in carbonate aquifers:natural sources versus human pollution[J].Journal of Hydrology,1983,61(1):285—301.
[20]Waldron S,Tatner P,Jack I,et al.The impact of sewage discharge in a marine embayment:a stable isotope reconnaissance[J].Estuarine,Coastal and Shelf Science,2001,52(1):111—115.
[21]Aravena R,Evans M,Cherry J.Stable isotopes of oxygen and nitrogen in source identification of nitrate from septic systems[J].Ground water,2005,31(2):180—186.
[22]沈志良,刘群.长江和长江口高含量无机氮的主要控制因素[J].海洋与湖沼,2001,32(5):465—473.
[23]McClelland J,Valiela I,Michener R.Nitrogen-stable isotope signatures in estuarine food webs:A record of increasing urbanization in coastal watersheds[J].Limnology and Oceanography,1997:930—937.
[24]Robinson D.δ15N as an integrator of the nitrogen cycle[J].Trends in Ecology&Evolution,2001,16(3):153—162.
[25]Thornton S,Mc Manus J.Application of organic carbon and nitrogen stable isotope and C/N ratios as source indicators of organic matter provenance in estuarine systems:evidence from the Tay Estuary,Scotland[J].Estuarine,Coastal and Shelf Science,1994,38(3):219—233.
[26]Peterson B,Howarth R,Garritt R.Multiple stable isotopes used to trace the flow of organic matter in estuarine food webs[J].Science(New York,NY),1985,227(4692):1361—1363.
[27]Wu Y,Zhang J,Li D J,et al.Isotope variability of particulate organic matter at the PN section in the East China Sea[J].Biogeochemistry,2003,65(1):31—49.
[28]Needoba J,Sigman D,Harrison P.The mechanism of isotope fractionation during algal nitrate assimilation as illuminated by the15N/14N of intracellular nitrate[J].Journal of Phycology,2004,40(3):517—522.
[29]Liu X,Yu Z,Song X,et al.The nitrogen isotopic composition of dissolved nitrate in the Yangtze River(Changjiang)estuary,China[J].Estuarine,Coastal and Shelf Science,2009,85(4):641—650.
[30]Tian R,Hu F,Saliot A.Biogeochemical processes controlling nutrients at the turbidity maximum and the plume water fronts in the Changjiang Estuary[J].Biogeochemistry,1992,19(2):83—102.
[31]李佳霖,白洁,高会旺,等.长江口邻近海域夏季沉积物硝化细菌与硝化作用[J].环境科学,2009(11):3203—3208.
[32]Mariotti A,Germon J C,Hubert P,et al.Experimental determination of nitrogen kinetic isotope fractionation:some principles;illustration for the denitrification and nitrification processes[J].Plant and Soil,1981,62(3):413—430.
Seasonal distribution of the isotopic composition of suspended particulate nitrogen in the Changjiang River estuary and its biogeochemistry implications
Yu Haiyan1,2,Yu Zhiming1,Song Xiuxian1,Liu Lili1,2,Cao Xihua1,Yuan Yongquan1
(1.Key Laboratory of Marine Ecology and Environmental Sciences,Institute of Oceanology,Chinese Academy of Sciences,Qingdao 266071,China;2.University of Chinese Academy of Sciences,Beijing 100039,China)
The isotopic composition of suspended particulate matters(δ15Np)in surface water was studied duringFebruary,May,August and November of 2010 in the Changjiang River estuary.Based on the variations ofδ15Np in different seasons and regions,the biogeochemical processing of nitrogen transformation was studied and its environmental implications were also revealed.The results showed thatδ15Np of SPM was in a wide range of-1.1‰—8.6‰,varying with seasons and geographic regions,which reflected influences of riverineinput and biogeochemical processes.In February,the variation ofδ15Np reflected the mixing between riverine and marine nitrogen;in May and November,δ15Np decreased with increased Chl a in the surface waters,which indicated assimilation;in August and November,significant positive relationships were found betweenδ15Np and DIN,which indicated remineralizaion and nitrification.
nitrogen isotope;assimilation;mineralization;nitrification
P736.4+4
A
0253-4193(2014)02-0016-07
2012-12-16;
2013-03-12。
国家自然科学基金项目(41276116);国家基金委创新研究群体科学基金资助项目(41121064);国家基础研究规划973项目(2010CB428706)。
于海燕(1985—),女,山东省潍坊市人,从事长江口海域氮循环研究工作。E-mail:yuhyyuhy@163.com
*通信作者:俞志明,男,研究员,博士生导师。E-mail:zyu@qdio.ac.cn
于海燕,俞志明,宋秀贤,等.长江口海域悬浮颗粒有机物的稳定氮同位素季节分布与关键生物地球化学过程[J].海洋学报,2014,36(2):16—22,
10.3969/j.issn.0253-4193.2014.02.002
Yu Haiyan,Yu Zhiming,Song Xiuxian,et al.Seasonal distribution of the isotopic composition of suspended particulate nitrogen in the Changjiang River estuary and its biogeochemistry implications[J].Acta Oceanologica Sinica(in Chinese),2014,36(2):16—22,doi:10.3969/j.issn.0253-4193.2014.02.002
