胶州湾沉积物中有机硫来源及成因机制的研究
2014-06-01黄香利朱茂旭陈良进李铁
黄香利,朱茂旭*,陈良进,李铁
(1.中国海洋大学化学化工学院海洋化学理论与技术教育部重点实验室,山东青岛 266100)
胶州湾沉积物中有机硫来源及成因机制的研究
黄香利1,朱茂旭1*,陈良进1,李铁1
(1.中国海洋大学化学化工学院海洋化学理论与技术教育部重点实验室,山东青岛 266100)
有机硫是海洋沉积物中重要的硫形态,其中成岩有机硫对有机质保存和微量元素形态具有重要影响。利用化学提取及硫稳定同位素研究了胶州湾沉积物中碱可提取的腐殖酸硫(HA-S)、富里酸硫(FA-S)以及铬不可还原有机硫(non-CROS)的垂直分布、来源及形成机制。结果表明,non-CROS、HA-S以及FA-S的含量范围分别为19.1~52.6、3.35~7.82和27.3~38.6μmol/g,均处于其他许多近海沉积物中含量的低值区,且3者均为海洋生物有机硫和成岩有机硫的混合物。HA-S和non-CROS以海洋生物有机硫为主,其份数分别为65%~68%和67%~77%,而FA-S则以成岩有机硫为主(54%~73%)。相对于生物有机硫,成岩有机硫更易被碱和酸性Cr(Ⅱ)溶液提取,因此腐殖质硫和non-CROS都不能全面反映沉积物中有机硫的组成和来源。黄铁矿和腐殖质中成岩有机硫含量随深度的同步增加表明黄铁矿形成并未明显地竞争性抑制有机质硫化。
海洋沉积物;生物有机硫;成岩有机硫;硫同位素;胶州湾
1 引言
海洋沉积物中的固相硫存在多种形态:其中黄铁矿通常为还原态硫最主要的形态;有机硫为仅次于黄铁矿结合态硫的重要形态,其平均含量占沉积物总硫的35%,最高达80%[1]。有机硫的形成有两种基本路径[2]:一是同化还原,即细菌摄取硫酸盐用于合成氨基酸和其他含硫细胞组分(生物有机硫,Sbio);另一路径是在成岩过程中的有机质硫化,即由还原产生的各种还原态硫与有机质结合生成大分子的硫化合物(成岩有机硫,Sdiag)。这些大分子有机硫化物由二硫化物和多硫化物交联而成,其形成可提高有机质的稳定性及其在沉积物中的保存[3—4]。铁硫化物(包括黄铁矿)形成对有机质硫化具有竞争性抑制作用,而高含量活性铁氧化物对黄铁矿形成以及有机质硫化具有促进作用,使得有机质硫化受制于C-S-Fe体系的耦合关系[5]。此外,还原有机硫是Hg(Ⅱ)、Cu(Ⅱ)、Pb(Ⅱ)、Ag(Ⅰ)、As(Ⅲ)等污染元素的络合剂,对这些污染元素的形态和活性具有重要的控制作用[6—7]。可见,有机硫成因及有机质硫化的研究对揭示有机质埋藏的影响因素、C-S-Fe体系的成岩耦合关系以及有机硫的环境地球化学影响都具有重要意义。
有机硫的形态分析目前有两种方法,一种是酸性Cr(Ⅱ)提取无机还原硫(AVS和FeS2)后的有机硫,即酸性Cr(Ⅱ)不可还原有机硫(non-CROS)[8],另一种是碱(0.5 mol/L NaOH)提取腐殖质硫(腐殖质硫可进一步分为腐殖酸硫(HA-S)和富里酸硫(FA-S))[9—10]。non-CROS和碱可提取的腐殖质硫都被认为是海洋沉积物中有机硫的重要组分[8—11]。但需指出的是,现有提取法都无法准确得到总有机硫含量,如腐殖质硫不包括碱不可提取的有机硫,non-CROS不包括黄铁矿提取过程中同时被提取的有机硫。有限的研究表明[8,12],Cr(Ⅱ)还原法提取黄铁矿过程中同时提取的有机硫很少,因此,non-CROS被认为可近似代表沉积物中总有机硫含量[11],但并未得到广泛的验证,因为Canfield等[8]后来发现,酸性Cr(Ⅱ)可从海洋腐殖泥中提取较高含量的有机硫。目前,还未对腐殖质硫和non-CROS进行系统的比较研究,因此,并不清楚两者之间在含量和组成上的差异。
由于海洋沉积物中硫组成的多样性以及生物/非生物循环的复杂性,化学提取不能提供有机硫成因和来源的信息,但特定的硫源和循环路径常具有特征性的硫同位素组成,可用于示踪其来源及循环路径[9—11]。本文利用化学提取及硫同位素组成研究了胶州湾柱状沉积物中有机硫的组成及其成因,探讨了水体富营养化对有机硫形成和积累的可能影响,并系统比较了腐殖质硫和non-CROS在含量和组成上的差异。
2 材料与方法
2.1 研究区概况及样品采集
胶州湾为半封闭海湾,湾内1/5的面积为潮间带。由于周边约10条大小不等的河流常年或季节性输入营养盐和污染物,使得胶州湾出现富营养化和重金属污染[13—14]。沉积速率研究表明[15],尽管个别河口沉积速率较高,但近100 a来湾内整体沉积环境相对稳定,沉积速率较低,量级为100mm/a。2011年11 月8日,在胶州湾M1站点(36.19°N,120.33°E;水深2 m)采集沉积物样品(图1),用箱式采样器采集沉积物后,将内径为79 mm的PVC采样管垂直插入沉积物中采集柱样(采样深度约30 cm),然后迅速密封采样管两端,于-5℃冷冻保存。返回实验室后将沉积物在充满氮气的手套箱中解冻、切割,以2 cm间隔分层,分割后样品马上装入聚乙烯瓶中密封冷冻保存,直至分析。
2.2 分析方法湿沉积物样品,在105℃下烘干至恒重,测定其干湿比,用于各形态硫的计算。用Mastersizer 2000型激光粒度测定仪测定沉积物中黏土、粉砂、砂粒的平均份数分别为22.5%、71.0%和6.5%。
2.2.1 沉积物干湿比及粒度测定
沉积物样品在氮气中解冻后,准确称取一定量的
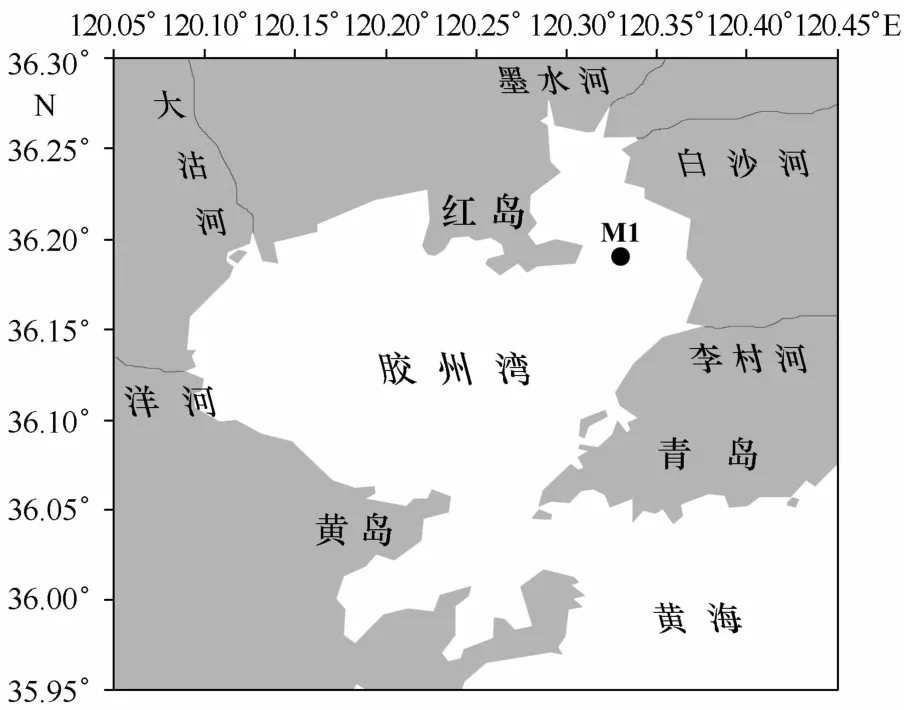
图1 胶州湾沉积物M1站位
2.2.2 黄铁矿硫(Spy)含量及其同位素测定
在通入氮气条件下,准确称取沉积物湿样(约5 g),用6 mol/L HCl和丙酮处理并离心以去除硫酸盐、AVS及S0,残余沉积物用去离子水洗后用酸性CrCl2还原剂将Spy还原成H2S,用置于反应器中的碱性Zn Ac2溶液(20%Zn Ac2+2 mol/L NaOH)吸收释放的H2S(即冷扩散吸收法)[16],生成的ZnS用亚甲基蓝法测定[17]。
用上述同样方法提取Spy后,往碱性ZnAc2溶液加入足量的0.1 mol/L AgNO3溶液将ZnS转化为Ag2S。然后用足量1 mol/L氨水洗涤使其进一步纯化。将洗涤后的Ag2S收集并干燥,在中国科学院地球化学研究所环境地球化学国家重点实验的Finnigan MAT-252质谱仪上测定硫同位素组成(δ34Spy),硫同位素组成表示为:
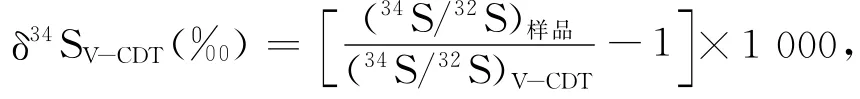
式中,(34S/32S)样品为样品的34S/32S,(34S/32S)V-CDT(=0.044 2)[18]为V-CDT的34S/32S。NBS127 (BaSO4,δ34S=20.3‰)标准样品测定的标准偏差在±0.2‰以内(n=5)[19]。
2.2.3 铬不可还原有机硫(non-CROS)含量及其同位素测定
将Spy提取后的剩余样品干燥、研磨。将粉末样品与3倍艾氏卡(Eschka)试剂(质量比MgO∶Na2CO3=2∶1)[20]混合,在800℃焙烧将所有有机硫转化为硫酸盐。用300 mL蒸馏水溶解并过滤,用HCl调节滤液p H到2.0,加入足量10%BaCl2将转化为BaSO4沉淀,将沉淀干燥至恒重后称量,计算non-CROS含量,并测定其硫同位素组成(δ34Snon-CROS)。
2.2.4 腐殖酸硫(HA-S)和富里酸硫(FA-S)含量及其同位素测定
在通入氮气条件下,准确称取沉积物湿样(约5 g),用0.5 mol/L NaCl、1 mol/L HCl和丙酮处理并离心以去除AVS、S0及硫酸盐。残余沉积物用去离子水洗涤后,加入15 mL 0.5 mol/L NaOH,震荡24 h,离心并分离出上清液,此过程重复5~8次,直至提取液呈微黄色。所收集上清液即为腐殖质,将其酸化到p H 2,沉淀出为腐殖酸,清液为富里酸,通过离心、过滤将两者分离,分离的腐殖酸沉淀需进一步用p H 2的 HCl溶液洗涤2次。
将腐殖酸沉淀烘干、研磨,测定HA-S含量及其同位素组成(δ34SHA-S),其方法与non-CROS测定方法相同。富里酸清液用30%H2O2氧化,将有机硫转化为S,然后用HCl调节滤液p H到2.0,加入足量10%BaCl2,将沉淀为BaSO4,将沉淀干燥至恒重后称量,计算FA-S含量并测定其同位素组成(δ34SFA-S)。
3 结果
3.1 Spy含量及其硫同位素组成
Spy含量范围为24.6~44.1μmol/g,平均含量为35.2μmol/g(图2a),总体上呈现随深度增加的趋势。δ34Spy范围为-29.86‰~-28.06‰(图2e),且在整个采样深度范围内基本保持不变。
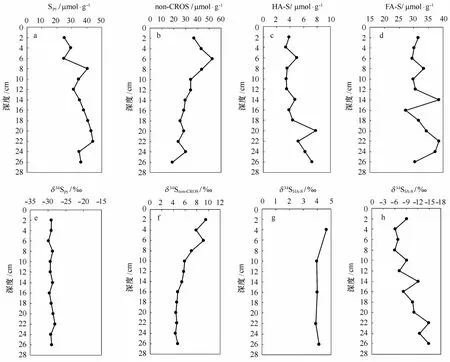
图2 Spy,non-CROS,HA-S,FA-S含量及其硫同位素组成垂直分布
3.2 有机硫含量及其硫同位素组成
Non-CROS含量范围为19.1~52.6μmol/g,平均值为33.2μmol/g(见图2b),略低于Spy的平均含量。从表层到7 cm范围内,non-CROS含量随深度的增加而增加,在该深度以下随深度增加而逐渐减小。δ34Snon-CROS值在4.30‰~9.58‰范围内(见图2f),且随深度的增加而逐渐减小。
HA-S含量在3.35~7.82μmol/g之间(见图2c),平均含量为4.78μmol/g,且随深度增加逐步增加;δ34SHA-S在3.89‰~4.67‰之间(见图2g),尽管在表层随深度增加有降低的趋势,但都在很小的范围内变化。FA-S含量在27.3~38.6μmol/g之间(见图2d),平均含量为32.6μmol/g,无明显的深度变化趋势;δ34SFA-S在-6.01‰~-14.93‰之间(见图2h),随深度增加有递减的趋势。腐殖质硫(HA-S+FA-S)含量在31~44μmol/g之间,其平均含量(37.3μmol/g)略高于Spy的平均含量。
4 讨论
4.1 黄铁矿形成的硫同位素制约
M1站点Spy含量在胶州湾其他站点以及东海内陆架沉积物中的含量范围内[21—23],但比其他一些富含有机质的近海沉积物中的含量明显偏低[24]。Spy含量随深度增加的趋势表明随成岩作用的进行黄铁矿逐步积累。该站点的δ34Spy明显低于海水的硫同位素组成(δ34Ssulfate≈21‰),Δδ34Ssulfate-py为49.06‰~50.86‰,表明硫酸盐异化还原中其产物(硫化物)发生了明显的32S富集,因此,为相对开放体系[25]。上述开放体系表明,尽管胶州湾水体富营养化导致初级生产力增加,但在沉积物的采样深度范围内,有机质的厌氧分解并未导致沉积物中的快速亏损。实际上,尽管胶州湾富营养化导致水体初级生产增加,但由于近些年的过度养殖对有机质的过滤作用,导致沉积物中的有机质积累并未增加,反而有所减小[13],因此并未明显提高硫酸盐还原速率和硫化物的积累[21],也未引起S的快速亏损以及Spy含量的明显提高。此外,养殖条件下底栖生物持续的物理扰动也可减少的浓度梯度、加速硫化物的氧化,这也是未快速亏损及Spy含量较其他一些富含有机质的近海沉积物中偏低的原因之一。
4.2 硫同位素组成对有机硫来源及成因的制约
M1站点的non-CROS平均含量高于东海内陆架沉积物中的平均含量[21],但位于其他许多海洋沉积物中含量范围的低值端[26—27]。FA-S含量明显高于HA-S含量,但δ34SFA-S却明显低于δ34SHA-S,这与文献报道一致[9—10]。与non-CROS含量相似,FA-S和HA-S含量以及腐殖质硫(即FA-S+HA-S)含量也处于其他许多海洋沉积物中各自含量范围的低值端[3,9]。这表明,陆源污染物的输入以及水体富营养化并未明显提高胶州湾沉积物中有机硫含量。
海洋沉积物中有机硫可能来源于陆源有机硫、海洋生物有机硫和成岩有机硫,且几乎所有陆源有机硫均为生物有机硫[28]。由于生物有机硫多为活性很高的生物分子(如蛋白质、氨基酸),大部分陆源有机硫在进入海洋之前已分解,因此对海洋沉积物中有机硫的贡献都很小,在海洋沉积物中硫质量平衡计算中都不予考虑[8—10]。海洋生物有机硫具有较高的活性,通常在沉积物的早期成岩作用中快速分解,但在还原性沉积物中仍有部分被保存,尽管其机制至今并不十分清楚[5,11]。在富含有机质的近海沉积物中,硫酸盐异化还原产生的硫化物可沉淀为铁硫化物(包括黄铁矿),也可与有机质结合形成成岩有机硫。可见,海洋沉积物中的有机硫有不同来源和成因。
硫同位素组成是研究有机硫成因及其相对贡献的重要工具。硫酸盐同化还原中硫同位素分馏很小(1‰~3‰)[29—30],因此海洋生物有机硫与海水的硫同位素组成相似。开放体系中硫酸盐异化还原的硫同位素分馏一般较大(>20‰)[31—32],而硫化物的沉淀以及有机质硫化的硫同位素分馏都很小(1‰~5‰)[33—34],因此,成岩有机硫的δ34Sdiag与无机硫化物的δ34S相似。胶州湾沉积物中的δ34Spy(平均值为-29.02‰)可作为该沉积物中成岩有机硫的δ34Sdiag。胶州湾沉积物中的δ34SHA-S(3.89‰~4.67‰)远大于δ34Spy,而远小于δ34Sbio(21‰)。显然,无论是海洋生物有机硫还是成岩有机硫都不可能是HA-S的唯一来源,HA-S应是两者的混合物。在忽略陆源生物有机硫的条件下,可通过二端元同位素质量平衡定量估算海洋生物有机硫和成岩有机硫的相对份数[10—11]:
f×δ34Sdiag+(1-f)×δ34Sbio=δ34SHA-S,(1)式中,f为成岩有机硫占HA-S的质量份数(Sdiag/SHA-S),δ34Sdiag和δ34Sbio分别为成岩有机硫和海洋生物有机硫的同位素组成(δ34Sdiag≈δ34Spy;δ34Sbio≈δ34Ssulfate=21‰),δ34SHA-S为实测HA-S的硫同位素组成。计算结果表明,成岩有机硫占HA-S的份数为32%~35%(见图3a),几乎不随深度变化。可见,海洋生物有机硫为HA-S的主要组成。
该站点δ34SFA-S(-6.01‰~-14.93‰)明显低于δ34SHA-S,但仍介于δ34Sdiag和δ34Ssulfate之间,说明FA-S也是成岩有机硫和海洋生物有机硫的混合物。利用二端元硫同位素质量平衡模拟计算,得到成岩有机硫的份数为54%~73%(图3b),随深度的增加呈增加的趋势,表明FA的硫化程度逐步增加。FA-S中成岩有机硫的份数明显高于HA-S中成岩有机硫的份数。这表明,相对于HA,FA更易于成岩硫化,这与我们对东海沉积物的研究结果一致[35],也与Brüchert[9]的推断吻合,该作者根据HA和FA中C、N、S及其稳定同位素组成的明显差别认为FA比HA具有更高的成岩活性,更易于发生成岩硫化作用。以上特征应是海洋沉积物中FA-S含量普遍远高于HA-S含量的重要原因,且这一特征在受到人类活动扰动较大的胶州湾未被改变。
成岩硫化作用的程度是决定沉积物中有机硫含量的关键因素[5]。由于FA的硫化活性远高于HA,因此腐殖质硫(FA-S+HA-S)含量主要由FA的硫化作用决定。与许多近海沉积物相比,胶州湾中较低的FA-S及腐殖质硫含量应主要受制于FA的硫化作用。该沉积物中(河口除外)孔隙水HS-、AVS以及黄铁矿含量普遍较低[21],这也必然不利于硫化作用的发生。
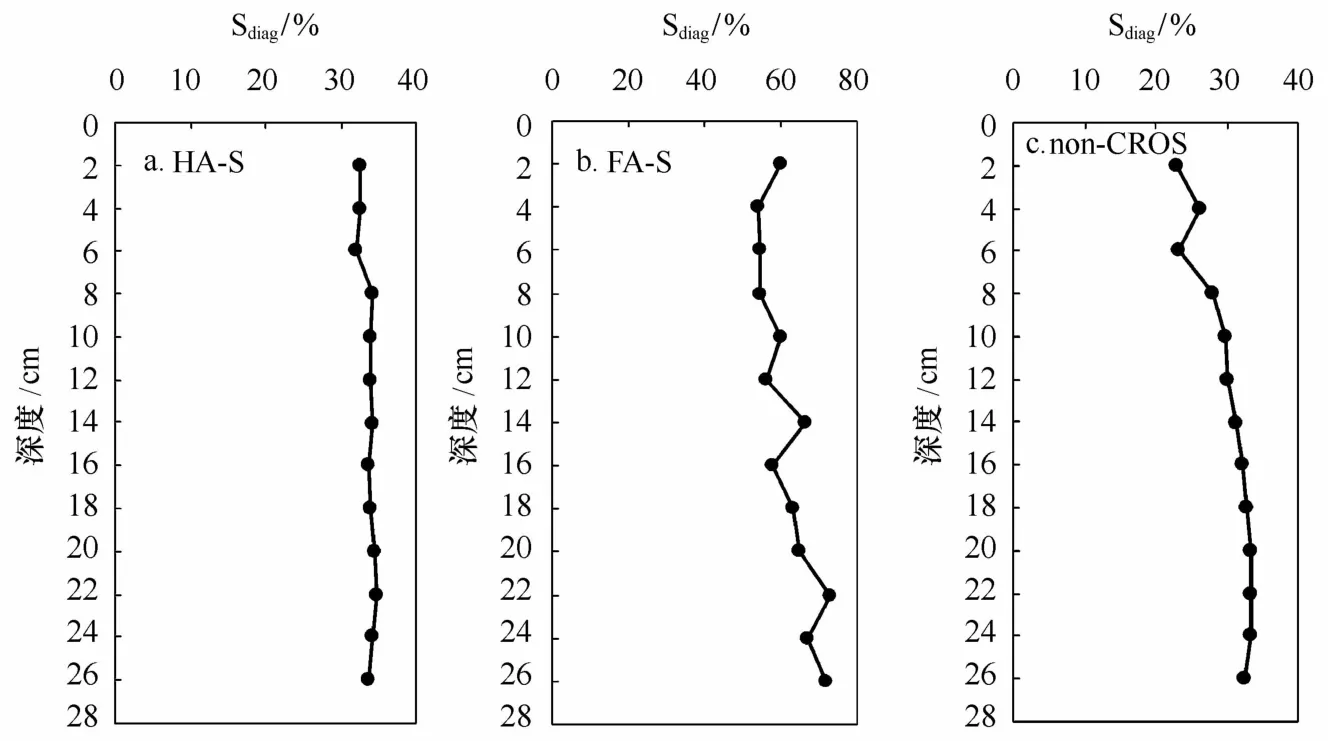
图3 HA-S(a),FA-S(b)和non-CROS(c)中Sdiag份数垂直分布
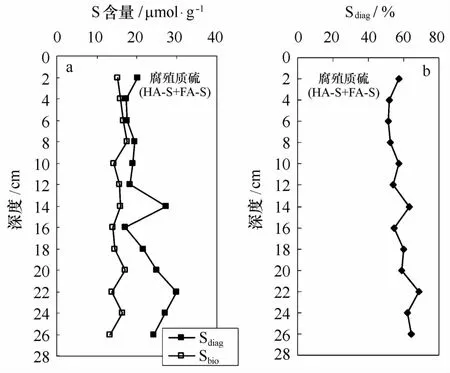
图4 腐殖质硫Sbio和Sdiag含量(a)和(HA-S+FA-S)中Sdiag份数(b)垂直分布
根据FA-S和HA-S中生物有机硫和成岩有机硫的份数,计算出腐殖质硫中成岩有机硫的含量和份数分别为17.4~30.0μmol/g和51%~69%(图4a,b),且随深度略有增加。尽管海洋生物有机硫占HA-S的份数较高,但由于HA-S含量远小于FA-S含量,腐殖质硫中成岩有机硫份数仍由FA-S中成岩有机硫份数决定。因此,总体而言,腐殖质硫仍以成岩有机硫为主。腐殖质硫中成岩有机硫含量(图4a)低于Spy含量(见图2a),但在整个采样深度范围内,成岩有机硫与黄铁矿共存且都随深度呈增加的趋势,并未表现出黄铁矿的形成对有机质硫化有明显的竞争性抑制。
在对应深度上,non-CROS的δ34Snon-CROS(4.30‰~9.58‰)明显高于δ34SFA-S,也高于δ34SHA-S,但介于δ34Sdiag和δ34Ssulfate之间,通过二端元同位素质量平衡计算得到成岩有机硫含量和份数分别为6.20~12.2 μmol/g和23%~33%,这表明non-CROS以生物有机硫为主,但成岩硫化的程度随深度而增加(图3c),这与我们对东海内陆架沉积物研究的结果一致[22]。
4.3 腐殖质硫(HA-S+FA-S)与non-CROS的对比
从前面的分析可知,腐殖质硫(HA-S+FA-S)和non-CROS的组成存在较大的差异,前者以成岩有机硫为主,而后者则以生物有机硫为主。腐殖质硫含量几乎不随深度变化,而non-CROS含量却随深度呈降低的趋势(图5)。在上部12 cm深度范围内,non-CROS含量略大于或等于腐殖质硫含量,但在该深度以下non-CROS含量均低于腐殖质硫含量。考虑到腐殖质硫不包括碱不可提取的有机硫,在深部沉积物中,non-CROS含量低于腐殖质硫含量说明non-CROS并不能作为总有机硫的近似值,也表明Passier等[11]的结论并不具有普遍性。腐殖质硫中的成岩有机硫的含量为17~30μmol/g(见图4a),这表明沉积物中总成岩有机硫含量应大于该值。而non-CROS中成岩有机硫含量仅为6.2~12.2μmol/g,而生物有机硫含量却为12.8~40.4μmol/g,这表明在黄铁矿提取过程中成岩有机硫易被提取而损失掉,该推断得到了Canfield等[8]的硫同位素研究结果的支持。反过来,从non-CROS角度分析,沉积物中总生物有机硫至少应在12.8~40.4μmol/g范围内,但腐殖质硫中的生物有机硫含量仅为13.4~17.6μmol/g,而成岩有机硫的含量为17~30μmol/g,这表明成岩有机硫更易被碱提取。由此可见,碱和酸性Cr(Ⅱ)都更易于提取成岩有机硫。因此,腐殖质硫和non-CROS都不能全面反映沉积物中有机硫的组成和来源,为更全面了解有机硫组成及成因,应将这两种提取方法结合起来研究。
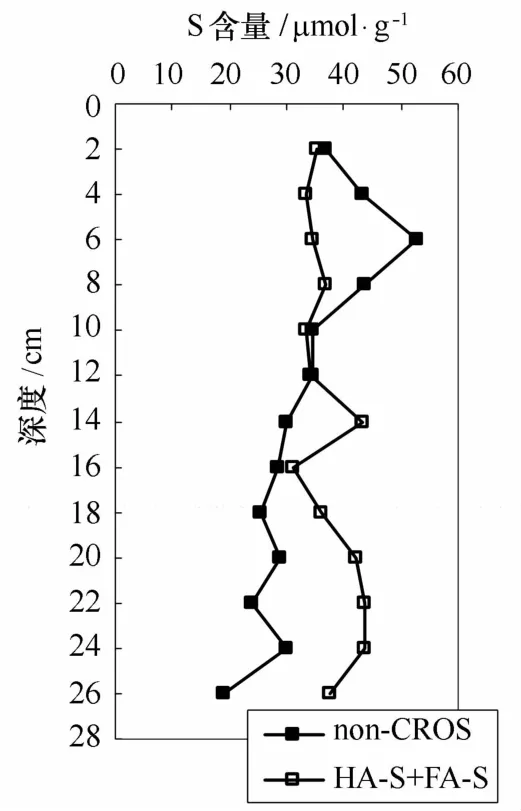
图5 non-CROS与腐殖质硫(HA-S+FA-S)含量比较
5 结论
(1)胶州湾M1站点HA-S、FA-S和non-CROS含量位于其他许多海洋沉积物中含量范围的低端区,其组成均为海洋生物有机硫和成岩有机硫的混合物。non-CROS和HA-S都以海洋生物有机硫为主,其份数分别为67%~77%和65%~68%,而FA-S则以成岩有机硫为主(54%~73%)。该沉积物中腐殖质硫含量主要受制于FA较低的硫化作用,水体富营养化以及陆源污染物输入并未明显提高该沉积物中有机硫(FA-S+HA-S)含量。
(2)Non-CROS与腐殖质硫的对比表明,non-CROS并不能作为总有机硫的近似值。相对于生物有机硫,成岩有机硫更易被碱和酸性Cr(Ⅱ)提取,因此,腐殖质硫和non-CROS都不能全面反映沉积物中有机硫的组成和来源。
(3)腐殖质中成岩有机硫与Spy共存,且其含量都随深度呈增加的趋势,因此未表现出黄铁矿形成对有机质硫化有明显的竞争性抑制。
致谢:野外工作得到了王洪波的帮助,硫同位素测定得到了中国科学院地球化学研究所肖化云研究员的大力协助,谨此致谢!
[1] Anderson T F,Pratt L M.Isotopic evidence for the origin of organic sulfur and elemental sulfur in marine sediments[C]//Vairavamurthy M A,Schoonen M A A.Geochemical Transformations of Sedimentary Sulfur.Washington D C:ACSSymposium Series 612,1995:378-396.
[2] Werne J P,Lyons T W,Hollander DJ,et al.Investigating pathways of diagenetic organic matter sulfurization using compound-specific sulfur isotope analysis[J].Geochimica et Cosmochimica Acta,2008,72:3489-3502.
[3] Ferdelman T G,Church T M,Luther G W.Sulfur enrichment of humic substances in a Delaware salt marsh sediment core[J].Geochimica et Cosmochimica Acta,1991,55:979-988.
[4] Sinninghe DamstéJ S,Eglinton T I,De Leeuw J W.Analysis,structure and geochemical significance of organically-bound sulphur in the geosphere:state of the art and future research[J].Organic Geochemistry,1990,16:1077-1101.
[5] Werne J P,Hollander DJ,Lyons T W,et al.Organic sulfur biogeochemistry:Recent advances and future research directions[C]//Amend JP,EdwardsKJ,Lyon T W.Sulfur biogeochemistry—past and present.Boulder:Geological Society of America,2004:135-150.
[6] Hoffmann M,Mikutta C,Kretzschmar R.Bisulfide reaction with natural organic matter enhances arsenite sorption:insights from X-ray absorption spectroscopy[J].Environmental Science&Technology,2012,46:11788-11797.
[7] XiaK,Skyllberg U,Bleam W,et al.X-ray absorption spectroscopic evidence for the complexation of Hg(II)by reduced sulfur in soil humic substances[J].Environmental Science&Technology,1999,33:257-261.
[8] Canfield D E,Boudreau B P,Mucci A,et al.The early diagenetic formation of organic sulfur in the sediments of Mangrove Lake,Bermuda[J]. Geochimica et Cosmochimica Acta,1998,62:767-781.
[9] Brüchert V.Early diagenesis of sulfur in estuarine sediments:the role of sedimentary humic and fulvic acids[J].Geochimica et Cosmochimica Acta,1998,62:1567-1586.
[10] Brüchert V,Pratt L M.Contemporaneous early diagenetic formation of organic and inorganic sulfur in estuarine sediments from St.Andrew Bay,Florida,USA[J].Geochimica et Cosmochimica Acta,1996,60:2325-2332.
[11] Passier H F,Böttcher M E,De Lange G J.Sulphur enrichment in organic matter of eastern Mediterranean sapropels:a study of sulphur isotope partitioning[J].Aquatic Geochemistry,1999,5:99-118.
[12] Canfield D E,Raiswell R,Westrich J T,et al.The use of chromium reduction in the analysis of reduced inorganic sulfur in sediments and shales [J].Chemical Geology,1986,54:149-155.
[13] Liu S M,Zhu B D,Zhang J,et al.Environmental change in Jiaozhou Bay recorded by nutrient components in sediments[J].Marine Pollution Bulletin,2010,60:1591-1599.
[14] Dai J,Song J,Li X,et al.Environmental changes reflected by sedimentary geochemistry in the last hundred years of Jiaozhou Bay,North China[J]. Environmental Pollution,2007,145:656-667.
[15] 刘运令,汪亚平,高建华,等.胶州湾铅-210比活度的分布模式及百年尺度的沉积速率[J].海洋学报,2010,32(1):83-93.
[16] Hsieh Y P,Yang C H.Diffusion methods for the determination of reduced inorganic sulfur species in sediments[J].Limnology and Oceanography,1989,34:1126-1130.
[17] Cline J D.Spectrophotometric determination of hydrogen sulfide in natural waters[J].Limnology and Oceanography,1969,14:454-458.
[18] Ding T,Valkiers S,Kipphardt H,et al.Calibrated sulfur isotope abundance ratios of three IAEA sulfur isotope reference materials and V-CDT with a reassessment of the atomic weight of sulfur[J].Geochimica et Cosmochimica Acta,2001,65:2433-2437.
[19] Xiao H Y,Liu C Q.The elemental and isotopic composition of sulfur and nitrogen in Chinese coals[J].Organic Geochemistry,2011,42:84-93.
[20] Tuttle M L,Goldhaber M B,Williamson D L.An analytical scheme for determining forms of sulphur in oil shales and associated rocks[J].Talanta,1986,33:953-961.
[21] Zhu M X,Liu J,Yang G P,et al.Reactive iron and its buffering capacity towards dissolved sulfide in sediments of Jiaozhou Bay,China[J].Marine Environmental Research,2012,80:46-55.
[22] Zhu M X,Shi X N,Yang G P,et al.Formation and burial of pyrite and organic sulfur in mud sediments of the East China Sea inner shelf:constraints from solid-phase sulfur speciation and stable sulfur isotope[J].Continental Shelf Research,2013,54:24-36.
[23] 蒲晓强,钟少军,刘飞,等.胶州湾李村河口沉积物中硫化物形成的控制因素[J].地球化学,2009,38(4):323-333.
[24] Chambers R,Hollibaugh J,Snively C,et al.Iron,sulfur,and carbon diagenesis in sediments of Tomales Bay,California[J].Estuaries,2000,23:1 -9.
[25] Hoefs J.Stable Isotope Geochemistry[M].Berlin:Springer,2009.
[26] Mossmann J R,Aplin A C,Curtis C D,et al.Geochemistry of inorganic and organic sulphur in organic-rich sediments from the Peru Margin[J]. Geochimica et Cosmochimica Acta,1991,55:3581-3595.
[27] Zaback D A,Pratt L M.Isotopic composition and speciation of sulfur in the Miocene Monterey formation:reevaluation of sulfur reactions during early diagenesis in marine environments[J].Geochimica et Cosmochimica Acta,1992,56:763-774.
[28] Vairavamurthy M A,Maletic D,Wang S,et al.Characterization of sulfur-containing functional groups in sedimentary humic substances by X-ray absorption near-edge structure spectroscopy[J].Energy&Fuels,1997,11:546-553.
[29] Kaplan I R,Rittenberg S C.Microbiological fractionation of sulphur isotopes[J].Journal of General Microbiology,1964,34:195-212.
[30] Trust B A,Fry B.Stable sulphur isotopes in plants:a review[J].Plant,Cell&Environment,1992,15:1105-1110.
[31] HabichtKS,Canfield D E.Sulfur isotope fractionation during bacterial sulfate reduction in organic-rich sediments[J].Geochimica et Cosmochimica Acta,1997,61:5351-5361.
[32] Brüchert V,Knoblauch C,Jørgensen B B.Controls on stable sulfur isotope fractionation during bacterial sulfate reduction in Arctic sediments[J]. Geochimica et Cosmochimica Acta,2001,65:763-776.
[33] Price F T,Shieh Y N.Fractionation of sulfur isotopes during laboratory synthesis of pyrite at low temperatures[J].Chemical Geology,1979,27:245-253.
[34] Böttcher M E,Smock A M,Cypionka H.Sulfur isotope fractionation during experimental precipitation of iron(II)and manganese(II)sulfide at room temperature[J].Chemical Geology,1998,146:127-134.
[35] Zhu M X,Huang X L,Yang G P,et al.Speciation and stable isotopic compositions of humic sulfur in mud sediment of the East China Sea:Constraints on origins and pathways of organic sulfur formation[J].Organic Geochemistry,2013,63:64-73.
Sources and formation mechanisms of organic sulfur in Jiaozhou Bay sediments
Huang Xiangli1,Zhu Maoxu1,Chen Liangjin1,Li Tie1
(1.Key Laboratory of Marine Chemistry Theory andTechnology,Ministry of Education,College of Chemistry andChemical Engineering,Ocean University of China,Qingdao 266100,China)
Organic sulfur(OS)is an important sulfur pool in marine sediments.Sulfurization of organic matter (OM)helps to enhance the preservation of OM and exerts an important impact on mobility of trace elements. Chemical extractions were used to quantify base-extractable humic-acid sulfur(HA-S),fulvic-acid sulfur(FA-S)and non-chromium-reducible OS(non-CROS)in Jiaozhou Bay sediments,and sulfur stable isotope was used to trace their sources and mechanisms of formation.Results show that non-CROS,HA-Sand FA-Scontents are 19.1 to 52.6,3.35 to 7.82,and 27.3 to 38.6μmol/g,respectively,being at the lower ends of the respective contents in many other marine sediments.The three OS pools are mixtures of diagenetic and marine biogenic OS,with the HA-S and non-CROS dominated by biogenic OS(65%to 68%and 67%to 77%,respectively),while the FA-S dominated by diagenetic one(54%to 73%).Relative to the biogenic OS,diagenetic OS is more readily extracted by both base and acidic Cr(Ⅱ)solutions.Thus both base-extractable OS(i.e.,HA-S+FA-S)and non-CROS cannot truly reflect the compositions and sources of OSin the bulk sediments.Simultaneous downcore increase in contents of pyrite-Sand diagenetic OSin humic substances suggests that pyrite formation has not competitively inhibited OM sulfurization to a significant extent.
marine sediments;biogenic organic sulfur;diagenetic organic sulfur;sulfur isotopes;Jiaozhou Bay
P734.5
A
0253-4193(2014)06-0050-08
2013-07-19;
2013-12-22。
国家自然科学基金(41076045);山东省自然科学基金(ZR2011DM003)。
黄香利(1988—),男,山东省济宁市人,从事海洋化学及环境地球化学研究。E-mail:huangxiangli1988@163.com
*通信作者:朱茂旭,教授。E-mail:zhumaoxu@ouc.edu.cn
黄香利,朱茂旭,陈良进,等.胶州湾沉积物中有机硫来源及成因机制的研究[J].海洋学报,2014,36(6):50—57,
10.3969/j. issn.0253-4193.2014.06.007
Huang Xiangli,Zhu Maoxu,Chen Liangjin,et al.Sources and formation mechanisms of organic sulfur in Jiaozhou Bay sediments[J]. Acta Oceanologica Sinica(in Chinese),2014,36(6):50—57,doi:10.3969/j.issn.0253-4193.2014.06.007
