iASPP在压力诱导的视网膜神经节细胞凋亡中的表达及意义
2014-06-01杨海燕许文晶高志卓徐韶琳
王 英,杨海燕,许文晶,胡 萍,高志卓,徐韶琳*
(1.吉林大学第二医院眼科,吉林长春130041;2.吉化总医院眼科)
iASPP在压力诱导的视网膜神经节细胞凋亡中的表达及意义
王 英1,杨海燕1,许文晶1,胡 萍1,高志卓2,徐韶琳1*
(1.吉林大学第二医院眼科,吉林长春130041;2.吉化总医院眼科)
目的观察P53凋亡刺激蛋白(ASPP家族的抑制因子iASPP)在压力诱导的视网膜神经节细胞(RGC-5)凋亡中的表达及意义。方法将视网膜神经节细胞(RGC-5细胞)分别在60mmHg和80mmHg压力条件下培养48小时,MTT方法检测细胞活力,细胞染色检测凋亡,RT-PCR,WESTERN-BLOT检测P53和iASPP基因的变化。结果随着压力的增加RGC-5细胞活力下降,细胞凋亡逐渐增加,P53基因表达增加,iASPP基因的表达下降。结论在压力诱导的RGC-5细胞凋亡中iASPP表达下降可能使P53活性增加,促进RGC-5细胞凋亡的发生,上调iASPP表达可能具有神经保护作用。
P53凋亡刺激蛋白;视网膜神经节细胞;凋亡
(Chin J Lab Diagn,2014,18:1589)
P53是调节视网膜神经节细胞(RGC)凋亡的重要蛋白。P53凋亡刺激蛋白家族的抑制因子(iASPP)为新近发现的一种重要P53抑制蛋白[1]。为探讨iASPP在压力诱导的视网膜神经节细胞(RGC-5)凋亡中的作用,我们采用RT-PCR,WESTERN-BLOT方法检测iASPP在压力诱导的视网膜神经节细胞(RGC-5)凋亡中表达水平并初步探讨其意义,为青光眼视神经保护治疗新靶点的发现提供理论基础。
1 材料与方法
1.1 主要试剂DMEM培养基(美国Hyclone公司)、胎牛血清(美国Hyclone公司)、兔抗鼠单克隆体P53(美国Santa公司),兔抗鼠多克隆抗体iASPP(美国Santa公司),PCR试剂盒(美国TaKa-Ra公司)。
1.2 细胞培养RGC-5细胞培养应用含10%胎牛血清的DMEM细胞培养液。细胞培养于37℃,5% CO2、饱和湿度的细胞培养箱。应用胰蛋白酶每3-4 d消化传代1次。
1.3 MTT法检测细胞增殖抑制率取对数期生长的RGC-5细胞,以8×103每孔密度接种于96孔培养板,培养24h后,将RGC-5细胞分别在60mm-Hg,80mmHg压力条件下培养48h,然后,每孔加入5mg/ml的MTT 20μl,继续培养4h;吸除培养液;加入100μl DMSO终止反应,570nm波长测定吸光度(A),计算不同压力对RGC-5细胞的增殖抑制率。
1.4 细胞染色检测细胞凋亡Hoechst33342是一种可以穿透细胞膜的荧光染料,细胞毒性低。它在聚AT序列富集区与DNA结合,显示凋亡细胞和活细胞。RGC-5细胞常规培养24h后,将RGC-5细胞分别在60mmHg,80mmHg压力条件下培养48h,加入10mg/ml Hoe33342避光染色0.5h,然后在荧光显微镜下观察拍照。
1.5 半定量RT-PCR检测RGC-5细胞常规培养24h后,将RGC-5细胞分别在60mmHg,80mm-Hg压力条件下培养48h,取1×105个RGC-5细胞,利用Trizol一步法提取总RNA。利用随机引物进行逆转录反应,得到cDNA。根据Genbank上的基因序列,利用引物设计软件设计引物,内参GAPDH上游引物:5′-CATCAAGAAG GTGGTGAAGCAGG-3′;下游引物:5′-CCACCACCCTGTTGCT GTAGCCA-3′;扩增内参GADPH长度为206bp;iASPP上游引物:5′-GTGAAGGAGATGAACGACCCG-3′;下游引物:5′-AGTGCGACCCTTACCGCGAGG-3′,所扩增的iASPP目的片段长度为821bp。P53上游引物:5′-ACAGGACCCTGTCACCGAGGA-3′,下游引物5′-GACCTCCGTCACCGAGACC-3′,所扩增的P53片段长度303bp;以逆转录的cDNA为模板,用上述iASPP,P53引物和内参GADPH引物分别行PCR。反应体系为25μl(ddH2O 13μl;模板cDNA 5μl;10×Easy Taq Buffer 2.5μl;dNTP 2μl;上游引物1μl;下游引物1μl;Easy Taq DNA聚合酶0.5μl;Total 25μl)。反应条件为:95℃预变性5min,剩余34个循环95℃变性50s,55℃退火50s,72℃延伸50s;最后72℃延伸5min,共35个循环。PCR产物经含花青素的1%的琼脂糖凝胶电泳鉴定,并在紫外投射仪下进行观察、拍照,并用凝胶成像系统进行分析。
1.6 Western BlotRGC-5细胞常规培养24h后,将RGC-5细胞分别在60mmHg,80mmHg压力条件下培养48h,收集RGC-5细胞,应用细胞裂解液裂解细胞30min,于4℃,12 000r/min离心5min后取上清液,然后加上样缓冲液并于沸水中煮5 min,以10%浓度的SDS-PAGE电泳分离。电泳完毕后,胶上的蛋白电转移到硝酸纤维素膜上,用5%脱脂奶粉封闭1h,加入一抗(1∶1 000)4℃过夜。TBST液漂洗30min,加入过氧化物酶(HRP)标记的二抗(1∶2 000)室温孵育30min,TBST液漂洗1 h,ECL染色。扫描获得图像。独立实验重复3次。
1.7 统计学方法实验所得数据均采用均数±标准差(¯x±s)表示,组间比较采用t检验,P<0.05表示差异有统计学意义。统计分析采用SPSS 19.0软件包完成。
2 结果
2.1 MTT方法检测压力对RGC-5细胞活力的影响MTT结果提示,随着压力的增加,RGC-5细胞的细胞活力下降,60mmHg压力作用RGC-5细胞48h后使细胞活力下降17.7%,80mmHg压力作用RGC-5细胞48h后使细胞活力下降23.4%,差异均有统计学意义。
2.2 细胞染色检测细胞凋亡Hoe33342染色正常细胞的细胞核呈正常的蓝色,而凋亡细胞的形态学常常发生改变,包括细胞皱缩,染色质浓染,颜色发白,核碎片、凋亡小体的形成。为了检测压力是否诱导RGC-5细胞凋亡,我们用Hoe33342对处理后的RGC-5细胞进行染色,结果显示,压力可以诱导RGC-5细胞发生染色质浓缩,凋亡小体形成,而且随着压力的增加,细胞凋亡现象更加明显,见图1。2.3 RT-PCR为检测iASPP,P53在压力诱导的视网膜神经节细胞(RGC-5)凋亡中表达水平,我们在mRNA水平和蛋白水平对其进行检测。结果显示,60mmHg和80mmHg压力作用RGC-5细胞48h后引起RGC-5细胞中iASPP的mRNA表达减少,P53的mRNA表达增加;蛋白表达水平与mRNA表达水平一致。综上所述,压力可以诱导RGC-5细胞发生凋亡,在凋亡过程中iASPP表达减少,P53表达增加,见图2、3。
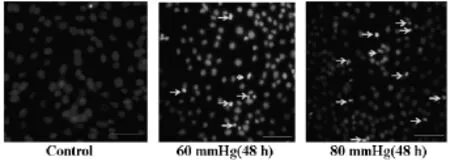
图1 Hoe33342染色检测RGC-5细胞在不同压力下细胞凋亡变化
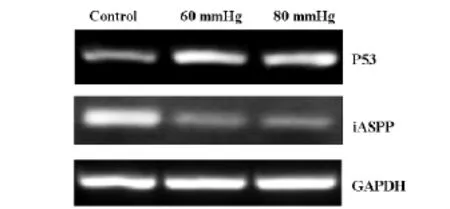
图2 RT-PCR方法检测RGC-5细胞在不同压力下P53和iASPP的mRNA的表达
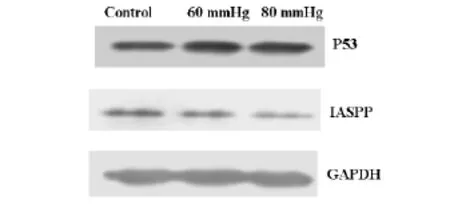
图3 Western-blot方法检测RGC-5细胞在不同压力下P53和iASPP蛋白的表达
3 讨论
青光眼是目前世界上主要不可逆性致盲眼病。青光眼导致视神经萎缩的病理基础是视网膜神经节细胞的凋亡。在众多调控细胞凋亡的因素中,P53与视网膜神经节细胞凋亡关系密切[2]。
p53凋亡刺激蛋白(apoptosis stimulating protein of p53,ASPP)是2001年发现的一个蛋白质家族[3],该家族成员包括ASPP1、ASPP2和iASPP 3个成员。ASPP1和ASPP2通过提高原凋亡基因的活力促进p53依赖的细胞死亡。iASPP基因存在于从线虫到人类等多种生物细胞内,序列高度保守[4,5]。iASPP与同一家族的ASPP1、ASPP2功能相反,它可以与ASPP1和ASPP2竞争结合p53的结合位点,通过特异性抑制p53的促细胞凋亡功能而抑制凋亡,而增加iASPP表达可以增强细胞的抗凋亡能力[6]。有研究发现,通过反义RNA技术或RNA干扰技术使iASPP基因表达沉默后,可以增加秀丽隐杆线虫发生p53依赖的细胞凋亡[1]。Ariel等[7]报道,增加iASPP的表达可以减少视网膜神经节细胞轴突损伤引起的凋亡。减少iASPP基因的表达可以增加促凋亡基因Bax,PUMA的表达,可以引起细胞凋亡或者增加细胞对促凋亡药物的敏感性,进一步提示iASPP具有抗凋亡的作用[8-10]。总之,ASPP家族与P53结合形成ASPP-P53复合物,作用于原凋亡基因启动子,ASPP的微小变化就可以引起P53结合DNA能力发生改变,从而影响p53诱导细胞凋亡的能力。
本研究结果显示,压力能诱导视网膜神经节细胞凋亡。在正常培养的RGC-5细胞中,有P53和 iASPP基因的表达。随着培养体系的压力增加,P53表达呈上升趋势,iASPP表达呈下降趋势,P53和iASPP表达的动态变化,提示它们在压力诱导的RGC-5凋亡中起重要作用,它们可能参与了RGC-5的凋亡进程,同时在压力诱导的RGC-5凋亡中维持iASPP表达水平或使其表达上调可能具有神经保护作用。但是目前我们还需要对iASPP功能进一步研究,才能揭示iASPP在整个细胞网络中的作用。
[1]Bergamaschi D,Samuels Y,O’Neil NJ,et al.IASPP oncoprotein is a key inhibitor of p53conserved from worm to human[J].Nat Genet,2003,33:162.
[2]Wilson AM,Morguette B,Abdouh M.ASPP1/2regulate P53-depedent death of retinal ganglion cells through PUMA and Fas/CD95activation in vivo[J].J Neurosci,2013,33(5):2205.
[3]Samuels-Lev Y,O’Connor DJ,Bergamaschi D,et al.ASPP proteins specifically stimulate the apoptotic function of p53[J].Mol Cell,2001,8(4):781.
[4]Ahn J,Byeon IJ,Byeon CH,et al.Insight into the structural basis of pro-and antiapoptotic p53modulation by ASPP proteins[J].J Biol Chem,2009,284:13812.
[5]Bergamaschi D,Samuels Y,O’Neil NJ,et al.iASPP oncoprotein is a key inhibitor of p53conserved from worm to human[J].Nat Genet,2003,33:162.
[6]Cao L,Huang Q,He J,et al.Elevated expression of iASPP correlates with poor prognosis and chemoresistant in FIGO lb-Ⅱa squamous cell cervical cancer[J].Cell Tissue Res,2013,352(2):361.
[7]Ariel M,Vince A,Sanford L,et al.Inhibitor of apoptosis stimulating protein of p53(iASPP)is required for neuronal survival after axonal injury[J].Plos One,2014,9(4):e94175.
[8]Liu ZJ,Cai Y,Hou L,et al.Effect of RNA interference of iASPP on the apoptosis in MCF-7breast cancer cells[J].Cancer Invest,2008,26:878.
[9]Liu H,Wang M,Diao S,et al.siRNA-mediated down-regulation of iASPP promotes apoptosis induced by etoposide and daunorubicin in leukemia cells expressing wild-type p53[J].Leuk Res,2009,33:1243.
[10]Yun Cai,Shi Qiu,Xing Gao,et al.iASPP inhibits p53-independent apoptosis by inhibiting transcriptional activity of p63/p73on promoters of proapoptotic genes[J].Apoptosis,2012,17:777.
The expression and significance of iASPP gene in the apoptosis of retinal ganglion cells induced by pressure
WANG
Ying,YANG Hai-yan,XU Wen-jing,et al.(The second Hospital of Jinlin University,Changchun130041,China)
ObjectiveThis study was to explore the expression of iASPP on pressure—induced apoptosis of cultured retinal ganglion cells(RGC-5cells).MethodsThe RGC-5cells were cultured under the pressure of 60mmHg and 80mmHg for 48hours.Cell viability were determined by MTT assays.Cells apoptosis was determined by Hoe33342.The expression of iASPP and P53was determined by using semi—quantitative RT—PCR and Western blot respective.ResultsMTT assay showed that the RGC-5cells viability was decreased in a pressure—dependent manner.As the pressure was up,the apoptosis of RGC-5cells was increased,the expression of P53was elevated and the expression of iASPP was decreased.ConclusionThe reduced expression of iASPP gene may increase the activity of p53and promote the apoptosis of RGC-5cells under pressure.Enhancing expression of iASPP may play a role as a neuroprotect.
iASPP;RGC;apoptosis
R775.1
A
2013-11-25)
1007-4287(2014)10-1589-03
吉林省科技厅资助项目(20090460)
*通讯作者
