豆渣蛋白肽的酶解工艺、抗氧化作用及其特性研究
2014-05-25高义霞周向军魏苇娟马子真孙龙龙
高义霞 周向军 魏苇娟 马子真 孙龙龙
(天水师范学院生命科学与化学学院,天水 741001)
中国是世界上种植大豆最主要的国家,有十分悠久的历史。大豆豆渣是豆腐、豆浆及豆制品加工的副产物,约占大豆干重的15%~20%[1]。豆渣富含蛋白质、膳食纤维、脂肪、维生素及黄酮等物质,在癌症预防、心血管疾病、肥胖控制及食品行业有广泛的应用[2]。但由于豆渣含水量高、口感粗糙,同时含有抗胰蛋白酶、皂素等抗营养因子,不易被人体消化吸收和具有豆腥味等不利因素,其多被用作饲料,甚至废弃物丢弃,造成环境污染及资源浪费[3-5]。研究表明,相对分子质量低于1 000的小肽极易被机体吸收,且具有较强的生物活性和功能特性,因此,如何利用豆渣获得高水解度、高得率的小肽值得深入探讨[6-7]。酶解蛋白不仅能生成抗氧化活性增强的小肽,且有助于改善该蛋白的溶解性、起泡性、低致敏性、高稳定性及乳化性等[8-10]。朱淑云等[11]和芦鑫等[12]分别对酶解水飞蓟粕和花生饼粕制备抗氧化肽进行了研究,为其加工利用扩开了新的途径。本试验对酶解豆渣蛋白肽的工艺进行研究,以对DPPH自由基清除率为考察指标,采用正交试验确定酶解最佳工艺;探讨其对·OH、O·-2的清除率、总还原力及其温度、酸碱稳定性。将豆渣蛋白制成高附加值的具有抗氧化作用的肽,有助于扩大豆渣用途,为豆制品加工企业创收提供技术。
1 材料与方法
1.1 材料与试剂
1.5 MG AS1.398 中性蛋白酶、Flavorzyme风味蛋白酶及Alcalase FG 2.4 L碱性蛋白酶:诺维信;胰蛋白酶、DPPH自由基:sigma;抗坏血酸、三羟甲基氨基甲烷(Tris):生工生物工程有限股份有限公司;三氯乙酸-硫代巴比妥酸-盐酸(TCA-TBA-HCl):15 g TCA,0.375 g TBA,2.1 mL HCl依次溶于 100 mL水中,超声处理1 h。
1.2 仪器
TGL-20M型高速台式冷冻离心机:湖南湘仪离心机仪器有限公司;PHS-3D雷磁pH计:上海精密科学有限公司;722型可见分光光度计:上海欣茂有限公司;UV-9600紫外分光光度计:北京瑞利分析仪器有限公司。
1.3 蛋白酶的初筛与复筛
1.3.1 蛋白酶活性测定及酪氨酸标准曲线的制作
参考 SB/T 10317—1999及福林 - 酚法[13]测定蛋白酶活性。酶活定义为1 g固体或1 mL液体蛋白酶,在一定温度和pH条件下,1 min水解酪蛋白产生1 μg酪氨酸为1个活力单位,以U/g(U/mL)表示。1 mL蛋白酶在各最适温度下预热5 min,加入终浓度均为5 mg/mL豆渣蛋白,反应10 min,加入2 mL 0.4 mol/L TCA终止反应,3 500 r/min离心10 min,取上清液 1 mL,加入0.4 mol/L Na2CO3溶液5 mL,福林试剂1 mL,40℃显色20 min,660 nm测光吸收值。同时制作酪氨酸标准曲线,Y=0.010 2X+0.021 7,R2=0.998 2,式中:X 为酪氨酸质量浓度/μg/mL,Y为OD660。
1.3.2 豆渣蛋白的制备及其酶解
[14-15]。豆渣粉碎过80目筛,取筛下物按1∶12(m/V)加入0.1 mol/L NaOH溶液,充分搅拌浸提2 h,5 000 r/min离心15 min,残渣重复浸提1次,合并2次上清液,5 000 r/min离心15 min,上清液调pH 5.4,4℃静止2 h,倾去上清液,10 000 r/min离心10 min,沉淀用蒸馏水洗涤2次,离心收集沉淀,室温干燥,即为豆渣粗蛋白。豆渣粗蛋白得率=豆渣粗蛋白(g)/豆渣(g)×100%,豆渣粗蛋白平均得率为33.17%。20 mg/mL豆渣蛋白溶于0.1 mol/L NaOH,3 500 r/min离心5 min,取上清液5 mL,磷酸缓冲液补至 15 mL,调 pH=7.0,终体积为20 mL,加入100 U中性蛋白酶,摇匀,60℃水浴,TCA终止反应,3 000 r/min离心10 min,上清液即为豆渣蛋白肽。
1.3.3 蛋白酶的初筛
相同豆渣蛋白浓度、酶活、酶解时间及各酶最适温度和最适pH下保温一定时间,灭活终止反应,取上清液稀释一定倍数,测定对DPPH自由基清除率。
1.3.4 蛋白酶作用条件的复筛
初筛的蛋白酶通过单因素和正交试验,确定最适酶解条件。单因素试验:分别在不同酶量、温度、豆渣蛋白浓度及pH条件下进行对DPPH·清除率的测定。正交试验:以酶量、温度、豆渣蛋白浓度及pH进行L9(34)正交试验,见表1。

表1 正交试验因素水平
1.4 抗氧化试验
1.4.1 对DPPH自由基的清除
取0.2 mL蛋白肽于试管中,用水补至2 mL,混匀,加入2 mL 0.04 g/L DPPH·无水乙醇溶液,混匀,室温暗处反应20 min,3 500 r/min离心10 min,取上清液在 517 nm 处测光吸收值[16],Ai;另取 0.2 mL蛋白肽于试管中,用水补充至2 mL,混匀,加入无水乙醇2 mL,室温暗处反应20 min,取上清液测光吸收值,Aj;以2 mL 0.04 g/L DPPH·无水乙醇和2 mL无水乙醇为参比,测定光吸收值,A0。对DPPH·的清除率K/%=[1-(Ai-Aj)/A0]×100%。VC同法操作。
1.4.2 对·OH清除率的测定
参考牛慧慧等[17]和曾卓等[18]方法稍作修改。取1 mL 5 mmol/L邻二氮菲乙醇溶液于试管中,依次加入2 mL pH 7.4 0.2 mol/L磷酸缓冲液和1 mL样品溶剂,混匀,加入1 mL 5 mmol/L硫酸亚铁,混匀后加入1 mL 0.1%双氧水,37℃水浴60 min,536 nm测定光吸收值,A损。未损伤管以1 mL蒸馏水代替损伤管中1 mL 0.1%双氧水,样品管以1 mL蛋白肽代替损伤管中的1 mL样品溶剂,其他同损伤管,测得未损伤管的吸光度(A未)及样品管的吸光度(A样),按下式计算·OH清除率:·OH清除率/%=(A样-A损)/(A未-A损)×100%。VC同法操作。
1.4.3 对 O·-2清除率的测定
参考励建荣等[19]方法并修改。0.05、0.1、0.15、0.2、0.25 mL 蛋白肽于试管中,用 0.1 mmol/L pH 8.2 Tris- HCl缓冲液补至 2.8 mL,加入 0.1 mL 0.018 mmol/L邻苯三酚,迅速混匀并开始计时,每隔30 s测定 A320,共2 min。以0.1 mL 蒸馏水和2.8 mL 0.1 mmol/L pH 8.2 Tris- HCl缓冲液为对照。VC同法操作。拟合光吸收值随时间变化回归方程,斜率为邻苯三酚自氧化速率v,清除率K/%=(v对照-v样品)/v对照×100%。式中:v对照(ΔA对/Δt)为对照组邻苯三酚自氧化速率(ΔA320/min);v样品(ΔA样/t)为加入蛋白肽后邻苯三酚自氧化速率(ΔA320/min)。
1.4.4 总还原力的测定
参考贾俊强等[20]方法。分别取 0.05、0.1、0.15、0.2、0.25 mL 0.2 mg/mL 蛋白肽于试管中,用0.2 mol/LpH 6.6 磷酸缓冲液补至 1 mL,加入 0.75 mL 1%铁氰化钾,混匀后50℃水浴20 min,2 mL 10%TCA终止反应,3 000 r/min离心10 min。取上清液2 mL,加入 0.5 mL 0.1%FeCl3混匀,700 nm 测定光吸收值。VC同法操作。
1.4.5 脂质过氧化抑制作用
0.05、0.1、0.15、0.2 和 0.25 mL 5 mg/mL 蛋白肽于试管中,400 μmol/L FeSO41.0 mL,蛋黄 1.0 mL,pH 7.4 0.1 mol/L 磷酸缓冲液补至相同体积,混匀,避光,37℃水浴60 min。加入2 mL TCA-TBAHCl,100 ℃水浴15 min,迅速冷却,10 000 r/min 离心10 min,取上清液,532 nm测定光吸收值,A1。以相同体积磷酸缓冲液代替蛋白肽为对照,A0,抑制率I/%=(A0-A1)/A0×100。VC同法操作。
1.5 豆渣蛋白肽的特性
1.5.1 豆渣蛋白肽提取率的测定
利用李雪等[21]方法稍作修改。用0.1 mol/L HCl和NaOH调0.05 mg/mL蛋白肽pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0 和 12.0,搅拌混匀30 min,7 500 r/min离心15 min,测定上清液蛋白含量。将豆渣蛋白溶于0.5 mol/L NaOH溶液中,测定总蛋白含量。豆渣蛋白提取率=上清液中蛋白总量(g)/豆渣中粗蛋白总量(g)×100%。蛋白含量测定采用双缩脲法[22]。豆渣蛋白平均提取率为45.12%。
1.5.2 等电点的测定
利用杨立等[23]方法稍作修改。0.05 mg/mL蛋白肽分别以0.1 mol/LHCl和 NaOH调 pH,660 nm测定透光率,作pH值和透光率曲线,透光率最小时对应的pH值为肽等电点。
1.5.3 不同温度下保温时间对清除·OH能力的影响
0.05 mg/mL 蛋白肽,分别在60、70、80、90 ℃条件下水浴加热30、60、90、120、150 min,测定清除·OH 能力。
1.5.4 不同时间下pH对清除·OH能力的影响
0.05 mg/mL 蛋白肽,用 1 mol/L HCl和 NaOH调 pH,使分别为 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0 及 11.0,30、60、90、120 min 后调 pH 值至7.0,测清除·OH 能力。
1.6 统计分析
所有试验数据均平行3次,以平均值±标准差±s)表示,用Excel 2003进行单因素方差分析(P<0.05),用 origin7.5 作图,spss16 进行方差分析。
2 结果与分析
2.1 蛋白酶的筛选
蛋白酶来源不同,对同一种蛋白质的水解作用存在差异,水解产物中肽的长度和结构也不同,因此酶的种类对酶解产物的抗氧化性有较大影响[24]。各蛋白酶作用条件见表2,结果见图1,在30~250 min内,碱性蛋白酶(P <0.01)、胰蛋白酶(P <0.01)、风味蛋白酶(P<0.01)及中性蛋白酶(P<0.01)酶解产物对DPPH·清除率随时间变化均显著。各酶解产物对DPPH·清除率在120 min内均出现了较大波动,无规律可循,这表明酶与底物混合后生成蛋白肽的降解反应仍处于相对不稳定状态。180 min时,中性蛋白酶清除率最大,随后,清除率开始下降,这是因为酶解产物的抗氧化活性与特定时间内水解产生的活性片段的多少、长度及序列等有关[25],随时间的延长,活性多肽可能进一步被水解成无活性的小肽。综合考虑酶解时间及清除率等因素,确定中性蛋白酶为最佳水解酶,酶解时间为180 min。
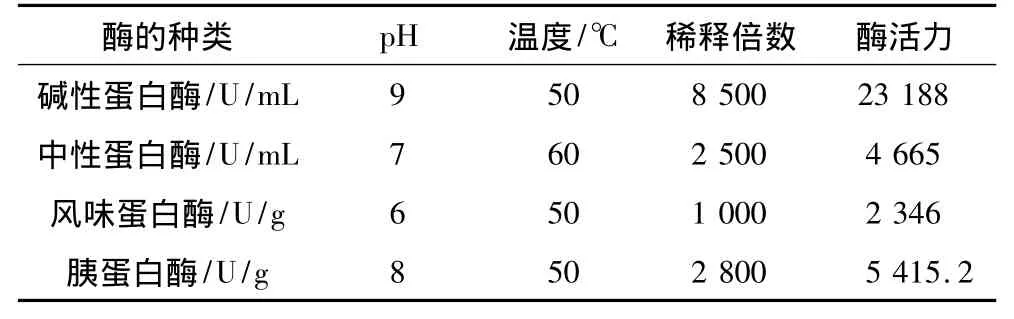
表2 蛋白酶的作用条件及酶活

图1 蛋白酶的筛选
2.2 单因素试验
豆渣蛋白浓度对DPPH·清除率的影响见图2a(P <0.01),在 3.5~4.5 mg/mL 范围内,蛋白肽对DPPH·清除率随其浓度增加而增大,随后继续增加浓度,清除率下降,这是因为在底物浓度较低时,其浓度增加可增大与酶的接触机会,使平衡向产物方向进行,但当酶被底物饱和时,体系流动性差,反而不利于酶与底物的接触[26-27],因此水解速率下降,故豆渣蛋白质量浓度选择 4.5 mg/mL。pH对DPPH·清除率的影响见图2b(P<0.01)。pH影响中性蛋白酶活性部位和豆渣蛋白的解离,从而影响产物的氨基酸组成,最终影响其对DPPH·的清除率。中性蛋白酶推荐的最适pH=7,故选择6.5、7、7.5、8、8.5 对豆渣蛋白进行水解,在 pH 6.5 ~7 范围内,清除率逐渐增加,pH 7.5时清除率最低,当pH>8时,清除率开始下降,这是由于pH升高使中性蛋白酶活性减弱,因而酶解不完全,对DPPH·清除率降低,因此选择pH=7。温度对DPPH·清除率的影响见图2c(P<0.01),中性蛋白酶推荐的最适温度为60 ℃,因此选择50、55、60、65、70 ℃对豆渣蛋白进行水解,在50~65℃范围内,随温度的升高,清除率逐渐增加,65℃时清除率最大,比推荐值高5℃,说明抗氧化肽的分子可能较大,需要增温进一步降解[28]。随后清除率下降,原因是酶分子吸收过多能量,引起维持酶分子空间结构的次级键解体,中性蛋白酶热变性失活,催化能力降低[29],因此选择65℃。酶量对DPPH·清除率的影响见图2d(P<0.01),在50~100 U范围内,清除率随酶量的增加而增大,随后继续增加酶量,清除率先降低又增大,出现波动,这是因为当底物过量时,反应速度与酶量成正比,酶量继续增大时,所有底物与酶结合,达到最大水解;另一方面生成的豆渣蛋白肽也会被酶再次降解,因此酶量选择100 U。
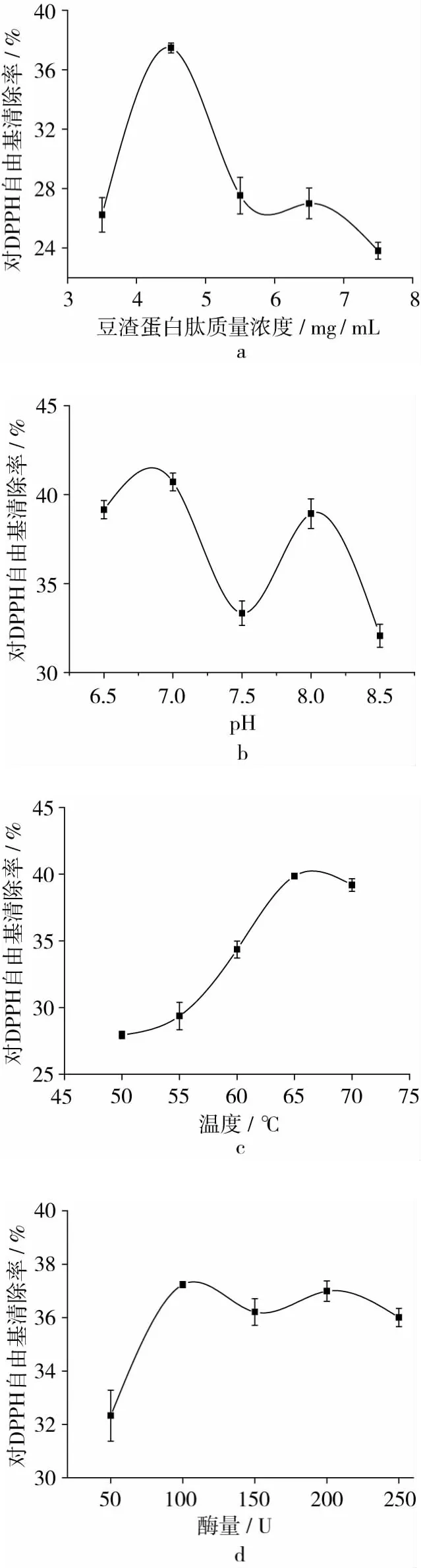
图2 单因素试验
2.3 正交试验
极差和方差分析见表3和表4。pH、酶量及温度对DPPH·清除率影响均极显著(P<0.01),蛋白肽浓度对DPPH·清除率影响不显著(P>0.05)。各因素对该酶解工艺的影响依次为D>B>A>C,即酶量>温度>pH>蛋白肽浓度。最佳酶解工艺为A2B3C1D2,即pH=7,温度70℃,蛋白肽浓度4 mg/mL及酶量100 U,正交试验中第6组即为该组合。
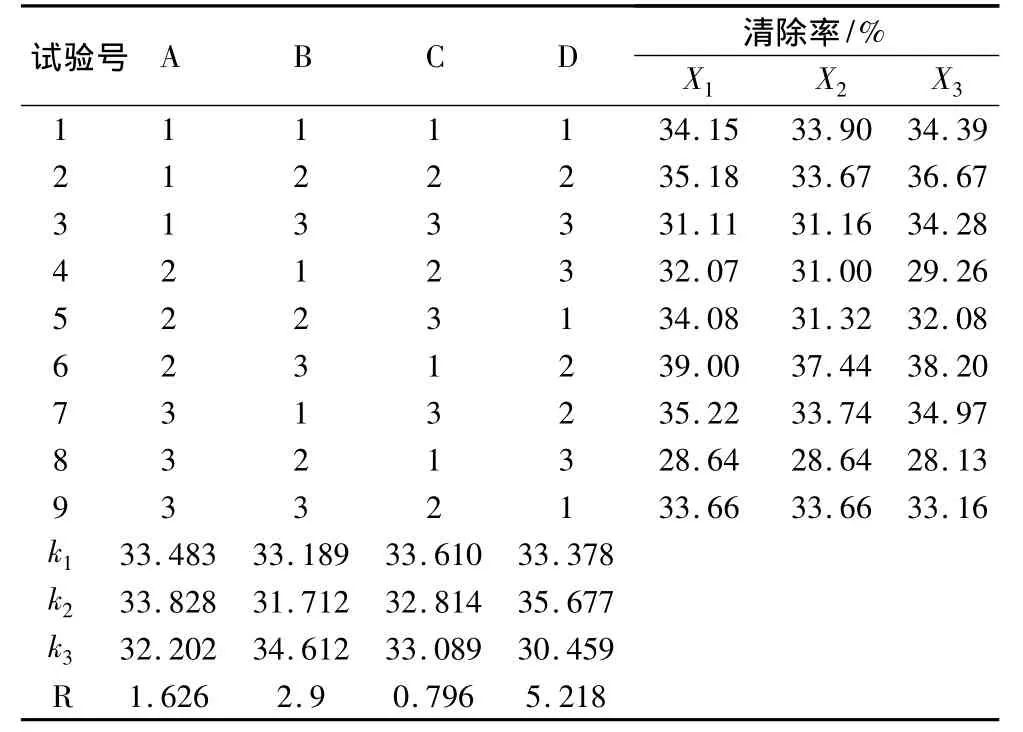
表3 正交设计结果表
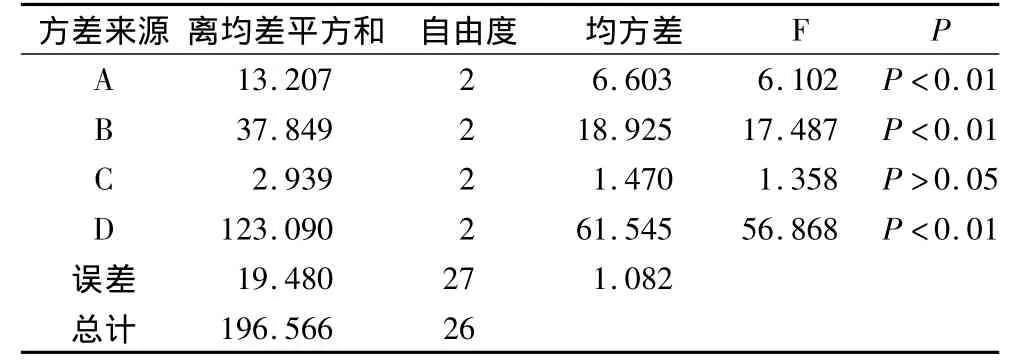
表4 方差分析
2.4 抗氧化性试验
VC及豆渣蛋白肽对·OH清除见图3a,对试验数据进行拟合,回归方程分别为Y=-2 461.3X2+1 531.5X -191.57,R2=0.999,Y= - 6 205.6X2+1 578.6X -9.413,R2=0.993。VC(P < 0.05)及豆渣蛋白肽(P<0.05)对·OH均表现出较强的清除作用,且随其浓度的增大,清除作用呈增大趋势,具有二次方量效关系[30]。VC及豆渣蛋白肽IC50分别为0.274和0.046mg/mL,说明豆渣蛋白肽对·OH清除能力强于VC。VC(P<0.01)及豆渣蛋白肽(P<0.01)对 O·2-的清除作用见图3b,方程:Y=-29 428X2+4 110.5X - 38.003,R2=0.963,Y= - 320.01X2+297.14X+27.247,R2=0.898。VC 及豆渣蛋白肽 IC50分别为0.026 和0.084 mg/mL,说明豆渣蛋白肽对 O·2-清除能力弱于VC。VC(P>0.05)及豆渣蛋白肽(P>0.05)总还原力见图3c。抗氧化剂通过自身的还原作用给出电子或氢原子,与自由基形成稳定的产物,从而终止链式反应,因此还原能力越强,抗氧化作用越强[31]。方程分别为 Y= -3.9 021X2+15.468X+0.01,R2=0.9 97,Y= - 0.005X2+0.156X -0.001,R2=0.998,说明 VC 及豆渣蛋白肽的总还原力均与其浓度成正比,但后者弱于前者。VC(P<0.01)及豆渣蛋白肽(P <0.01)对脂质过氧化的抑制见图3d,后者弱于前者,VC(0.018~0.259 μg/mL)对脂质过氧化抑制能力先增大后减小,豆渣蛋白肽(0.167~0.333 mg/mL)基本保持不变,这可能是高浓度VC将Fe3+还原为Fe2+时产生了自由基,对脂质体氧化起到了促进作用[32],对豆渣蛋白肽而言,可能是其具有较强的螯合能力,能与脂质过氧化所必须的Fe2+离子螯合,从而抑制卵黄脂蛋白过氧化反应的发生[33];同时豆渣蛋白肽浓度已达较高水平,因此清除接近最大。
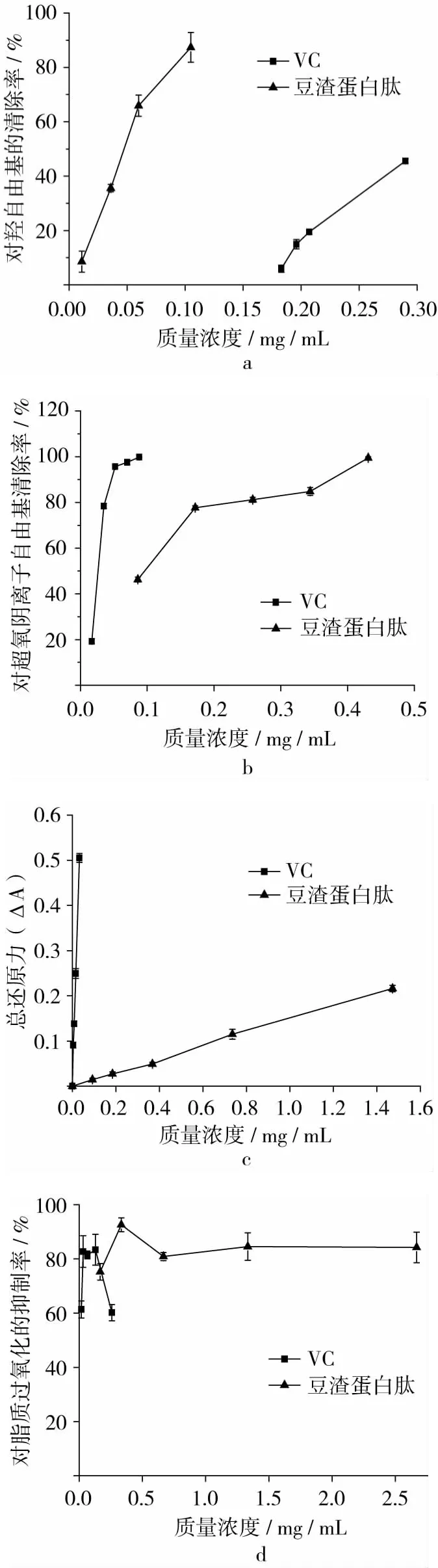
图3 抗氧化试验
2.5 豆渣蛋白肽的特性
不同温度下豆渣蛋白肽对·OH清除率的影响见图4a,当温度高于80℃时,产物对羟自由基的清除率出现下降趋势,这是由于温度升高时,豆渣蛋白肽稳定性降低。豆渣蛋白肽等电点见图4b(P<0.01),pH 3 时,透光率最低,即等电点约为 3,原因是等电点附近蛋白质处于兼性离子状态,总电荷为零,缺乏静电排斥作用,蛋白质分子易聚集、沉淀、因此溶解度最小[34],pH 3~11范围内,透光率增强。由于在酸度条件下才会析出,而一般食品及饮料行业pH均会远离其等电点[23],因此可广泛应用于食品行业中。pH对豆渣蛋白肽提取率的影响见图4c(P<0.01)。高电荷、低疏水性可提高提取率。酶解可提高电荷数目,疏水性逐渐暴露,但前者作用大于后者,因此,整体上增加了豆渣蛋白肽的提取率[35-36]。在 pH 3~12 范围内,豆渣蛋白肽提取率逐步增加,这是因为多肽链断裂并暴露出离子化的氨基和羧基,使分子极性增强,亲水性增加;同时破坏了分子中的疏水作用,使分子间相互排斥作用增加,提高了酶解产物的分散稳定性,进而提高了其提取效果[37-38]。不同时间下pH对·OH清除率的影响见图4d,pH 2~4时,不同时间下产物对·OH清除率均出现下降趋势,这是因为豆渣蛋白肽等电点在pH 3左右,其提取率降低,因此清除率下降,在pH 4~6范围内,不同时间下产物清除率的增加是由于豆渣蛋白肽偏离等电点,电荷增加所致。pH>6.5时,清除率下降,说明碱性条件不利于豆渣蛋白肽活性的稳定。

图4 豆渣蛋白肽的特性
3 讨论与结论
中性蛋白酶为豆渣蛋白肽最佳水解酶,其工艺为:pH 7,温度70℃,蛋白肽浓度4 mg/mL及酶量100 U。VC(0.183~0.29 mg/mL)和豆渣蛋白肽(0.011~0.105 mg/mL)对·OH 具有清除作用,且随浓度增大而增强;VC(0.017~0.088 mg/mL)和豆渣蛋白肽(0.086~0.431 mg/mL)对O·-2具有清除能力。研究表明,肽类清除O·-2能力差于·OH[39],这是因为后者的氧化性强于前者,本试验结果也体现了这一点。VC(0.004~0.032 mg/mL)和豆渣蛋白肽(0.092~1.472 mg/mL)的总还原力均与浓度呈正相关性[40];VC(0.018 ~0.259 μg/mL)对脂质过氧化抑制能力先增大后减小,豆渣蛋白肽(0.167~0.333 mg/mL)基本保持不变。与VC相比较,豆渣蛋白肽的部分抗氧化指标相对较低,可能是酶解产物成分较为复杂,且为初级提纯产品。豆渣蛋白肽等电点约为3.0,在pH 3~12范围内,其提取率逐步增加。
参考文献
[1]葛飞,桂琳,陶玉贵,等.大豆豆渣粗提物清除DPPH自由基活性及其协同效应的研究[J].大豆科学,2010,29(1):113-117
[2]吴占威,胡志和.大豆豆渣的生理功能及其在食品中的应用[J].食品科学,2012,33(19):358 -362
[3]黄晓东,陈玲,胡华俊.豆渣提取物抗氧化性能的研究[J].食品工业科技,2004,25(3):109 -110
[4]张强,牟雪姣,周正义,等.豆渣多糖的提取及其抗氧化活性研究[J].中国粮油学报,2007,22(5):49 -52
[5]何恩铭,齐香君,魏丽娜.大豆豆渣中大豆异黄酮的提取工艺研究[J].西北农业学报,2006,15(4):160 -162
[6]顿新鹏,陈正望.酶法水解米渣蛋白制备大米小分子肽[J].食品科学,2004,25(6):113 -116
[7]张宇昊,王强,周素梅,等.分步酶解制备花生短肽的研究[J].农业工程学报,2008,24(5):275 -279
[8]刘静波,王菲,王翠娜,等.Alcalase酶解蛋清粉制备抗凝血肽的工艺优化[J].吉林大学学报:工学版,2012,42(1):250-255
[9]Tsumura K,Saito T,Tsuge K,et al.Functional properties of soy protein hydrolysates obtained by selective proteolysis[J].LWT - Food Science and Technology,2005,38(3):255 -261
[10]徐红华,刘欣,温其标.复合酶法改善大豆分离蛋白乳化性的试验[J].农业机械学报,2008,39(2):103 -106
[11]芦鑫,朱巧梅,孙强,等.高温压榨花生饼粕酶法制备抗氧化肽的研究[J].中国粮油学报,2013,28(3):99 -104
[12]朱淑云,董英,张海晖,等.水飞蓟粕蛋白的酶解及其酶解物抗氧化活性研究[J].中国粮油学报,2011,26(2):68-72
[13]裴小平,唐道邦,肖更生,等.酶法制备鸡肉蛋白抗氧化肽工艺研究[J].食品与发酵工业,2009,35(11):104-108
[14]周德红,郑为完,祝团结.酶法水解豆渣制备水解蛋白工艺[J].南昌大学学报:工科版,2005,27(2):74-76,83
[15]张君慧,张晖,王兴国,等.大米蛋白酶解产物抗氧化活性及功能性质研究[J].食品工业科技,2008,29(5):73 -76
[16]马海乐,刘斌,李树君,等.酶法制备大米抗氧化肽的蛋白酶筛选[J].农业机械学报,2010,41(11):119-123
[17]牛慧慧,马美湖,杨昆.蛋清肽的抗氧化稳定性与功能特性[J].食品科学,2011,32(15):139-143
[18]曾卓,王金水,付雅丽.鸡肉蛋白的酶解特性及酶解产物的抗氧化性研究[J].食品工业科技,2008,29(6):126 -128
[19]励建荣,齐旦旦,张蕾.蜂王浆水溶性蛋白质及其水解多肽对自由基的清除能力和对胰脂肪酶和α-葡萄糖苷酶的抑制活性[J].中国食品学报,2012,12(9):8-15
[20]贾俊强,马海乐,曲文娟,等.超声预处理大米蛋白制备抗氧化肽[J].农业工程学报,2008,24(8):288 -293
[21]李雪,罗永康,尤娟.草鱼鱼肉蛋白酶解物抗氧化性及功能特性研究[J].中国农业大学学报,2011,16(1):94 -96
[22]安建平,王廷璞.生物化学与分子生物学实验技术教程[M].兰州:兰州大学出版社,2005
[23]杨立,邹波,李玓瓅,等.鱼鳞抗氧化肽的酶法制备工艺及特性[J].食品科学,2011,32(12):115-118
[24]周徐慧,钱平,卢蓉蓉,等.酶法制备汉麻籽蛋白抗氧化肽[J].食品与发酵工业,2008,34(5):76 -81
[25]郑喜群.玉米黄粉的酶解工艺与抗氧化活性肽的制备[D].北京:中国农业大学,2006
[26]李艳红,江波,刘柱,等.鹰嘴豆蛋白Alcalase水解工艺及其体外抗氧化活性的研究[J].浙江大学学报:农业与生命科学版,2007,33(4):392 -399
[27]李建杰,荣瑞芬.碱性蛋白酶对核桃蛋白水解条件的优化研究[J].中国食品学报,2011,11(2):129-135
[28]林琳.鱼皮胶原蛋白的制备及胶原蛋白多肽活性的研究[D].青岛:中国海洋大学,2007
[29]郭勇,郑穗平.酶学[M].广州:华南理工大学出版社,2000
[30]张艳萍,戴志远,张虹.贻贝蛋白的酶解及其酶解物的抗氧化活性研究[J].中国食品学报,2012,12(1):10 -18
[31]鞠兴荣,胡蓉,王丹丹,等.不同酶水解菜籽蛋白的水解物的抗氧化活性研究[J].中国粮油学报,2011,26(4):47-51
[32]莫凤奎,朱澄云,黄松鹤,等.维生素E和维生素 C对大豆磷脂脂质体的抗氧化作用[J].中国药物化学杂志,1997,7(2):121 -124
[33]张强,周正义,马玉涵,等.米糠抗氧化活性的研究[J].中国粮油学报,2008,23(5):9 -12
[34]王素雅,刘胜,鞠兴荣,等.中性蛋白酶限制性水解对高温菜籽粕蛋白功能性质的影响[J].食品与发酵工业,2010,36(1):56 -59
[35]玄国东,何国庆,熊皓平,等.大米蛋白酶法改性及酶解物功能特性研究[J].中国粮油学报,2005,20(3):1-4
[36]郭浩楠,杨荣华,袁晓晴,等.鲢鱼蛋白的酶解及其酶解物功能性质的研究[J].中国食品学报,2010,10(4):106-111
[37]赵国华,陈宗道,王光慈,等.改性对玉米蛋白质功能性质和结构的影响(1)酶解[J].中国粮油学报,2000,15(3):28-31
[38]Mahmoud M I,Malone W T,Cordle C T.Enzymatic hydrolysis of casein:effect of degree of hydrolysis on antigenicity and physical properties[J].Journal of Food Science,1992,57(5):1223-1229
[39]Peng X Y,Xiong Y L,Kong B H.Antioxidant activity of peptide fractions from whey protein hydrolysates as measured by electron spin resonance[J].Food Chemistry,2009,113(1):196-201
[40]Singh N,Rajini P S.Free radical scavenging activity of an aqueous extract of potato peel[J].Food Chemistry,2004,85(4):611-616.
