何首乌提取物对正常与荷肝癌小鼠的急性肝毒性研究Δ
2014-05-21葛珍珍张超冯光远杨红莉石璐缘孙震晓北京中医药大学中药学院北京100102
葛珍珍,张超,冯光远,杨红莉,石璐缘,孙震晓(北京中医药大学中药学院,北京 100102)
何首乌为蓼科植物何首乌Polygonum multiflorum Thunb.的干燥块根,味苦、甘、涩,气微温,归肝、心、肾经,具有解毒、消痈、截疟、润肠通便之功效[1]。药物性肝损伤(Drug-induced liver injury,DILI)是指由药物本身或其代谢产物引起的肝损伤。目前已知,数以千计的药物可引起肝损伤或有潜在肝毒性;很多药物的赋形剂、中草药以及保健药亦有导致肝损伤的可能[2]。临床报道何首乌有一定肝毒性,症状类似急性肝炎[3-5],会加重肝功能异常病情;服用何首乌可对乙肝患者造成较严重的肝损伤[6]。笔者在体外筛选何首乌肝毒性成分时发现,何首乌乙醇提取物大孔树脂吸附后95%乙醇洗脱部位(简称R95部位)及其主要成分大黄素能明显诱导人肝实质细胞凋亡[7],但进一步动物实验研究发现R95部位及大黄素的肝毒性不明显(尚未发表)。另外,何首乌乙醇提取物大孔树脂吸附后50%乙醇洗脱部位(简称R50部位)对人肝细胞也有一定毒性作用,并在一定质量浓度范围内对人肝癌细胞具较强的杀伤作用而对人肝实质细胞的影响较小,R50部位及其主要成分在动物实验中的表现值得进一步研究[8]。
本研究主要报道何首乌总提物及其R50部位、R50部位主要成分 2,3,5,4’-四羟基二苯乙烯-2-O-β-d-葡糖苷(2,3,5,4’-tetrahydroxystilbene-2-O-β-d-glucoside,TSG)和 大 黄素-8-O-β-d-葡糖苷(Emodin-8-O-β-d-Glucoside,EG)对 ICR正常小鼠的肝毒性,以及R50部位对荷肝癌小鼠肝毒性的实验研究结果,以为其临床应用提供理论依据。
1 材料
1.1 仪器
TGL-20M台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司);AU-400全自动生化分析仪(日本Olympus公司))。
1.2 药材
何首乌药材购自北京同仁堂饮片有限责任公司(批号:701001037),经笔者鉴定为真品。
1.3 药品与试剂
TSG(中国食品药品检定研究院,批号:110844-200908);EG(四川维克奇生物科技有限公司,批号:20714,纯度:≥98%);天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)测试盒均购自南京建成生物工程研究所。
1.4 动物
ICR小鼠60只与荷肝癌H22小鼠40只,♂,体质量(20±2)g,均购自北京大学医学部动物实验中心[实验动物使用许可证号:SCXK(京)2011-0012]。
2 方法
2.1 何首乌总提物与R50部位的提取
常规煎煮获取何首乌总提物,将何首乌总提物用AB-8大孔树脂吸附,先用水洗脱至洗脱液无色,再用50%乙醇洗脱至洗脱液无色,收集R50部位,贮藏,备用。
2.2 何首乌总提物、R50部位及TSG、EG对正常小鼠的影响
2.2.1 分组与给药 50只ICR小鼠随机均分为5组,即正常对照(等容0.5%CMC-Na溶液)组、何首乌总提物(1500mg/kg)组、R50部位(500mg/kg)组、TSG(185mg/kg)组、EG(2mg/kg)组。ig给药,每天1次,连续10d。
2.2.2 一般情况观察 每天观察小鼠被毛、摄食、活动、排便等情况,定期称量小鼠体质量。
2.2.3 指标的测定 (1)AST、ALT活性的测定:按AST、ALT测试盒说明书测定AST、ALT活性。(2)肝脏系数的计算:末次给药1 h后处死小鼠,解剖观察各组小鼠肝脏大体情况,取小鼠肝脏称质量,按脏器质量与体质量的比值,计算肝脏系数。
2.3 R50部位对荷肝癌小鼠的影响
2.3.1 分组与给药 40只荷肝癌H22小鼠随机均分为4组,即模型(等容0.5%CMC-Na溶液)组与R50部位高、中、低剂量(1000、500、250mg/kg)组,另取10只正常小鼠作正常对照(等容0.5%CMC-Na溶液)组。ig给药,每天1次,共10d。
2.3.2 指标的测定 按“2.2.2”与“2.2.3”项下方法测定指标。
2.4 统计学方法
3 结果
3.1 何首乌总提物、R50部位及TSG、EG对正常小鼠的影响
3.1.1 何首乌总提物、R50部位及TSG、EG对正常小鼠一般情况的影响 给药期间各组小鼠一般情况均无异常,体质量增加趋势相同(P>0.05)。何首乌总提物、R50部位及TSG、EG对正常小鼠体质量的影响见图1。
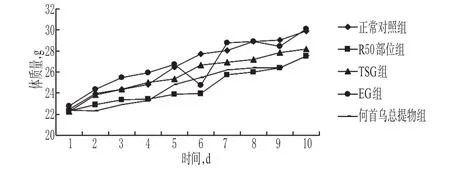
图1 何首乌总提物、R50部位及TSG、EG对正常小鼠体质量的影响Fig 1 Effects of F.multiflorum total extract,R50 part,TSG and EG on body weight of normal mice
3.1.2 何首乌总提物、R50部位及TSG、EG对正常小鼠血清AST、ALT活性的影响 各组小鼠血清AST、ALT活性无明显差异(P>0.05)。何首乌总提物、R50部位及TSG、EG对正常小鼠血清AST、ALT活性的影响见表1。
表1 何首乌总提物、R50部位及TSG、EG对正常小鼠血清AST、ALT活性的影响(,n=10)Tab 1 Effects of P.multiflorum total extract,R50 part,TSG and EG on the activities of AST and ALT in normal mice(,n=10)

表1 何首乌总提物、R50部位及TSG、EG对正常小鼠血清AST、ALT活性的影响(,n=10)Tab 1 Effects of P.multiflorum total extract,R50 part,TSG and EG on the activities of AST and ALT in normal mice(,n=10)
组别正常对照组R50部位组TSG组EG组何首乌总提物组AST,U/L 33.70±5.2737.67±19.9837.58±17.4031.37±2.6235.97±4.07 ALT,U/L 28.68±10.5727.08±17.6327.13±10.7022.98±12.2627.47±12.63
3.1.3 何首乌总提物、R50部位及TSG、EG对正常小鼠肝脏系数的影响 各组小鼠肝质量与肝脏系数无明显差异(P>0.05)。何首乌总提物、R50部位及TSG、EG对正常小鼠肝脏系数的影响见表2。
表2 何首乌总提物、R50部位及TSG、EG对正常小鼠肝脏系数的影响(,n=10)Tab 2 Effects of P.multiflorum total extract,R50 part,TSG and EG on liver coefficient in normal mice(,n=10)
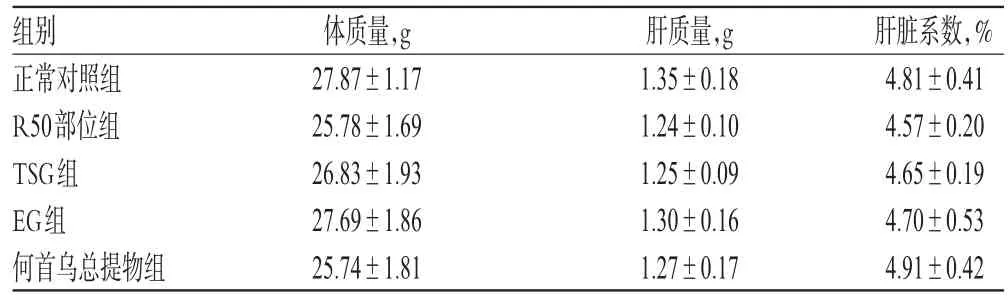
表2 何首乌总提物、R50部位及TSG、EG对正常小鼠肝脏系数的影响(,n=10)Tab 2 Effects of P.multiflorum total extract,R50 part,TSG and EG on liver coefficient in normal mice(,n=10)
组别正常对照组R50部位组TSG组EG组何首乌总提物组体质量,g 27.87±1.1725.78±1.6926.83±1.9327.69±1.8625.74±1.81肝质量,g 1.35±0.181.24±0.101.25±0.091.30±0.161.27±0.17肝脏系数,%4.81±0.414.57±0.204.65±0.194.70±0.534.91±0.42
3.2 R50部位对荷肝癌小鼠的影响
3.2.1 R50部位对荷肝癌小鼠体质量的影响 给药期间,各给药组小鼠均有腹泻现象,随药物质量浓度的增加症状明显加强。实验结束时与正常对照组比较,各给药组小鼠体质量减轻,其中R50部位中剂量组小鼠体质量明显减少。R50部位对荷肝癌小鼠体质量的影响见图2。
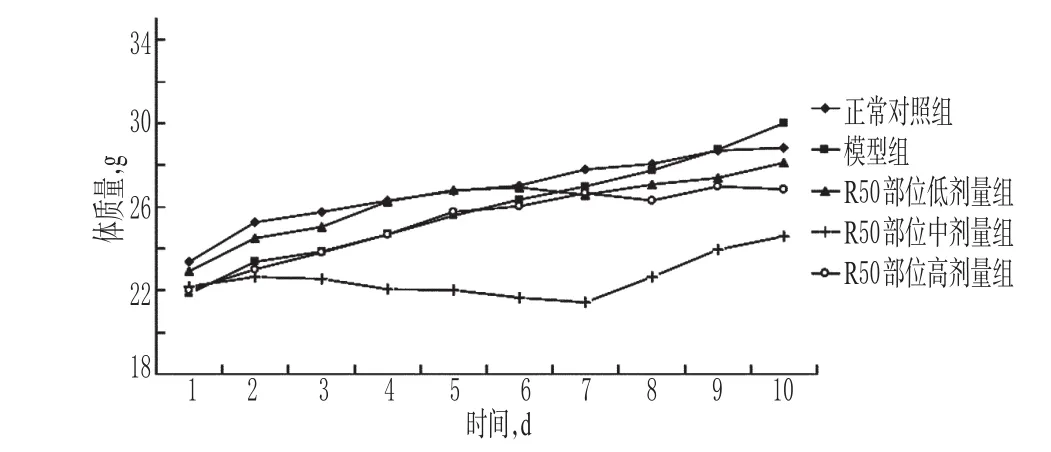
图2 R50部位对荷肝癌小鼠体质量的影响Fig 2 Effects of R50 part on body weight of model mice
3.2.2 R50部位对荷肝癌小鼠血清AST、ALT活性的影响 与正常对照组比较,模型组与R50部位高、中、低剂量组小鼠血清AST、ALT活性增强,差异有统计学意义(P<0.05);与模型组比较,R50部位高、中剂量组小鼠血清ALT活性增强,差异有统计学意义(P<0.01或P<0.05)。R50部位对荷肝癌小鼠血清AST、ALT活性的影响见表3。
表3 R50部位对荷肝癌小鼠血清AST、ALT活性的影响(,n=10)Tab 3 Effects of R50 part on AST and ALT of model mice(,n=10)

表3 R50部位对荷肝癌小鼠血清AST、ALT活性的影响(,n=10)Tab 3 Effects of R50 part on AST and ALT of model mice(,n=10)
与正常对照组比较:*P<0.05;与模型组比较:#P<0.05,##P<0.01vs.normal control group:*P<0.05;vs.model group:#P<0.05,##P<0.01
组别正常对照组模型组R50部位低剂量组R50部位中剂量组R50部位高剂量组ALT,U/L 35.35±3.3664.23±18.83*54.20±17.07*104.72±13.54*##86.65±19.92*#AST,U/L 35.81±10.32106.16±17.13*92.12±30.08*90.43±20.69*174.60±37.47*
3.2.3 连续给药对荷肝癌小鼠肝脏系数的影响 与正常对照组比较,模型组与R50部位高、中、低剂量组小鼠肝脏系数升高,差异有统计学意义(P<0.05);与模型组比较,R50部位中剂量组小鼠肝脏系数升高,差异有统计学意义(P<0.05)。各组小鼠肝质量变化不大,说明肝脏系数的增加主要为小鼠体质量下降引起。连续给药对荷肝癌小鼠肝脏系数的影响见表4。
表4 连续给药对荷肝癌小鼠肝脏系数的影响(,n=10)Tab 4 Effects of successive administration on liver coefficient of model mice(,n=10)
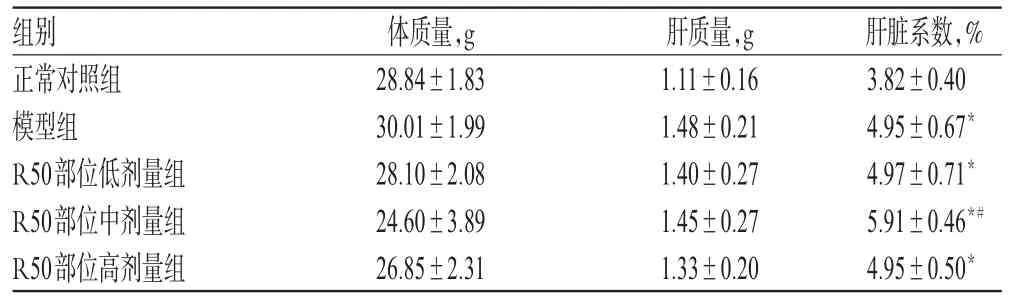
表4 连续给药对荷肝癌小鼠肝脏系数的影响(,n=10)Tab 4 Effects of successive administration on liver coefficient of model mice(,n=10)
与正常对照组比较:*P<0.05;与模型组比较:#P<0.05vs.normal control group:*P<0.05;vs.model group:#P<0.05
组别正常对照组模型组R50部位低剂量组R50部位中剂量组R50部位高剂量组肝脏系数,%3.82±0.404.95±0.67*4.97±0.71*5.91±0.46*#4.95±0.50*体质量,g 28.84±1.8330.01±1.9928.10±2.0824.60±3.8926.85±2.31肝质量,g 1.11±0.161.48±0.211.40±0.271.45±0.271.33±0.20
4 讨论
本研究通过对正常及荷肝癌小鼠ig何首乌提取物、R50部位及TSG、EG,观察各组小鼠被毛、摄食、排泄、体质量等一般情况及肝功能血清酶学、脏脏系数等指标,初步考察并比较何首乌及其所含成分对正常及荷肝癌小鼠肝脏损伤的情况。结果表明,何首乌及其R50部位、TSG、EG对正常小鼠一般情况均没有明显影响,各成分均没有表现明显的肝毒性,但对荷肝癌小鼠,同样剂量的R50部位可引起荷肝癌小鼠腹泻、体质量减轻,并加剧荷肝癌小鼠的肝损伤。
近年来,随着临床上何首乌肝毒性的病例报告增多,其肝毒性研究逐渐受到关注。有报道小鼠单次ig一定剂量的何首乌水提组分或醇提组分可造成急性肝损伤,并呈现一定的“量-时-毒”关系[9]。考虑到临床上何首乌发生急性肝毒性的时间一般在连续用药1~4周,最短1~6 d[3-4],本研究选用何首乌临床用药100倍的剂量作用小鼠10d,考察其肝毒性作用,结果并没有发现明显的肝毒性。虽然选取考察的与肝损伤相关的指标与前者基本相同,如血液生化指标及肝脏系数等,但所用何首乌来源、提取方法、给药时间和剂量、小鼠品种等均不相同,结果尚不好比较。但是,笔者前期用SD大鼠所做的何首乌提取物的30d及60 d的实验与本实验结果基本吻合:大鼠30d及60 d实验中,各给药组大鼠肝脏系数及氨基转移酶(ALT、AST)没有明显变化。虽然大鼠肝脏病理学分析发现,60 d给药组大鼠脂肪变性、炎细胞浸润较明显,并随药物剂量加大而加重,但各给药组均没有发现明显的肝细胞坏死、胆汁淤积等病变[10],这与临床上何首乌引起的急性肝毒性如ALT急剧升高、肝细胞凋亡或坏死等明显不同[3-4]。结合目前血清药理学研究结果[11],考虑何首乌肝毒性的发生可能与患者药物代谢酶异常有关,相关实验研究正在进行中。
近来研究发现,何首乌有一定抗肿瘤作用[12],利用体外细胞系笔者发现R50部位在一定质量浓度范围内对人肝癌细胞有明显的抑制作用而对人肝实质细胞的影响较小[8]。本研究考察了其对荷肝癌小鼠肝脏的作用,结果发现,R50部位加剧了荷肝癌小鼠的肝功能异常。何首乌为补益药类,临床上常用于滋补肝肾的复方,提示临床上对已有肝功能异常的患者如肝炎或肝癌患者使用何首乌或含何首乌制剂时要慎重,注意监测肝功,以免造成二次伤害。
以往有关蒽醌类的实验研究发现,结合蒽醌致泄作用比游离蒽醌强[13]。本研究中R50部位ig荷肝癌小鼠,各给药组小鼠均有腹泻现象,随药物质量浓度的增加症状明显加强,实验结束时各给药组与正常对照组比较体质量减轻,分析原因可能与其含有较多结合蒽醌有关,动物荷肝癌后胃肠功能下降,故R50部位组荷肝癌小鼠腹泻及体质量减轻较明显。
[1]国家药典委员会.中华人民共和国药典:一部[S].2010年版.北京:中国医药科技出版社,2010:164.
[2]刘蕾,张晓岚.药物性肝损伤诊断与防治进展[J].临床肝胆病杂志,2012,8(6):477.
[3]孙震晓,张力.何首乌及其制剂相关肝损害国内文献回顾与分析[J].药物不良反应杂志,2010,12(1):26.
[4]Jung KA,Min HJ,Yoo SS,et al.Drug-induced liver injury:twenty five cases of acute hepatitis following ingestion of Polygonum multiflorum Thunb[J].Gut Liver,2011,5(4):493.
[5]谢先吉,马葵芬,刘莹.何首乌致肝损伤病例分析[J].中国药物警戒,2012,9(32):36.
[6]Yuen MF,Tam S,Fung J,et al.Traditional Chinese medicine causing hepatotoxicity in patients with chronic hepatitis B infection:a 1-year prospective study[J].Aliment Pharmacol Ther,2006,24(8):1179.
[7]张瑞晨,刘斌,孙震晓,等.何首乌提取物对人正常肝细胞L02周期阻滞及凋亡的影响[J].中西医结合学报,2010,8(6):554.
[8]张瑞晨,张超,孙震晓,等.何首乌不同分离部位对人正常肝L02细胞和肝癌HepG2细胞的杀伤作用[J].中国中药杂志,2012,37(12):1830.
[9]黄伟,张亚囡,孙蓉.何首乌不同组分单次给药对小鼠肝毒性“量-时-毒”关系研究[J].中国药物警戒,2011,8(4):193.
[10]张超,张瑞晨,孙震晓.何首乌生品与炮制品对大鼠肝脏的毒理学研究[J].中药材,2013,36(9):1416.
[11]杨红莉,孙震晓.何首乌含药血清对体外培养肝脏细胞活力的影响[J].中国药理学与毒理学杂志,2013,27(1):110.
[12]杨红莉,葛珍珍,孙震晓.何首乌药理研究最新进展[J].中药材,2013,36(10):1713.
[13]张挺,吕圭源.炮制前后何首乌蒽醌类含量的比较研究[J].浙江中医药大学学报,2009,33(6):872.
