姜黄素酚羟基衍生物的合成Δ
2014-05-21齐齐哈尔医学院药学院黑龙江齐齐哈尔161000
王 静,王 鑫,刘 磊,秦 伟(齐齐哈尔医学院药学院,黑龙江 齐齐哈尔 161000)
姜黄素具有抗肿瘤[1]、抗炎[2-5]、抗氧化[6]、抗肝细胞毒性[7]、抗菌[8]等广泛药理作用,且毒副作用小、安全性好,因此发展前景十分广阔[9]。但是,因其水溶性小、生物利用度低等缺点,应用受限[10]。利用结构修饰可提高姜黄素的生物活性,改善姜黄素的应用缺点,为新药开发提供参考[11]。姜黄素化学结构上存在的活性位点主要集中于苯环的取代基、羰基、4-亚甲基,因此这些潜在的活性位点成为其进行化学修饰的重要基团[11]。本研究通过对姜黄素的酚羟基进行结构修饰,得到一个酚羟基的酯类新衍生物,该化合物命名为(E,E)-1,7-双(4-(2-乙酰氧基苯甲酰氧基)-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮,经结构表征后,其化学结构正确。并且,该化合物尚未见文献报道。
1 材料
1.1 仪器
DF-101S型集热式恒温加热磁力搅拌器、RE-5ZC型旋转蒸发器、电热恒温鼓风干燥箱(巩义市予华仪器有限责任公司);DT系列电子天平(常熟市意欧仪器仪表有限公司);高效液相色谱仪(上海天普分析仪器有限公司)。
1.2 药品与试剂
姜黄素(天津市光复精细化工研究所,批号:20120815,纯度:>98%);阿司匹林(山东新华制药股份有限公司,批号:20120714,纯度:>98%);氯化亚砜(天津市福晨化学试剂厂,批号:20111102,纯度:98%);二氯甲烷(天津市福晨化学试剂厂,批号:20120516,纯度:99%);石油醚(沈阳新兴试剂厂,批号:20121224,纯度:99%);乙酸乙酯(丹东市江城化工厂,批号:20120411,纯度:99%);甲醇(上海泰坦科技有限公司,批号:20120723,纯度:98%);三氯甲烷(天津市耀华化学试剂有限责任公司,批号:20121013,纯度:98%);其余试剂均为分析纯,水为蒸馏水。
2 方法与结果
2.1 中间体乙酰水杨酰氯的合成
将阿司匹林5.0 g、氯化亚砜2.0ml、吡啶1滴依次加入到三颈瓶中,缓缓加热至70℃,在此基础上维持温度(70±2)℃,回流70min,冷却至室温,即得中间体乙酰水杨酰氯,密闭,备用。
2.2 姜黄素酚羟基的结构修饰
称取姜黄素0.5 g,置圆底烧瓶中,加入适宜的二氯甲烷使其溶解(加热至30℃完全溶解),冷却至室温;将上步得到的中间体乙酰水杨酰氯滴加入反应体系中,35℃下反应5 h,前2 h每30min点板1次,后3 h每1 h点板1次,直至确定姜黄素衍生物产生,且产率较高,足以能通过柱层析法分离出产物为止。记录结果,确定不同展开剂薄层色谱的检测情况及不同时间下同一展开剂的薄层色谱检测情况。
将最后所得反应液倒入分液漏斗中,加5~10ml水、15~20ml二氯甲烷萃取3次,得有机层粗品,加入无水硫酸钠脱水干燥至少3 h,抽滤,得深棕红色液体。然后将所得液体浓缩,加入适量硅胶炒样。柱层析分离以石油醚-乙酸乙酯(3∶2,V/V)为流动相,旋蒸蒸干后得纯姜黄素酚羟基衍生物。姜黄素酚羟基衍生物的合成路线见图1。
2.3 姜黄素酚羟基衍生物的结构表征
姜黄素酚羟基衍生物为白色固体。通过核磁共振扫描进行目标化合物结构表征:1H-NMR(400 MHz,CDCl3)δ:6.91~8.11(m,16H),6.51(d,J=12hz,2H),3.95(s,2H),2.33(s,6H),1.26(s,3H);13C-NMR(101 MHz,CDCl3)δ:185.11、169.83、169.47、153.04、151.24、141.27、136.82、134.83、132.29、129.65、129.46、126.18、124.46、122,30、121.07、109.75、55.97、55.60、21.03。

图1 姜黄素酚羟基衍生物的合成路线Fig 1 Synthesis route of phenolic hydroxyl derivative of curcumin
2.4 反应条件的筛选
2.4.1 反应溶剂与温度对姜黄素酚羟基衍生物收率的影响 由于姜黄素分子中含有多种不同的官能团,所以反应溶剂和温度的选择对反应收率尤为重要。通过文献研究和初步试验,笔者本着以得到最大收率为标准,在其他条件相同的情况下,分别选择了2种溶剂(二氯甲烷和三氯甲烷)在6个温度下(25、35、45、55、65 ℃和回流温度)进行试验。结果表明,2种溶剂25℃时反应收率均为最低,仍有大部分原料不能反应完全;随着反应温度的提高,反应收率也呈上升趋势,但并非是越高越好,在2种溶剂均为35℃时反应收率最高。因此,初步判定35℃是较为适宜的反应温度。同时,在35℃下、溶剂为二氯甲烷时,其反应收率为24.3%,是目前探索的条件中收率最高的。因此,综合考虑,反应条件为:溶剂为二氯甲烷、反应温度为35℃。反应溶剂与温度对姜黄素酚羟基衍生物收率的影响见表1。

表1 反应溶剂与温度对姜黄素酚羟基衍生物收率的影响(%)Tab 1 Effects of reaction solvent and temperature on yield of phenolic hydroxyl derivative of curcumin(%)
2.4.2 催化剂与反应时间对姜黄素酚羟基衍生物收率的影响
本研究在其他反应条件相同的情况下,探索了不同催化剂[N,N-二甲基甲酰胺(DMF)、碳酸钠、吡啶]和反应时间(1、2、3、4、5 h)对反应收率的影响。结果表明,无论是何种催化剂,反应收率均在反应时间为3 h时为最高。由此可见,并非是反应时间越长,收率越高,3 h为最佳反应时间。而反应时间为3 h时,选择吡啶作为催化剂,收率可达最大值。因此,综合考虑,反应条件为:催化剂为吡啶,反应时间为3 h。催化剂与反应时间对姜黄素酚羟基衍生物收率的影响见表2。
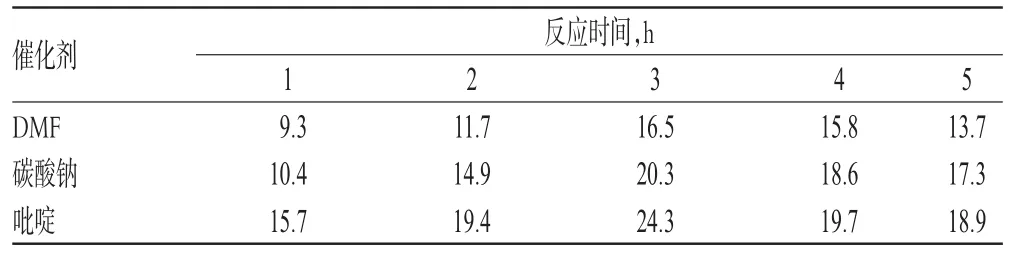
表2 催化剂与反应时间对姜黄素酚羟基衍生物收率的影响(%)Tab 2 Effects of reaction catalyst and time on yield of phenolic hydroxyl derivative of curcumin(%)
2.4.3 流动相对姜黄素酚羟基衍生物收率的影响 姜黄素酚羟基衍生物在用柱色谱分离的过程中,流动相的选择对于其收率的影响很大。流动相极性过大则很难分离,极性过小则会导致溶剂浪费,由此笔者对流动相的选择也进行了探索。选择的流动相体系是乙酸乙酯-石油醚,以比移值(Rf)表征分离度,最佳分离条件原则是0.2<Rf(姜黄素)<0.3、Rf(目标产物)>0.3。当石油醚∶乙酸乙酯=3∶2、4∶3、5∶4(V/V)时目标产物Rf>0.3,其中石油醚∶乙酸乙酸=3∶2(V/V)时,目标产物Rf值相对较大。因此,综合考虑,最佳流动相为石油醚-乙酸乙酯(3∶2,V/V)。流动相对姜黄素酚羟基衍生物收率的影响见表3。

表3 流动相对姜黄素酚羟基衍生物收率的影响Tab 3 Effects of different mobile phase on yield of phenolic hydroxyl derivative of curcumin
3 讨论
合成此姜黄素酚羟基衍生物所需药品、试剂易得,方法简单,合成路线简便,但所得产物较少且不稳定。但是,总的来说,试验比较成功,得到了预期新化合物。此姜黄素酚羟基衍生物是定向设计的目标产物,合成分离得纯品后经过了核磁共振谱进行结构表征,经解谱,该化合物纯度较好,是试验设计的目标化合物。
本研究采用了乙酰水杨酰氯和姜黄素进行亲核取代得到预期的产物,得到的产物较少,可能原因如下:(1)姜黄素原料药用量比较少,使得产物较少;(2)寻找到的催化剂仍不是最佳的,使得产物较少;(3)无论是原料药还是反应液,在转移的过程中都会或多或少的损失,使得产物较少;(4)由于姜黄素和乙酰水杨酰氯在反应过程中有空间位阻,使得反应较少,生成的产物较少;(5)由于研究安全性及姜黄素与新药物实体极性相差不大,所以在进行薄层色谱试验及柱层析试验时并不能找到最佳流动相,不能很好地分离,致姜黄素点提早出现,使得产物较少;(6)其他原料对试验有影响,其他副产物较多,使得目标产物较少。
试验中采用薄层色谱检测反应进程,先从室温开始反应,发现效果不是很好,依次尝试每次升高10℃的方法来加速反应,结果发现35℃时收率较好,产物较明显。继续升温时,收率呈下降趋势,且副产物增多,可能是在升温条件下产物不稳定而分解所致。
综上所述,根据收率的高低进行断定,本合成研究最佳的溶剂为二氯甲烷,最佳催化剂为吡啶,最适宜的反应温度为35℃,最佳反应时间为3 h,根据最佳分离条件0.2<Rf(姜黄素)<0.3、Rf(目标产物)>0.3确定最佳流动相为石油醚-乙酸乙酯(3∶2,V/V)。本产物的合成经过多次优化,得到较好结果,可为今后该类姜黄素衍生物的结构修饰奠定基础。
[1]Guo LY,Cai XF,Lee JJ,et al.Comparison of suppressive effects of demethoxycurcumin and bisdemethoxycurcumin on expressions of inflammatory mediators in vitro and in vivo[J].Arch Pharm Res,2008,31(4):490.
[2]Balasubramanian S,Eckert RL.Keratinocyte proliferation,differentiation,and apoptosis-differential mechanisms of regulation by curcumin,EGCG and apigenin[J].Toxicol Appl Pharmacol,2007,224(3):214.
[3]Gukovsky I,Reyes CN,Vaquero EC,et al.Curcumin ameliorates ethanol and nonethanol experimental pancreatitis[J].Am J Physiol Gastrointest Liver Physiol,2003,284(1):85.
[4]Natarajan C,Bright JJ.Curcumin inhibits experimental allergic encephalomyelitis by blocking IL-12 signaling through janus kinase-STAT pathway in T lymphocytes[J].J Immunol,2002,168(12):6506.
[5]Asai A,Miyazawa T.Dietary curcuminoids prevent highfat diet-induced lipid accumulation in rat liver and eipdidymal adipose tissue[J].J Nutr,2001,131(11):2932.
[6]周钦,兰洋,王远程,等.AP-1在转录水平调控氧化低密度脂蛋白诱导的转化生长因子的表达[J].中华医学杂志,2002,82(19):1346.
[7]Zhao J,Zhao Y,Zheng W,et al.Neuroprotective effectof curcumin on transient focal cerebral ischemia in rats[J].Brain Res,2008,1229(7):224.
[8]张庆云,莫曾南.姜黄素生物利用度研究进展[J].中国药房,2009,20(33):2631.
[9]崔品,翟光喜,娄红祥.姜黄素的研究进展[J].中南药学,2005,3(2):108.
[10]Aggarwal BB,Kumara A,Bhartia AC.Anticancer potential of curcumin preclinical and clinical studies[J].Anticancer Res,2003,23(1A):363.
[11]Anand P,Thomas SG,KunnumakkaraAB,et al.Biological activities of curcumin and its analogues(Congeners)made by man and Mother Nature[J].Biochem Pharmacol,2008,76(11):1590.
