DHA促NGF诱导的PC12细胞分化与BMPs通路关系的研究
2014-05-18石宝燕吴科锋黄俊炎李文德
周 心,石宝燕,吴科锋,高 翔,黄俊炎,黄 韧,李文德,
(1.广东医学院药理学教研室,2.广东天然药物研究与开发重点实验室,广东湛江 524023;3.广东省实验动物监测所,广东 广州 510260)
Omega-3脂肪酸是一组多元不饱和脂肪酸的家族,主要成员包括二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)。其中DHA在中枢神经系统特异性浓集,是神经元细胞膜的主要组成部分[1],而近年的研究发现,DHA对神经分化、神经细胞形态改变以及学习记忆等都有明显的促进作用[2-3]。此外,大量的动物实验及临床实验也证明,DHA的早期膳食供给能提高婴儿后认知能力发展[4]和幼鼠记忆相关的学习能力[5]。相反的,在发育期间缺乏DHA,降低大脑中的DHA含量,可诱发实验动物的认知缺陷[6]。而在年龄相关性神经系统退行性疾病,如阿尔采末病(Alzheimer’s disease,AD)中,患者表现出认知功能障碍,其海马中DHA浓度水平较正常人有明显下降,而补充DHA可有效改善这一症状[7],这说明发育脑中高丰度的DHA参与神经发育调节,而且其含量与认知功能有着密切的联系。尽管DHA已被广泛应用于保健医疗等领域,但其作用的分子机制至今尚不明确。而在已发现的众多调控机制中,骨形态发生蛋白(bone morphogenetic proteins,BMPs)是研究较为深入的明星分子。它是转化生长因子(transforming growth factor-β)超家族的成员,其受/配体信号通路在神经元分化与神经元形态发育中发挥着重要作用[8]。DHA与BMPs相似的功能提示我们,两者可能是通过相同的信号通路起作用的。而PC12细胞是大鼠肾上腺嗜铬瘤细胞克隆化的细胞株,可在神经生长因子NGF诱导下增殖和分化,是目前广泛用来研究神经细胞功能、分化和凋亡的一种细胞培养模型。因此,本实验拟通过PC12细胞观察DHA对NGF诱导PC12细胞分化的作用及其对BMP信号通路的影响。
1 材料与方法
1.1 主要试剂 DMEM(Gibco公司);NGF、DHA和多聚赖氨酸(Sigma公司);胎牛血清、马血清(Hyclone公司);兔抗多克隆抗体MAP-2一抗、兔抗βactin、HRP-labeled Goat Anti-Rabbit IgG(H+L)、HRP-labeled Goat Anti-Mouse IgG(H+L)(Signalway Antibody公司);DAPI(ROCHE公司);兔抗来源的多克隆抗体BMP7一抗(Abcam公司);羊抗来源的多克隆抗体BMPR-Ⅱ一抗、兔抗来源的多克隆抗体p-Smad 1/5/8和鼠抗来源的多克隆抗体BMP4一抗(Santa Cruz公司)、Affinity Purified Antibody cy3 Labeled Goat anti-Rabbit IgG(Kpl公司);BCA蛋白浓度测定试剂盒(碧云天生物有限公司);总蛋白提取试剂盒(北京普利莱基因技术有限公司);其他试剂均为国产分析纯。
1.2 PC12细胞培养 PC12细胞(购自上海细胞生物学研究所细胞库)置于DMEM培养液中,内含10%马血清、5%胎牛血清、青霉素1×105U·L-1、链霉素1×105U·L-1,于37℃、5%CO2条件下培养,待细胞长至80%时,按1∶3分瓶传代,约3 d传代1次,取对数生长期细胞分组进行实验。
1.3 实验分组 PC12细胞用含10%马血清、5%胎牛血清的DMEM培养基以1×108个·L-1接种于预先多聚赖氨酸处理的12孔板中,24 h后换用含1%胎牛血清和1%马血清的DMEM培养基,实验分别设置对照组(100μg·L-1NGF)、DHA组(100μg·L-1NGF+10μmol·L-1DHA)。
1.4 MAP-2与DAPI免疫荧光染色 吸弃培养基,PBS洗2次;预冷的4%多聚甲醛室温固定30 min;PBS洗2次,每次 3 min;0.1%Triton-100作用5 min;PBS洗2次,每次3 min;封闭用正常山羊血清工作液室温封闭20 min;吸出封闭液,勿洗;加入1∶150稀释的MAP-2,4℃过夜;PBS洗3次,每次3 min;加入二抗稀释液稀释的Affinity Purified Antibody cy3 Labeled Goat anti-Rabbit IgG二抗,室温避光孵育50 min;PBS洗3次,每次3 min;加入用蒸馏水稀释至终浓度为2 mg·L-1的DAPI,室温避光孵育15 min;PBS洗3次,每次3 min;倒置荧光相差显微镜观察并拍照。随机选取50个细胞,显微镜测微尺测量其突起长度和突起数目。
1.5 气相色谱法检测PC12细胞DHA的含量 将PC12细胞按照5×108·L-1接种于预先多聚赖氨酸处理含10%马血清、5%胎牛血清DMEM的培养皿,培养24 h后,换用含1%胎牛血清和1%马血清的DMEM培养基,分别在3、6、9 d时取出细胞,吸掉培养基,用含1%BSA的PBS洗2次,冰上刮取细胞于离心管中,4 000 r·min-1离心5 min;倒掉上清,加入1.5 ml正己烷,吹打混匀,用吸管转移至干净的螺旋帽玻璃瓶中;加入1.5 ml 4℃储存的三氟化硼于螺旋帽玻璃瓶中,往瓶中吹氮气约25 s,盖紧瓶盖;于恒温干浴型加热器中,100℃恒温加热1 h;加热结束,置于室温冷却后每瓶中加入1 ml双蒸水,涡旋振荡1 min,3 000 r·min-1离心 5 min;用吸管将瓶中上层液转移至干净的气相色谱瓶;在通风厨中,用氮气吹干气相色谱瓶中的液体;每个气相色谱瓶加入100μl正己烷,涡旋振荡2 min;把气相色谱瓶中的正己烷转移至内存管,再放回气相色谱瓶,盖紧盖子,封口胶封口,-20℃避光保存,切勿倒置。
1.6 W estern blot检测 将PC12细胞按照5×108·L-1接种于预先多聚赖氨酸处理含10%马血清、5%胎牛血清DMEM的培养皿,培养24 h后,换用含1%胎牛血清和1%马血清的DMEM培养基,分别在3、6、9 d时取出细胞,吸掉培养基,用含1%BSA的PBS洗两次,将培养皿中的PC12细胞用细胞刮冰上收集到相应离心管中,2 000 r·min-1离心10 min,PBS漂洗1次,使用总蛋白提取试剂盒提取蛋白,使用BCA蛋白浓度测定试剂盒定量蛋白浓度。每孔上样50μg蛋白,12%SDS-PAGE凝胶电泳分离,电转移至PVDF膜上,5%脱脂奶粉室温封闭1 h。一抗 BMP4(1∶50)、BMP7(2.5 mg·L-1)、BMPR-Ⅱ(1∶50)、p-Smad 1/5/8(1∶50)、β-actin(1∶500),二抗(1∶1 000),化学发光法显示结果,压片曝光,显影定影后扫描。利用Image-Pro plus 6.0分析软件对实验结果进行分析,以目的条带与内参β-actin的平均吸光度比值表示相对表达水平,进行半定量分析。
1.7 统计学处理 每个实验至少重复3次,每次实验至少有3个重复值。实验结果数据均采用¯x±s表示,并采用GraphPad统计软件进行单因素方差(One-Way ANOVA)分析。
Tab 1 Effect of DHA on neurite development of PC12 cells(±s)

Tab 1 Effect of DHA on neurite development of PC12 cells(±s)
**P<0.01 vs control group.
Group Neurite-length/μm Number of neurite 3 d 6 d 9 d Control 7.4±0.8 17.8±5.3 22.4±3.8 0.6±0.5 1.3 d 6 d 9 d 4±1.0 1.8±0.7 DHA 18.6±3.9** 34.3±10.9** 39.7±7.9** 1.8±0.7** 2.8±0.9** 3.3±1.1**
2 结果
2.1 MAP-2免疫荧光法观察DHA对NGF诱导的PC12细胞突起的影响 如Fig 1和Tab 1所示,对照组细胞在培养3 d时,只有少数细胞长出细短的突起;而DHA与NGF共同作用3 d时,细胞突起长度与对照组相比增长。DHA与NGF共同作用6 d时,DHA组与对照组的细胞相比,DHA组细胞的突起增长、突起数目增多;同样的,DHA与NGF共同作用9 d,与对照组相比,DHA组细胞的体积增大,突起长度明显增长,突起数目明显增多。
2.2 气相色谱检测PC12细胞中的DHA含量 气相色谱检测结果如Tab 2所示,在培养3 d时,对照组细胞的DHA含量过低,不在检测限之内,而DHA组细胞的DHA含量为2.48%;培养6 d时,对照组细胞的DHA含量仍低,不在检测限之内,而DHA组细胞的DHA含量为5.68%;培养9 d时,对照组细胞DHA含量为1.3%,DHA组为6.98%。

Fig 1 Promotion effect of DHA on NGF-induced neurite outgrow th in PC12 cells(200×)
Tab 2 DHA content of DHA group and control group analysed by gas chromatography(¯±s)

Tab 2 DHA content of DHA group and control group analysed by gas chromatography(¯±s)
“--”Notwithin the limits of detection.**P<0.01 vs control group.
G r o u p D H A c o n t e n t/%3 d 6 d 9 d C o n t r o l -- -- 1.3 0±0.2 5 D H A 2.4 8±0.2 8**5.6 8±0.7 2**6.9 8±0.5 4**
2.3 W estern blot结果 用Western blot的方法检测 PC12细胞BMP4、BMP7、BMPR-Ⅱ和 p-Smad 1/5/8蛋白的表达。结果如Fig 2所示,与对照组相比,DHA组细胞的BMP7、BMPR-Ⅱ蛋白表达明显增加,以作用6 d的细胞表达量较多;DHA组细胞BMP4和p-Smad 1/5/8表达量高于对照组,且6 d和9 d的细胞表达量较多。
3 讨论
DHA促进大脑发育及改善认知功能的观点在学界已得到普遍认同。近年的研究发现,DHA主要影响脑内神经元的生长状况,且补充DHA可促进成年哺乳动物DG区神经元的分化,增加神经元树突棘的密度和活性神经元的数目,增强神经元突触可塑性[9-10]。此外,DHA还可促进胚胎干细胞、神经元及拟神经细胞如PC12细胞等的增殖和分化能力,并能明显增加各类细胞突起的长度和分支数目[11-13]。从本实验MAP-2免疫细胞化学染色的结果,我们发现诱导9 d的PC12细胞对照组与DHA组相比差异明显,DHA组细胞体积、突起长度和数目都明显比对照组增大和增多,证明了在NGF存在的情况下,DHA可以明显促进PC12细胞突起的生长及提高PC12细胞的分化水平。我们进一步用气相色谱法探讨PC12细胞在给予DHA处理后,细胞DHA含量的变化,气相色谱的结果表明,对照组PC12细胞随着NGF诱导时间的增加,细胞的突起长度不断增长、突起数目不断增多,且细胞中DHA的含量也不断增多,但与DHA组相比,DHA组细胞的DHA含量更高。以上结果进一步表明了补充DHA有助于增强NGF诱导PC12细胞的分化。在中枢神经系统发育过程中,神经元分化和随后的形态发生是其中最为关键的环节。骨形态发生蛋白是转化生长因子超家族的成员,最早被发现是与骨骼系统的发育形成过程密切相关,而越来越多的研究表明,不同亚型的骨形态发生蛋白在神经系统的不同区域呈持续性表达,一系列的实验研究表明,不同亚型的BMPs配体蛋白在神经系统发育过程中发挥重要作用,如BMP2、BMP4和BMP7在顶盖区域有特异的高表达,若采用基因手段干预其表达,则会引起许多中枢神经结构的表达缺失,造成先天畸形[14]。Lein等[15]早在上世纪 90年代就发现 BMP7对交感神经元树突发育有强大的促进作用。也有研究[16]指出BMP7表达的缺失可导致脑膜和海马发育缺陷。进一步的研究也发现[17],另一配体蛋白BMP2具有类似神经营养因子的作用,可诱导PC12细胞系神经分化,促进神经元形态发生,并在体外培养环境中发挥促进GABA能神经元存活和分化的作用[18]。但目前尚无明确的研究证实,DHA促进神经元或拟神经细胞的分化及生长与BMPs配体蛋白的表达有关。
本实验发现,与对照组相比,添加10μmol·L-1DHA可不同程度的上调了BMP4、BMP7、BMPRⅡ和P-smad 1/5/8蛋白的表达,这说明补充DHA可能促进BMPs配体蛋白的表达,促进BMPs信号通路的活化。以上结果表明,增加PC12细胞的DHA摄取,能促进NGF诱导的PC12细胞分化过程,其机制可能与上调BMPs中 BMP4、BMP7蛋白的表达,激活更多的BMPRII受体并与之结合,使I型受体磷酸化后,招募效应分子Smad 1/5/8,使Smad 1/5/8磷酸化水平升高。大量的磷酸化 Smad 1/5/8与Smad4结合并转运至核内,在其他转录因子的协同作用下,形成转录复合物结合至靶基因的调控区域,从而调控靶基因的表达以发挥生物学效应。
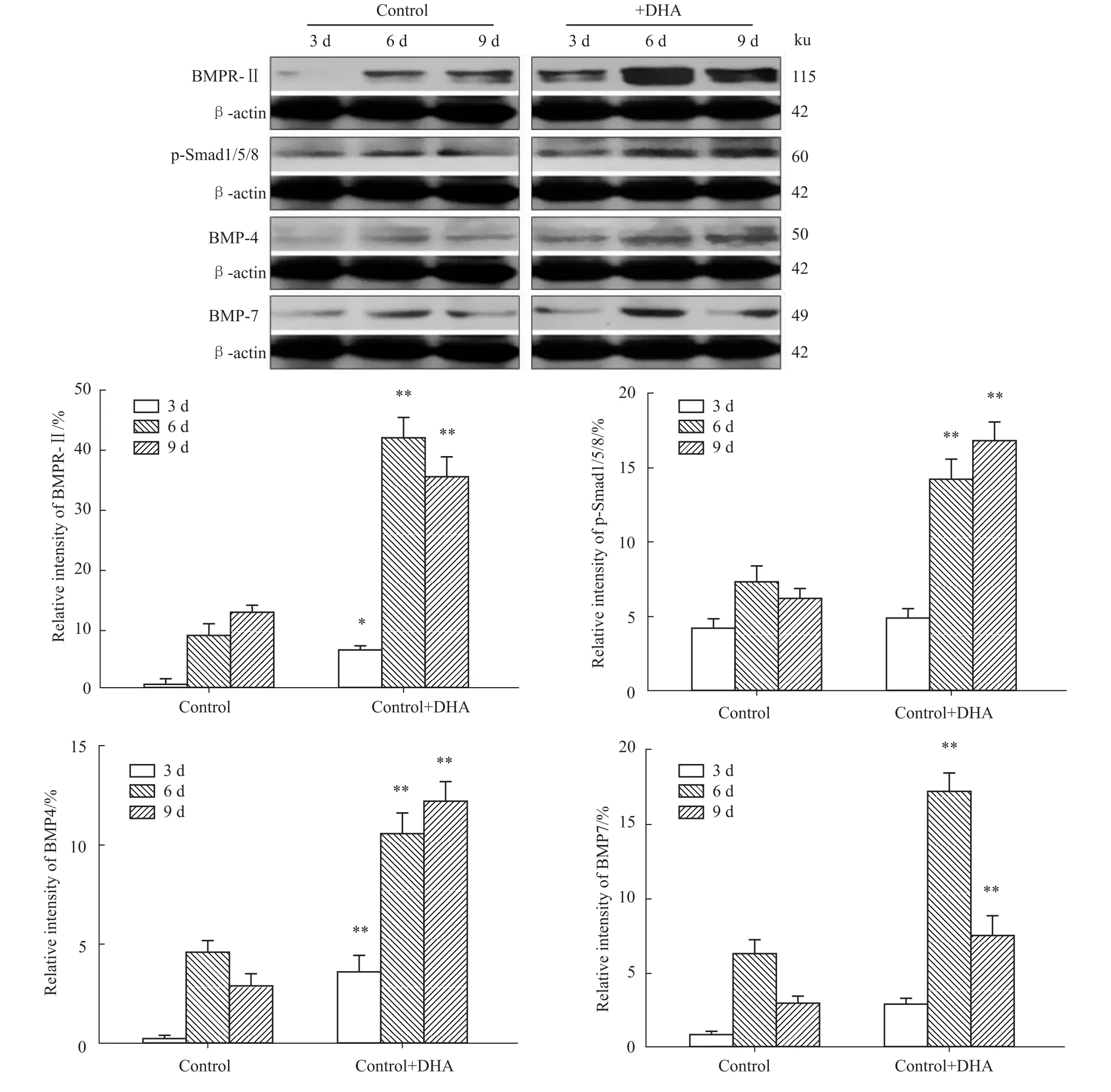
Fig 2 Expression of BMP4,BMP7,BMPR-Ⅱand p-Smad 1/5/8 protein upregulated by DHA¯x±s,n=3)*P<0.05,**P<0.01 vs control
参考文献:
[1] Martin R E,Bazan N G.Changing fatty acid content of growth cone lipids prior to synaptogenesis[J].J Neurochem,1992,59(1):318-25.
[2] Katakura M,Hashimoto M,Okui T,et al.Omega-3 polyunsaturated Fatty acids enhance neuronal differentiation in cultured rat neural Stem Cells[J].Stem Cells Int,2013,490476.
[3] Robson L G,Dyall S,Sidloff D,Michael-Titus A T.Omega-3 polyunsaturated fatty acids increase the neurite outgrowth of rat sensory neurones throughout development and in aged animals[J].Neurobiol Ag,2010,31(4):678-87.
[4] Simmer K,Patole SK,Rao SC.Long-chain polyunsaturated fatty acid supplementation in infants born at term[J].Cochrane Database Syst Rev,2008,23(1):CD000376.
[5] Gamoh S,Hashimoto M,Suqioka K,etal.Chronic administration of docosahexaenoic acid improves referencememory-related learning ability in young rats[J].Neuroscience,1999,93(1):237-41.
[6] Catalan J,Moriquchi T,Slotnick B,et al.Cognitive deficits in docosahexaenoic acid-deficient rats[J].Behav Neurosci,2002,116(6):1022-31.
[7] Horrocks L A,Farooqui A A.Docosahexaenoic acid in the diet:its importance in maintenance and restoration of neuralmembrane function[J].Prostaglandins Leukot Essent Fatty Acids,2004,70(4):361-72.
[8] Miyazono K,Kamiya Y,Morikawa M.Bonemorphogenetic protein receptors and signal transduction[J].J Biochem,2010,147(1):35-51.
[9] Sakamoto T,Cansev M,Wurtman R J.Oral supplementation with docosahexaenoic acid and uridine-5′-monophosphate increases dendritic spine density in adult gerbil hippocampus[J].Brain Res,2007,1182:50-9.
[10] Kan I,Melamed E,Offen D,et al.Docosahexaenoic acid and arachidonic acid are fundamental supplements for the induction of neuronal differentiation[J].J Lipid Res,2007,48(3):513-7.
[11]He C,Qu X,Cui L,et al.Improved spatial learning performance of fat-1mice is associated with enhanced neurogenesis and neuritogenesis by docosahexaenoic acid[J].Proc Natl Acad Sci USA,2009,106(27):11370-5.
[12]Liu JW,Alamguel F G,Bu L,et al.Expression of E-FABP in PC12 cells increases neurite extension during differentiation:involvement of n-3 and n-6 fatty acids[J].J Neurochem,2008,106(5):2015-29.
[13]Msika O,Brand A,Crawford M A,Yavin E.NGF blocks polyunsaturated fatty acids biosynthesis in n-3 fatty acid-supplemented PC12 cells[J].Biochim Biophys Acta,2012,1821(2012):1022-30.
[14]Liu A,Niswander L A.Bonemorphogenetic protein signalling and vertebrate nervous system development[J].Nat Rev Neurosci,2005,6(12):945-54.
[15]Lein P,Johnson M,Guo X,et al.Osteogenic protein-1 induces dendritic growth in rat sympathetic neurons[J].Neuron,1995,15(3):597-605.
[16]Choe Y,Kozlova A,Graf D,Pleasure SJ.Bonemorphogenic protein signaling is amajor determinantof dentate development[J].J Neurosci,2013,33(16):6766-75.
[17]Wu G,Ju L,Jin T,et al.Local delivery of recombinant human bone morphogenetic protein-2 increases axonal regeneration and the expression of tau protein after facial nerve injury[J].J Int Med Res,2010,38(5):1682-8.
[18]Hayashi H,Ishisaki A,Suzuki M,et al.BMP-2 augments FGF-induced differentiation of PC12 cells through upregulation of FGF receptor-1 expression[J].JCell Sci,2001,114(Pt 7):1387-95.