朱红栓菌中两个吩噁嗪酮类生物碱的分离与鉴定
2014-05-17卢卫红吴静姝
朱 峰,卢卫红,陈 忻,吴静姝
1佛山科学技术学院化学与化工系,佛山528000;2佛山科学技术学院动物医学系,佛山528231
朱红栓菌 Trametes cinnabarina(Jacq.)Franeh是一种野生高等真菌,在分类上属于多孔菌科(Polyporaceae),生于栎、桦、锻、榉等阔叶树的腐木上,偶尔生于松木上。分布于华北、西北及黑龙江、吉林、江苏、安徽、浙江、江西、河南、湖南、广东、广西等省区。在香菇、木耳栽培的段木上,常出现此菌,属食菌段木上常见的“杂菌”。它具有多种药用价值,具有祛风除湿,清热解毒,行气,止血,止痒等功效。其提取物对小白鼠肉瘤S180和艾氏腹水瘤的抑制率达90%,能明显增加小鼠免疫器官胸腺和脾脏的重量,提高巨噬细胞的吞噬活力,促进T细胞体外增殖及接触性皮炎反应,提高小鼠血清凝集素滴度,具有很高的开发利用价值[1,2]。
本文首次对采自广东省上川岛的野生朱红栓菌化学成分进行了研究,发现其甲醇粗提物对大肠杆菌、沙门氏菌、链球菌和金黄葡萄球菌表现出有意义的抗菌活性,从该粗提物分离获得两个吩噁嗪酮类生物碱,通过波谱分析分别鉴定为朱红菌素(1)和朱红栓菌素(2),结构式见图1。
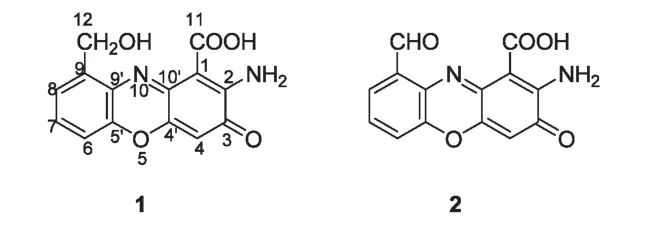
图1 朱红菌素(1)和朱红栓菌素(2)的结构式ig.1 The structures of cinnabarin(1)and tramesanguin(2)
1 材料与方法
1.1 仪器与材料
1.1.1 仪器
INOVA 500 NB超导核磁共振谱仪(美国Varian公司);ZAB-HS双聚焦磁质谱仪(英国VG公司);X4型显微熔点测定仪(上海荆和分析仪器有限公司)。
1.1.2 材料
野生朱红栓菌(2009年6月3日采自广东省上川岛,根据文献[1,2]鉴定为朱红栓菌 Trametes cinna-barina(Jacq.)Franeh);微晶纤维素薄层色谱板。
1.2 方法
1.2.1 甲醇粗提物的制备
137 g风干野生朱红栓菌子实体粉碎后用1 L甲醇室温浸泡提取3次,每次7 d,提取液合并减压浓缩至一半体积,析出红色沉淀,抽滤,得甲醇粗提物。
1.2.2 甲醇粗提物的抗菌活性
甲醇粗提物用DMSO配成1和5 mg/mL浓度样品液。采用K-B纸片扩散法[3],将试验微生物菌株用无菌生理盐水配置成为0.5麦氏单位的悬液,接种于M-H琼脂平皿上,分别贴上1和5 mg/mL甲醇粗提物药敏纸片,于35℃孵育24 h,测定抑菌圈大小。
1.2.3 化合物分离纯化
甲醇粗提物用吡啶重结晶,得红色物质(120 mg)。微晶纤维素薄层色谱分析表明,该红色物质由两个主要成分组成。因此取20 mg红色物质用少量混合溶剂(吡啶∶正丁醇∶水 v/v/v 6∶2∶2)溶解,进一步通过制备微晶纤维素薄层色谱分离纯化(展开溶剂系统为吡啶∶正丁醇∶水v/v/v 6∶2∶2),先后得到两个红色组分,这两个红色组分进一步通过吡啶重结晶,分别得到红色晶体1(5mg)和红色晶体2(9 mg)。
2 结果与讨论
2.1 甲醇粗提物及其抗菌活性
甲醇提取液在浓缩到一半体积时便析出大量红色固体,发现该固体很难再次溶解于甲醇,并且难溶于一般的有机溶剂和水,在吡啶和乙酸中溶解性能有所增加。采用K-B纸片扩散法[3],以链霉素为参照,测定该甲醇粗提物对大肠杆菌、沙门氏菌、链球菌和金黄葡萄球菌等4种试验微生物的体外抗菌活性,试验结果见表1。

表1 朱红栓菌甲醇粗提物的体外抗菌活性Table 1 Antibacterial activities in vitro of themethanol crude extract of Trametes cinnabarina(Jacq.)Franeh
体外抗菌试验结果表明,甲醇粗提物对4种试验菌株显示出有意义的抑菌活性,其中对大肠杆菌的抑菌活性最强。
2.2 化合物结构鉴定
化合物1 红色晶体(吡啶),mp.温度大于300℃时逐渐分解。1H NMR(500 MHz,DMSO-d6)δ:9.56(br s,1H,2-NHα),8.69(br s,1H,2-NHβ),7.55(m,1H,H-7),7.53(m,1H,H-8),7.46(d,J=7.5 Hz,1H,H-6),6.58(s,1H,H-4),4.86(s,2H,H-12);13C NMR(125 MHz,DMSO-d6)δ:177.6(s,C-3),169.0(s,C-11),152.0(s,C-2),151.1(s,C-10'),146.1(s,C-4'),142.0(s,C-5'),138.2(s,C-9),129.2(d,C-7),126.6(s,C-9'),123.6(d,C-8),114.5(d,C-6),105.0(d,C-4),92.2(s,C-1),58.7(s,C-12);FABMS:m/z 287 [M+H]+。NMR谱表明这是一个吩噁嗪酮类生物碱,其波谱数据与文献[4]报道的朱红菌素一致,因此鉴定为朱红菌素,结构式见图1。
化合物2 红色晶体(吡啶),mp.温度大于250℃逐渐分解;1H NMR(500 MHz,DMSO-d6)δ:10.33(s,1H,H-12),9.78(br s,1H,2-NHα),8.90(br s,1H,2-NHβ),7.98(d,J=7.5 Hz,1H,H-8),7.85(d,J=7.8 Hz,1H,H-6),7.72(dd,J=7.5,7.8 Hz,1H,H-7),6.63(s,1H,H-4);13C NMR(125 MHz,DMSO-d6)δ:191.4(d,C-12),168.7(s,C-11),177.8(s,C-3),152.6(s,C-2),150.4(s,C-10'),148.6(s,C-4'),142.0(s,C-5'),131.2(d,C-8),128.9(d,C-7),128.7(s,C-9'),128.4(s,C-9),121.6(d,C-6),105.0(d,C-4),92.1(s,C-1);FABMS:m/z285[M+H]+。化合物2的NMR谱与化合物1的NMR谱非常相似,也是一个吩噁嗪酮类生物碱,其波谱数据与文献[4]报道的朱红栓菌素一致,因此鉴定为朱红栓菌素,结构式见图1。
2.3 讨论
生物碱广泛存在于药用植物中[5,6],并且是许多微生物代谢产物的主要成分[7,8],具有各种各样的生物活性。吩噁嗪酮类生物碱也发现存在于其它多孔菌科高等真菌之中,比如Pycnoporus cinnabari-nus[4]、Trametes cinnabarina var.sanguinea(L.)Pilat[9]、T.cinnabarina Jacq.[10]和 Coriolus sanguineus(Polystictus cinnabarinus)[11],并且被认为是这些真菌呈现鲜艳的红色的主要原因[4,9-12]。近年来,发现海洋放线菌ACMA006也能产生吩噁嗪酮类生物碱[13],其中放线菌素 D还具有显著的抗肿瘤活性[14]。因而吩噁嗪酮类生物碱引起了人们的重视。
由于吩噁嗪酮类生物碱难溶于大多数有机溶剂和水溶液,因此人们一直致力于研究这类化合物的有效提取分离方法。早期对这类化合物的结构分析手段主要是运用红外和拉曼光谱、紫外光谱并结合化学合成与修饰方法[9-12,15-19]。近年来才开始逐渐应用NMR手段对这类化合物进行表征,并导致发现了一些新的吩噁嗪酮类生物碱[4,20,21]。
本文从广东省上川岛采集的野生朱红栓菌分离获得2个吩噁嗪酮类生物碱,经NMR谱鉴定为朱红菌素(1)和朱红栓菌素(2)。由于这2个化合物难溶于一般有机溶剂,因而其生物活性还未得到有效研究。对其结构进行修饰以增强其溶解性,从而深入研究其生物活性,开发其潜在的药用价值,这些工作正在进一步研究之中。
1 Ying JZ(应建浙),Mao XL(卯晓岚).Illustrated handbook of Chinesemedicinal fungus(中国药用真菌图鉴).Beijing:Science Press,1987.218-219.
2 Zhou WN(周文能),Zhang DZ(张东柱).Illustrated handbook ofwild mushroom(野菇图鉴).Taipei:Publishing business Limited by Share Ltd,2005.439.
3 Tan Y(谭瑶),Zhao Q(赵清).Antimicrobial susceptibility tested by Kirby-Bauer disk diffusion method.Lab Med Clin(检验医学与临床),2010,7:2290-2291.
4 Daniel AD,Sylvia U.HPLC and NMR studies of phenoxazone alkaloids from Pycnoporus cinnabarinus.Nat Prod Comm,2009,4:489-498.
5 Huang SZ(黄圣卓),Cao JX(曹金鑫),Jiang SP(蒋思萍),et al.Alkaloids of the Tibetan medicinal plant Aconitum naviculare Stapf.Nat Prod Res Dev(天然产物研究与开发),2011,23:655-657.
6 Wang H(王欢),Wang YH(王跃虎),Chen LJ(陈丽娟),et al.Research progress of alkaloids from Lycoris.Nat Prod Res Dev(天然产物研究与开发),2012,24:691-697.
7 Zhou JY(周俊勇),Huang HB(黄洪波),Wang ZW(汪中文),et al.The Metabolites of indolocarbazole alkloids from themarine-derived Streptomyces sp.SCSIO 1667.Nat Prod Res Dev(天然产物研究与开发),2011,23:415-419
8 Zhu F,Chen GY,Chen X,et al.Aspergicin,a new antibacterial alkaloid produced by mixed fermentation of twomarinederived mangrove epiphytic fungi.Chem Nat Comp,2011,47:767-769.
9 Gripenberg J.XIII.Tramesanguin,the pigment of Trametes cinnabarina var.sanguinea(L.)Pilat.Acta Chem Scand,1963,17:703-708.
10 Gripenberg J.Fungus pigments.I.Cinnabarin,a colouring matter from Trametes cinnabarina Jacq..Acta Chem Scand,1951,5:590-595.
11 Lemberg R.Nitrogenous pigments from the fungus Coriolus sanguineus(Polystictus cinnabarinus).Aust J Experi Biol&Med Sci,1952,30:271-278.
12 Gripenberg J,Honkanen E,Patoharju O.Fungus pigments V.Degradations of cinnabarin.Acta Chem Scand,1957,11:1485-1492.
13 Cao X(曹雪),Yang RL(杨瑞丽),Yuan XW(袁献温),et al.Separation,purification,and structural identification of antitumor active components from marine actinomycete ACMA006.J Ocean Taiwan Str(台湾海峡),2011,30:400-404.
14 Zhang BZ(张邦治),Wang KR(王凯荣),Wang ZZ(王则周),et al.Design,synthesis and in vitro antitumor activity of novel actinomycin D analogs.Chem J Chin Univ(高等学校化学学报),2010,31:1346-1352.
15 Schatz A,Schatz V,Adelson L M,et al.Spectrophotometric studies of Polyporus cinnabarinus and Polyporus sanguineus.Bull Torr Bota Club,1956,83:136-140.
16 Cavill GW,Clezy PS,Whitfield FB.The chemistry of mould metabolites-IV.Reductive acetylation and reoxidation of some phenoxazin-3-ones.Tetrahedron,1961,12:139-145.
17 Gripenberg J,Kivalo P.Polarography of cinnabarin.Suomen Kemistilehti B,1957,30B:134-136.
18 Cavill GWK,Ralph BJ,Tetaz JR,et al.The chemistry of mould metabolites Part I.Isolation and characterization of a red pigment from Coriolus sanguineus Fr..J Chem Soc,1953,525-529.
19 de Oliveira LFC,Le Hyaric M,Berg MM,et al.Raman spectroscopic characterization of cinnabarin produced by the fungus Pycnoporus sanguineus(Fr.)Murr..J Raman Spectr,2007,38:1628-1632.
20 Graf E,Schneider K,Nicholson G,et al.Elloxazinones A and B,new aminophenoxazinones from Streptomyces griseus Acta 2871.JAntibiot,2007,60:277-284.
21 Achenbach H,Blumm E.Investigation of the pigments of Pycnoporus sanguineus-Pycnosanguin and new phenoxazin-3-ones.Arch de Pharm,1989,324:3-6.
