内质网应激介导高脂及棕榈酸致骨骼肌胰岛素抵抗及非诺贝特的干预机制初探
2014-05-17鲍莹莹鲁云霞陈冠军程静静
鲍莹莹,鲁云霞,陈冠军,程静静,章 秋
(1.安徽医科大学附属第一医院内分泌科,安徽合肥 230022;2.安徽医科大学生物化学教研室,安徽 合肥 230032;3.安徽医科大学化学教研室,安徽合肥 230032)
随着人们生活方式和饮食习惯的改变,代谢综合征已成为新型流行性疾病,胰岛素抵抗(insulin resistance,IR)是其重要的病理学特征之一[1]。骨骼肌是体内最大、分布最广的代谢活性组织,约占机体重量的40%,承担了机体绝大部分脂肪酸的摄取和氧化利用,以及胰岛素刺激下70%~90%的葡萄糖吸收,是发生IR的主要外周组织[2],但其参与IR的具体机制目前尚不很清楚。
近年来,内质网应激(endoplasmic reticulum stress,ERS)作为IR和肥胖发生的重要环节,已引起了广泛的关注[3]。非诺贝特(fenofibrate,FF)是临床常用的调脂药,可降脂、抗炎、抗氧化应激和改善IR,但尚无其参与 ERS介导骨骼肌 IR的报道[4]。本研究拟通过动物实验研究非诺贝特对高脂血症大鼠骨骼肌组织ERS及IR的影响;非诺贝特酸(fenofibric acid,FA)是非诺贝特在体内的代谢产物,通过细胞验研究FA对棕榈酸(palmitic acid,PA)诱导小鼠骨骼肌细胞C2C12中产生ERS及IR的影响,旨在揭示非诺贝特改善IR的机制是否与减少ERS有关。
1 材料与方法
1.1 实验动物与细胞株 SD大鼠45只,8周龄,清洁级,♀,体质量180~200 g,由安徽医科大学实验动物中心提供,适应性饲养1周。小鼠C2C12骨骼肌细胞株,由中国科学院北京生物物理学研究所刘平生研究员惠赠。
1.2 主要药物与试剂 非诺贝特购自江苏神龙药业有限公司;非诺贝特酸、胰岛素、棕榈酸、衣霉素、无游离脂肪酸的牛血清白蛋白购自美国Sigma公司;DMEM培养基购自美国Invitrogen公司;四季青胎牛血清购自浙江天杭生物科技有限公司;RT逆转录试剂盒购自Fermentas Life Sciences;RNAiso Reagent、Real-time PCR试剂盒购自大连宝生物工程有限公司;所有引物均采用Primer 5.0软件设计,由上海生工生物工程公司合成(Tab 1和Tab 2)。RIPA裂解液购自南京凯基生物科技发展有限公司。鼠抗GAPDH单克隆抗体、鼠抗CHOP单克隆抗体、兔抗Akt和p-Akt多克隆抗体均购自美国CST公司;兔抗GRP78多克隆抗体购自美国Abcam公司;羊抗小鼠二抗、羊抗兔二抗、FITC标记羊抗小鼠二抗购自北京中杉金桥生物技术有限公司;增强化学发光底物检测试剂盒(ECL发光剂)购自碧云天生物技术研究所;DAPI购自Biosharp生物科技有限公司。
1.3 动物和分组 将SD大鼠随机分为标准饮食组(SCD,n=12)和高脂饮食组(HFD,n=33)。SCD组给予标准饲料,由安徽医科大学动物实验中心提供;HFD组给予国际标准化高脂饮食(D12451,脂肪含量为45%)。20周后,取体重明显增加的大鼠24只随机分为HFD组(n=12)和高脂饮食+非诺贝特组(HFD+FF,n=12),HFD组继续给予高脂饮食8周,HFD+FF组在给予高脂饮食的同时给予非诺贝特灌胃治疗,参考文献[5]采用单一剂量(30 mg·kg-1·d-1)干预8周。
1.4 胰岛素抵抗检测 28周时,大鼠禁食12 h,灌胃给予葡萄糖(2 g·kg-1体重,生理盐水配制),分别于0、30、60、90、120 min鼠尾采血测定血糖水平,行葡萄糖耐量实验(GTT);4 d后大鼠禁食4 h,腹腔注射胰岛素(1 U·kg-1体重),分别于 0、30、60、90、120 min鼠尾采血测定血糖水平,行胰岛素耐量实验(ITT)。采血量约为5μl,采血过程中大鼠生命体征平稳。
1.5 血清脂代谢指标测定 所有大鼠禁食12 h后称重,水合氯醛麻醉,腹主动脉取血,3 000 r·min-1离心5 min,分离血清,分析血清葡萄糖(FBG)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
1.6 骨骼肌基因表达的检测 提取各组大鼠比目鱼肌总RNA,逆转录合成cDNA,Real-time RT-PCR分析PPARα及GRP78、CHOP基因的表达,在美国ABI公司StepOnePlus仪上进行扩增,用比较Ct法(△△Ct)分析结果。
1.7 骨骼肌细胞培养 高糖DMEM培养基中添加10%胎牛血清、105IU·L-1青霉素、105IU·L-1链霉素为完全培养基,骨骼肌细胞株C2C12用完全培养基在37℃、5%CO2、95%湿度的条件下培养。当细胞生长密度达80%时,换成含0.5%无游离脂肪酸的牛血清白蛋白(BSA)的DMEM,将细胞分为正常对照组(NC组)、模型组(0.4 mmol·L-1棕榈酸组,PA)、阳性对照药组(1 mg·L-1衣霉素组,TM)、治疗组(0.4 mmol·L-1棕榈酸 +0.2 mmol·L-1非诺贝特酸组,PA+FA),均孵育24 h,PA和FA的作用剂量和时间参考文献[6-7],并根据 RT-PCR结果确定,其中FA提前8 h预孵育。收集细胞用于RTPCR、细胞免疫荧光和Western blot检测。100 nmol·L-1胰岛素刺激细胞30 min后收集蛋白样品,Western blot检测Akt蛋白及p-Akt水平。

Tab 1 Primer sequences used for Realtime RT-PCR analysis of gene expression in rat skeletal muscles

Tab 2 Primer sequences used for RT-PCR analysis of gene expression in mouse skeletal cells
1.8 细胞基因表达的检测 提取各组细胞总RNA,RT逆转录试剂盒逆转录成 cDNA,检测GRP78、CHOP的基因表达,以大鼠GAPDH基因作为内参,在英国TECHNE PCR仪上进行扩增,2%琼脂糖凝胶电泳,检测基因表达水平。
1.9 细胞免疫荧光 4%多聚甲醛4℃固定细胞后,0.5%Triton-100破膜,5%BSA封闭后加鼠抗CHOP单克隆抗体,4℃孵育过夜,FITC标记山羊抗小鼠孵育1 h,DAPI孵育10 min,抗荧光淬灭封片剂封片,激光共聚焦显微镜下观察。
1.10 Western blot 取0.1 g比目鱼肌或1×106的C2C12细胞,RIPA裂解液制备匀浆,12 000 r·min-1、4℃离心15 min,取上清抽提总蛋白。12%SDS-PAGE分离胶和5%SDS-PAGE浓缩胶凝胶电泳后,转移蛋白至PVDF膜,5%脱脂牛奶封闭后,分别孵育 GAPDH、GRP78、Akt、p-Akt一抗,4℃过夜,HRP标记的二抗孵育1.5 h,X线片曝光、显影及定影。
1.11 统计学方法 SPSS 16.0统计软件进行数据分析,所有实验数据以¯x±s表示,多组间均数比较采用方差分析(ANOVA),两两比较采用最小显著差异法(LSD法)。
2 结果
2.1 非诺贝特对高脂血症大鼠体重、糖脂代谢指标的影响 与SCD组相比,28周的国际标准化高脂饮食(D12451)导致 HFD组大鼠体重、血 FBG、TG、TC水平明显增加、HDL-C水平明显下降(P<0.05)。与HFD组相比,8周非诺贝特干预后,HFD+FF组大鼠体重、血FBG、TG水平明显降低、HDL-C水平明显上升(P<0.05);血清TC水平虽然降低,但差异无显著性(P>0.05)。各组大鼠之间血清LDL-C水平差异均无显著性(P>0.05)(Tab 3)。
Tab 3 Effects of fenofibrate on glucose and lipid metabolic parameters in hyperlipidemic rats±s,n=12)

Tab 3 Effects of fenofibrate on glucose and lipid metabolic parameters in hyperlipidemic rats±s,n=12)
*P<0.05 vs SCD group;#P<0.05 vs HFD group
Parameter SCD HFD HFD+FF Body weight/g 294±14 416±19* 352±16#FBG/mmol·L-1 6.03±0.23 8.69±0.30*7.68±0.22#TG/mmol·L-1 0.36±0.07 1.16±0.11*0.69±0.08#TC/mmol·L-1 2.28±0.44 3.92±0.48*3.59±0.45 LDL-C/mmol·L-1 0.41±0.09 0.49±0.08 0.48±0.08 HDL-C/mmol·L-1 1.42±0.13 1.18±0.11*1.39±0.14#
2.2 非诺贝特对高脂血症大鼠胰岛素抵抗的影响GTT和ITT实验都显示HFD组空腹血糖比SCD组、HFD+FF组均高。GTT实验显示,HFD组给予葡萄糖30 min后血糖达高峰,且比SCD组、HFD+FF组峰值均高,此后缓慢下降;与HFD组相比,HFD+FF组空腹血糖降低,给予葡萄糖后30 min时峰值降低,血糖波动较小。ITT实验显示,注射胰岛素后,SCD组血糖迅速下降,30 min时达最低值后血糖缓慢上升;HFD组血糖缓慢下降,且始终维持在较高水平,90 min时达最低值后血糖缓慢上升;HFD+FF组各点血糖值介于HFD和SCD组之间,注射胰岛素后血糖下降至60 min时达最低值,随后缓慢上升(Fig 1)。
2.3 非诺贝特对高脂血症大鼠骨骼肌ERS基因表达的影响 与SCD组相比,HFD组PPARα表达无明显改变(P>0.05),但 HFD+FF组PPARα表达水平明显增加(P<0.05),表明FF明显激活骨骼肌中PPARα的表达。与SCD组相比,HFD组GRP78、CHOP的基因表达水平均明显增加(P<0.05),表明标准化高脂饮食明显激活了骨骼肌组织中的ERS;与HFD组比较,HFD+FF组GRP78和CHOP基因表达水平均明显降低(P<0.05),显示骨骼肌组织中激活的 ERS被明显改善(Fig 2)。Western blot检测了各组大鼠骨骼肌GRP78蛋白表达水平的变化,其结果与mRNA水平的表达改变相一致(Fig 3)。
2.4 非诺贝特酸对棕榈酸诱导的C2C12中ERS基因表达的影响 与NC组相比,PA或TM诱导的骨骼肌细胞GRP78和CHOP的mRNA表达水平均明显增加(P<0.05),表明ERS被激活。PA+FA组GRP78和 CHOP mRNA明显降低(P<0.05),ERS得到明显改善(Fig 4)。Western blot、免疫荧光分别检测各组细胞GRP78和CHOP蛋白表达水平,与其mRNA水平表达变化的结果相一致(Fig 5、6)。PA或TM诱导的C2C12细胞Akt Ser473磷酸化水平明显降低,PA+FA组Akt Ser473磷酸化水平增加(Fig 5)。
3 讨论
ER是细胞内膜型/分泌型蛋白质合成的细胞器,对细胞的营养和能量状况高度敏感,在新合成蛋白的折叠和成熟过程中起重要作用。错误折叠的蛋白质聚集和脂质合成紊乱时,引发未折叠蛋白反应(unfolded protein response,UPR)和 ERS[8-9]。在骨骼肌细胞中,内质网被称为肌浆网(sarcoplasmic reticulum,SR),调控细胞内钙稳态和蛋白质的合成。
已有研究报道高脂饮食可能通过激活骨骼肌的ERS而介导IR[10],而C2C12中ERS也可能介导PA诱导的IR[6]。非诺贝特是PPARα的特异性激动剂,具有抗氧化应激、抑制炎症反应、抗凋亡等作用,可降低2型糖尿病血管并发症的风险[11],但尚无其对骨骼肌ERS影响的报道。本研究的创新之处是通过研究非诺贝特(酸)对高脂血症大鼠骨骼肌组织和细胞中IR和ERS的影响,讨论了非诺贝特改善骨骼肌IR的新机制。
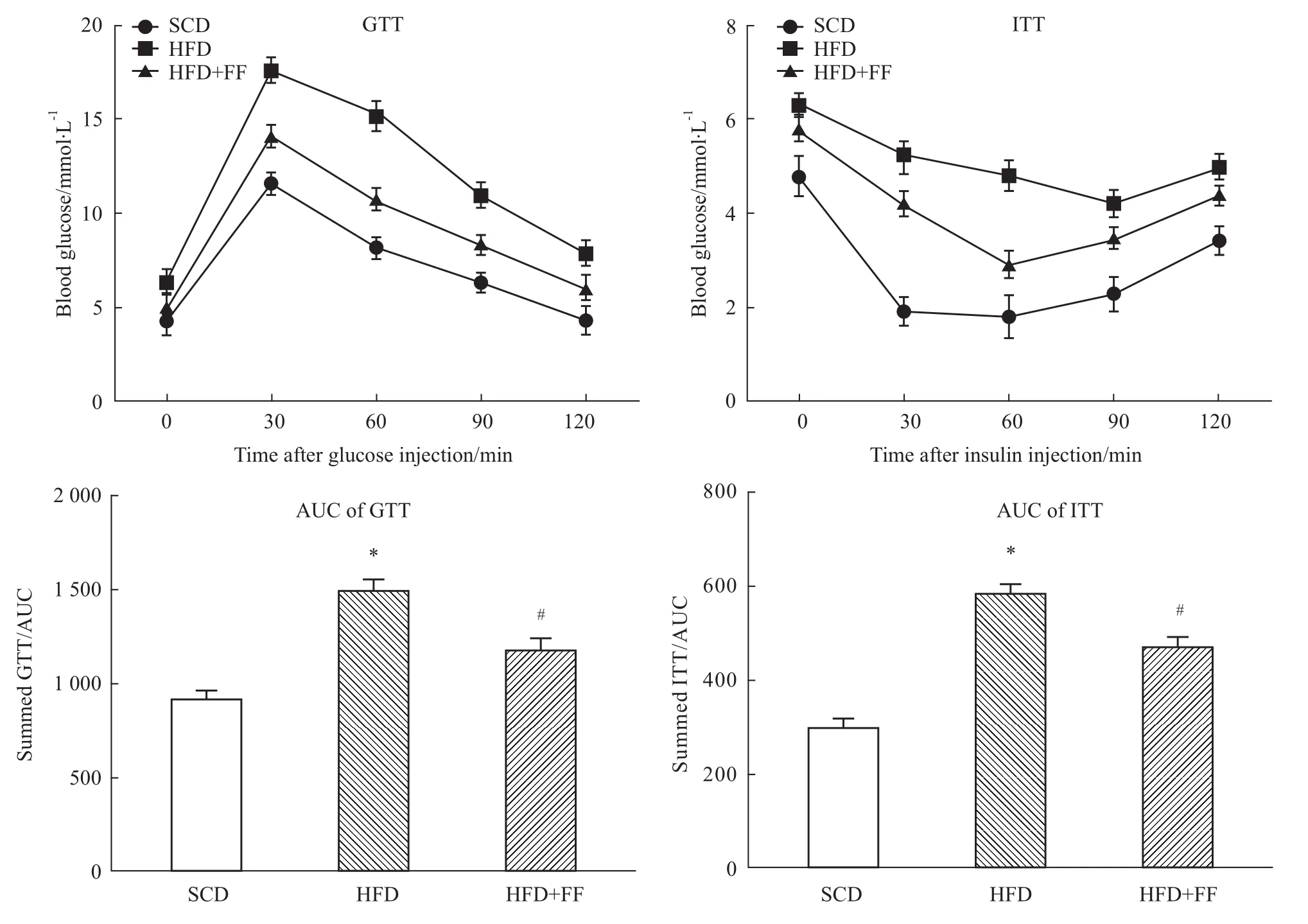
Fig 1 Effects of fenofibrate on insulin resistance in hyperlipidemic rats*P<0.05 vs SCD group;#P<0.05 vs HFD group
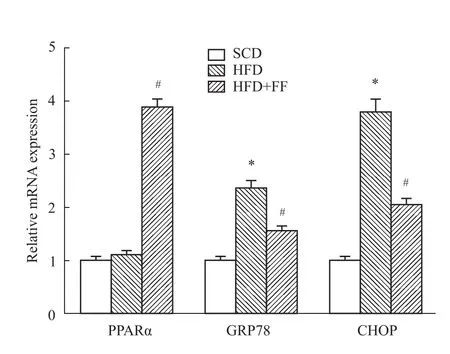
Fig 2 Effects of fenofibrate on mRNA expression of PPARα,GRP78 and CHOP in skeletal muscle of hyperlipidemic ratsReal-time RT-PCR analysis of PPARα,GRP78,CHOP mRNA expression and the relative mRNA level was normalized to a standard housekeeping gene GAPDH.*P<0.05 compared with SCD group;#P<0.05 compared with HFD group
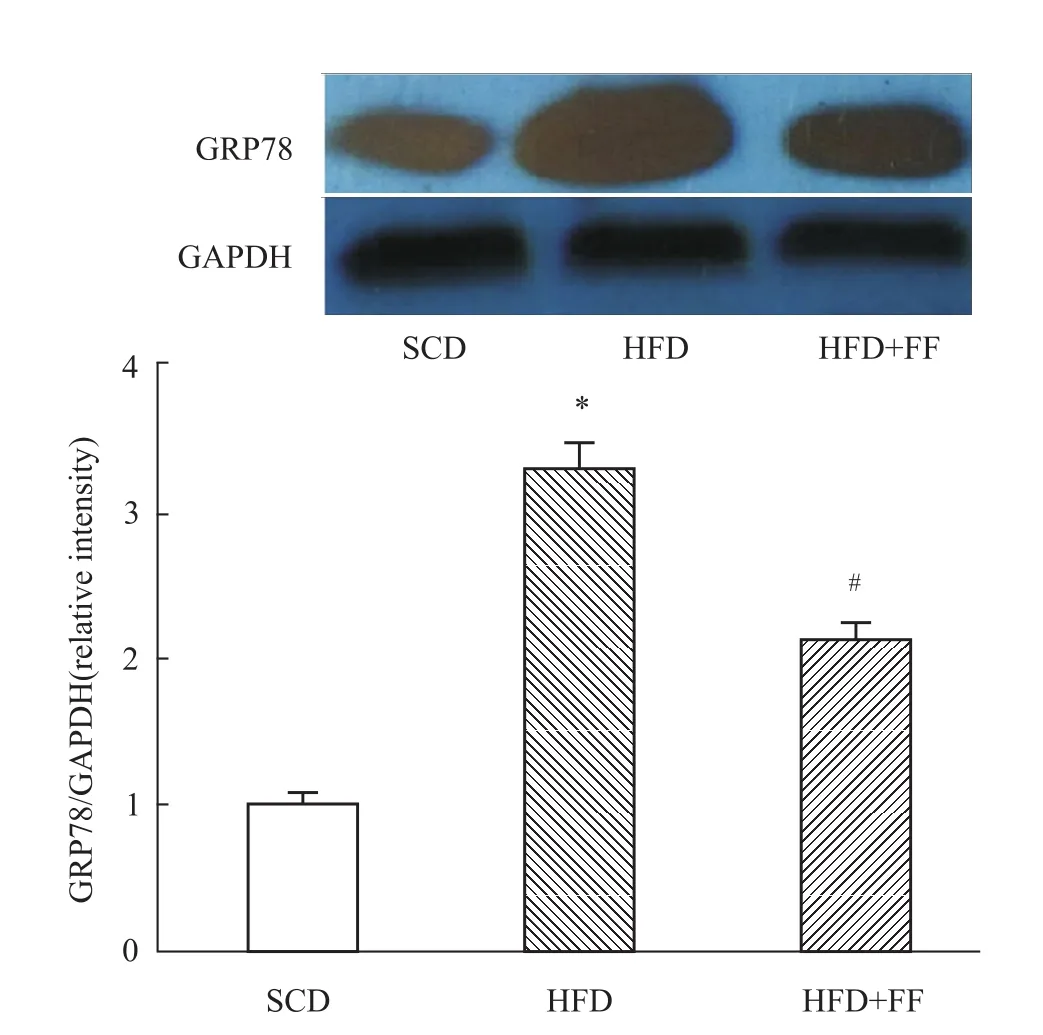
Fig 3 Effects of fenofibrate on GRP78 protein expression in skeletal muscle of hyperlipidemic ratsWestern blot analysis of GRP78 protein and the relative protein level was normalized to GAPDH.*P<0.05 vs SCD group;#P<0.05 vs HFD group.

Fig 4 Effects of fenofibric acid on GRP78 and CHOP mRNA expression in C2C12 induced by palmitic acidNC:normal control;PA:palmitic acid;PA+FA:palmitic acid+fenofibric acid;TM:tunicamycin.*P<0.05 compared with NCgroup;#P<0.05 compared with PA group

Fig 5 Effects of fenofibric acid on GRP78 protein expression and Akt phosphorylation in C2C12 induced by palmitic acid*P<0.05 vs NCgroup;#P<0.05 vs PA group
♀大鼠由于雌激素的保护作用,发展为高脂血症的时间一般比♂大鼠长[12]。本实验通过国际标准化高脂饮食喂养♀SD大鼠28周,HFD组大鼠体重、血FBG、TG、TC水平均明显增加,HDL-C水平明降低,GTT和ITT实验提示HFD组出现明显的IR,说明已成功建立了♀高脂血症伴IR大鼠模型。参考文献[5],非诺贝特(30 mg·kg-1·d-1)灌胃治疗8周后,体重、血FBG、TG水平明显下降,HDL-C水平升高,IR明显改善,说明非诺贝特具有明显的降脂和改善IR的作用。高脂组骨骼肌组织GRP78、CHOP的基因表达水平均明显增加,治疗组这两个指标的表达水平均明显下降,说明标准化高脂饮食已诱导骨骼肌组织产生ERS,非诺贝特具有明显的改善ERS作用。
棕榈酸(PA)是高脂饮食中含量最多的饱和脂肪酸[13],为了进一步明确高脂饮食诱导骨骼肌细胞产生ERS以及非诺贝特的体内代谢形式非诺贝特酸(FA)的保护作用,在细胞实验中,用FA预孵育骨骼肌细胞C2C12后再加入PA诱导,同时选用衣霉素作为诱导产生ERS的阳性对照药。结果显示,PA可诱导C2C12中CHOP和GRP78的mRNA和蛋白表达,同时Akt Ser473的磷酸化被明显抑制,提示PA确实诱导骨骼肌C2C12细胞产生了ERS和IR,而FA的预孵育可明显改善PA诱导的ERS和IR。
有研究提示,非诺贝特可通过增加骨骼肌组织中解偶联蛋白3(UCP3)基因的表达来增加胰岛素的敏感性[14],而本研究从体内和体外实验两方面来研究非诺贝特对高脂血症大鼠骨骼肌组织、非诺贝特酸对棕榈酸诱导骨骼肌细胞 ERS和IR的影响,初步证实了其降脂和改善IR的机制可能与其明显减少ERS水平有关,为开发非诺贝特作为治疗代谢综合征的药物奠定新的理论基础。

Fig 6 Effects of fenofibric acid on CHOP protein expression in C2C12 induced by palmitic acid
参考文献:
[1] Gobato A O,Vasques A C,Zambon M P,et al.Metabolic syndrome and insulin resistance in obese adolescents[J].Rev Paul Pediatr,2014,32(1):55-62.
[2] Mizgier M L,Casas M,Contreras-Ferrat A,et al.Potential role of skeletal muscle glucose metabolism on the regulation of insulin secretion[J].Obes Rev,2014,15(7):587-97.
[3] Cnop M,Foufelle F,Velloso L A.Endoplasmic reticulum stress,obesity and diabetes[J].Trends Mol Med,2012,18(1):59-68.
[4] McKeage K,Keating GM.Fenofibrate:a review of its use in dyslipidaemia[J].Drugs,2011,71(14):1917-46.
[5] Tanabe J,Tamasawa N,Yamashita M,et al.Effects of combined PPAR gamma and PPAR alpha agonist therapy on reverse cholesterol transport in the Zucker diabetic fatty rat[J].Diabetes Obes Met,2008,10(9):772-9.
[6] Peng G,Li L,Liu Y,et al.Oleate blocks palmitate-induced ab-normal lipid distribution,endoplasmic reticulum expansion and stress,and insulin resistance in skeletal muscle[J].Endocrinology,2011,152(6):2206-18.
[7] Chen W L,Chen Y L,Chiang Y M,et al.Fenofibrate lowers lipid accumulation in myotubes by modulating the PPARα/AMPK/FoxO1/ATGL pathway[J].Biochem Pharmacol,2012,84(4):522-31.
[8] Hummasti S,Hotamisligil G S.Endoplasmic reticulum stress and inflammation in obesity and diabetes[J].Circ Res,2010,107(5):579-91.
[9] Hosoi T,Ozawa K.Endoplasmic reticulum stress in disease:mechanisms and therapeutic opportunities[J].Clin Sci,2009,118(1):19-29.
[10]Deldicque L,Cani P D,Philp A,et al.The unfolded protein response is activated in skeletal muscle by high-fat feeding:potential role in the downregulation of protein synthesis[J].Am J Physiol Endocrinol Met,2010,299(5):E695-705.
[11]Miranda S,Gonzalez-Rodriguez A,Garcia-Ramirez M,et al.Beneficial effects of fenofibrate in retinal pigment epithelium by the modulation of stress and survival signaling under diabetic conditions[J].J Cell Physiol,2012,227(6):2352-62.
[12]Kien C L,Bunn J Y,Stevens R,et al.Dietary intake of palmitate and oleate has broad impact on systemic and tissue lipid profiles in humans[J].Am J Clin Nutr,2014,99(3):436-45.
[13]Weigt C,Hertrampf T,Kluxen F M,et al.Molecular effects of ER alpha-and beta-selective agonists on regulation of energy homeostasis in obese female Wistar rats[J].Mol Cell Endocrinol,2013,377(1-2):147-58.
[14]魏翠凤,陈璐璐,王保平,等.非诺贝特对高脂喂养的糖尿病大鼠骨骼肌UCP3基因表达的影响[J].中国药理学通报,2007,23(3):399-402.
[14]Wei C F,Chen L L,Wang B P,et al.Effect of fenofibrate on the expression of uncoupling protein 3 gene in skeletal muscle of diabetic rats fed with high fat diet[J].Chin Pharmacol Bull,2007,23(3):399-402.
