体外活细胞定向迁移研究方法的建立
2014-05-17蔡文杰王铭洁
蔡文杰,王铭洁
(1.上海理工大学医疗器械与食品学院医学基础教研室,上海 200093;2.复旦大学上海医学院生理与病理生理学系,上海 200032)
趋化是指细胞随环境中化学物质的分布梯度作定向运动的现象[1]。许多细胞具有感受环境中趋化因子的能力,从而产生特定的生理与病理生理现象。比如细菌释放炎症因子,中性粒细胞感知后能朝向炎症部位运动,最终到达该部位,发挥吞噬功能,起到免疫防护作用[2]。在创伤修复、组织再生、干细胞归巢以及肿瘤转移等过程中也都存在趋化现象[3]。本研究通过建立活细胞定向迁移研究平台,探索在体外评价细胞运动和趋化能力的标准,为细胞迁移信号通路的研究提供实验方法。
1 材料与方法
1.1 实验材料 蔡司倒置显微镜,Eppendorf显微操纵仪、显微注射仪和毛细管针,腔室盖玻片(丹麦NUNC公司)。HL-60细胞株(ATCC),DMSO、牛血浆来源纤连蛋白、N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸(N-formylmethionyl-leucylphenyl-alanine,fMLP)和 AS605240(美国 SIGMA公司)。
1.2 实验方法
1.2.1 诱导HL-60细胞株成为中性粒细胞 人原髓细胞白血病细胞株(HL-60)在体积分数为0.20的胎牛血清-RPMI 1640培养液中常规培养,用体积分数为0.013的 DMSO处理细胞5~6 d,诱导其分化为中性粒细胞。
1.2.2 慢病毒介导基因表达 把PH-Akt-GFP克隆到慢病毒表达载体FUW2中,将其与另外3个质粒pMDL、pRSV、pCMV同时转染293T细胞,2~3 d后将培养液超速离心得到病毒颗粒。慢病毒感染HL-60细胞后通过流式细胞术分选阳性细胞,最终得到表达PH-Akt-GFP的稳转株。
1.2.3 准备供成像的活细胞 中性粒细胞离心后用改良HBSS缓冲液(137 mmol·L-1NaCl,4 mmol·L-1KCl,1.2 mmol·L-1MgCl2,10 mmol·L-1glucose和 20 mmol·L-1HEPES,pH 7.4)洗涤,再次离心后用含质量分数为0.2%的BSA缓冲液重悬细胞,接种于预先用100 mg·L-1人纤连蛋白包被的腔室盖玻片,置于37℃培养箱中孵育15~20 min,换液后去除未贴壁细胞。
1.2.4 准备显微镜和显微注射系统 趋化因子(1μmol·L-1fMLP)用 0.22μm滤膜过滤,离心 5 min(10 000 r·min-1)去除未溶解杂质。毛细管针内注入10μl fMLP后安装于显微注射仪上,镜下确认针尖端通畅且无气泡。
1.2.5 显微成像 研究单细胞迁移和趋化时,采用低倍(100~200倍)光镜拍摄,图像采集间隔为30~60 s。研究信号分子和骨架的动态分布时,采用高倍(400~630倍)荧光显微镜(或者激光共聚焦)拍摄,图像采集间隔为5 s到10 s。
1.2.6 数据评价 用迁移速度(motility speed)、趋化速度(chemotaxis motility)、趋化指数(chemotaxis index)和持续性(persistency)来评价采集到的数据。得到的结果以¯x±s表示,统计学分析采用单因素方差分析方法比较组间差异。
2 结果
2.1 fMLP可促进中性粒细胞随机迁移 无fMLP处理的HL-60迁移速率为(1.40±0.28)μm·min-1,fMLP处理后细胞迁移速率明显增加,达到(5.94±0.38)μm·min-1,见Fig 1。
2.2 fMLP可诱导中性粒细胞定向迁移 在未放置含1 μmol·L-1fMLP的毛细管针时,细胞随机运动。当把毛细管针放置到观察视野中心位置底面时候,很快引起细胞出现暂时性的铺展。在2 min内,细胞分辨出fMLP的方向,开始朝向毛细管针迁移,直到到达针尖处(趋化因子浓度最高点)。见Fig 2。
2.3 AS605240抑制中性粒细胞定向迁移 细胞预先使用PI3K抑制剂 AS605240(10μmol·L-1)或其溶剂 DMSO处理30min,然后将含1μmol·L-1fMLP毛细管针放置到视野中,开始记录细胞的迁移情况。用Image J软件分析趋化的各种指标,发现AS605240处理后的细胞与对照组细胞相比,迁移速度降低(1.94±0.21)vs(3.12±0.24)μm·min-1,趋化速度降低(0.51±0.13)vs(1.01±0.21)μm·min-1,趋化指数减少(0.19±0.03)vs(0.36±0.05),持续性变差(0.29±0.04)vs(0.47±0.05),且差异皆有统计学意义(Fig 3)。
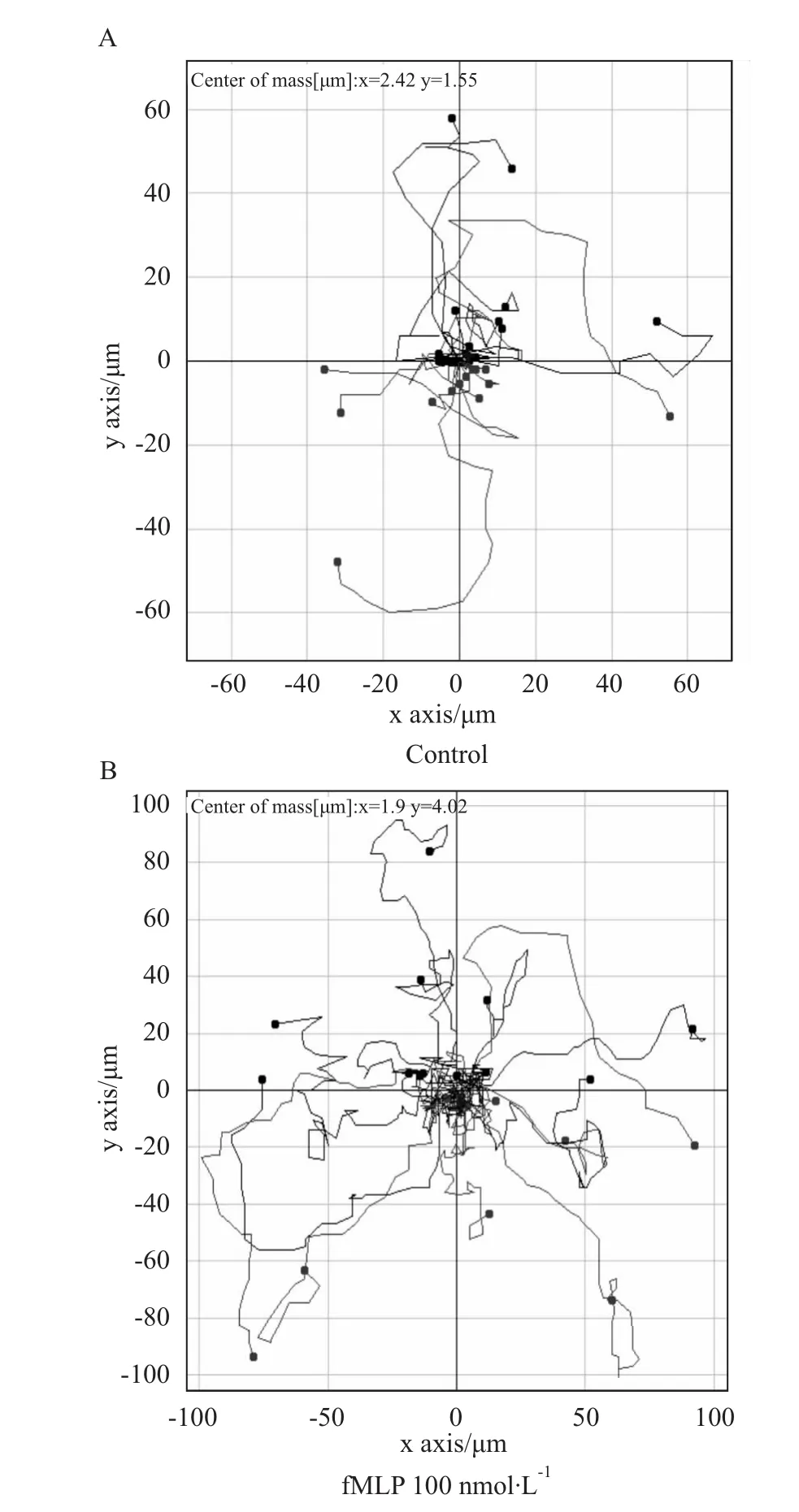
Fig 1 fMLP promotes random migration of HL-60 neutrophils(n=21)A:Control;B:100 nmol·L-1 fMLP treated.P<0.01.

Fig 2 Directional migration of HL-60 neutrophils towards fMLP gradientA:0 min;B:1.5 min;C:24 min;D:Migrating tracks.
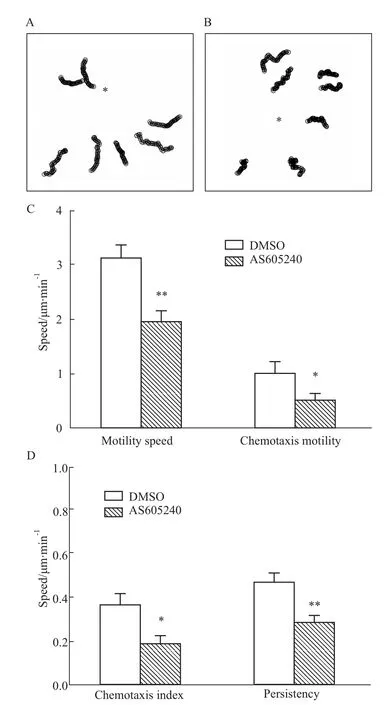
Fig 3 AS605240 inhibits directional migration of HL-60 neutrophils towards fMLP gradientA:Migration track of DMSO treated cells;B:Migration track of AS605240 treated cells;C:Statistics of motility speed and chemotaxis speed;D:Statistics of chemotaxis index and persistency.*in A and B indicates the location of micropipette.In C and D,*P<0.05,**P<0.01 vs DMSO group.
2.4 信号分子标记物在活细胞中的动态分布 含1μmol·L-1fMLP毛细管针放置到视野中后,引起细胞膜PIP3产生增加,PH-Akt-GFP荧光标记物转位到细胞膜上;1 min后,PIP3的产生主要发生在细胞前端朝向高浓度fMLP处;重置毛细管针引起fMLP浓度梯度方向的改变,进而导致PH-Akt-GFP荧光标记物发生重定位,朝向新的浓度梯度(Fig 4)。
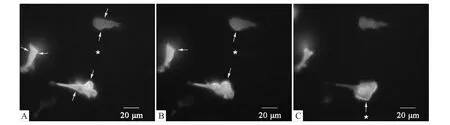
Fig 4 PIP3 probe PH-Akt-GFP relocate with fMLP micropipetteA:10 sec;B:1 min;C:Relocation of the micropipette.*indicates the location of micropipette.Arrows show local accumulation of PH-Akt-GFP on the plasma membrane.
3 讨论
趋化通常包括方向感知、细胞极化和运动3个过程[4],但这几个过程并不是完全独立的,而是相辅相成的。细胞通过膜上的趋化受体感知外界信号,通过信号转导通路,把环境中微弱的趋化因子浓度差异转换为细胞膜上明显的信号分子分布差异,进一步使细胞内与运动相关的分子进行重分布,细胞出现形态上变长,其中一端成为前端,另一端成为后端或称为尾端。前端的信号蛋白如Rac等引起肌动蛋白聚合[5],后者又通过一种正反馈机制激活 PI3K,使得极性增强。PI3K活化后催化PIP2生成PIP3,PIP3可以结合蛋白的PH功能域,因此,当细胞过表达PH功能域后就可以实时监测细胞PI3K的活化状况[6]。中性粒细胞对fMLP的反应以PI3Kγ的激活最为重要[7],因此,当利用了 PI3Kγ特异性的抑制剂AS605240后,细胞的趋化能力明显降低。
评价细胞趋化能力的常用指标有迁移速度、趋化速度、趋化指数和持续性[8],其中,迁移速度是指细胞在单位时间内实际迁移了多少距离,趋化速度是指细胞在单位时间内向趋化源迁移了多少有效距离,趋化指数是指趋化速度除以迁移速度得到的商,持续性是指起点和终点的直线距离除以迁移的总距离。这些指标综合起来可以较好地反映出细胞对趋化源的反应能力和自身的趋化能力。
目前,常用的检测细胞迁移的方法有细胞划痕实验、Transwell小室迁移实验等[9],这些方法简单有效,不需要特殊的仪器设备,缺点是数据比较笼统,反映的是群体迁移,不能完全排除细胞增殖的影响,不能分辨出细胞对所加药物是否具有趋化性。在我们的实验中,药物通过毛细管针缓慢释放,维持一定的浓度梯度,从而可以很好地观察细胞对药物的反应能力,而且,我们是对单细胞进行动态观察,因此得到的信息量很大,可以进行多种后续分析。但该方法对显微镜要求比较高,需要得到高质量的图像,这样才能通过软件把细胞与背景区分开,实现数据的自动分析。虽然在我们的实验中用的是快运动细胞,但相关方法也同样适用于慢运动细胞的趋化,因此,该方法应用前景广泛。
参考文献:
[1] Jin T.Gradient sensing during chemotaxis[J].Curr Opin Cell Biol,2013,25(5):532-7.
[2] Kolaczkowska E,Kubes P.Neutrophil recruitment and function in health and inflammation[J].Nat Rev Immunol,2013,13(3):159-75.
[3] Martins M,Warren S,Kimberley C,et al.Activity of PLCεcontributes to chemotaxis of fibroblasts towards PDGF[J].J Cell Sci,2012,125(Pt 23):5758-69.
[4] Cai H,Devreotes P N.Moving in the right direction:how eukaryotic cells migrate along chemical gradients[J].Semin Cell Dev Biol,2011,22(8):834-41.
[5] 姚红伊,颜小锋,吴希美.Rac小G蛋白与中性粒细胞趋化研究进展[J].中国药理学通报,2010,26(11):1407-9.
[5] Yao H Y,Yan X F,Wu X M.Progress in the study between Rac GTPase and neutrophil chemotaxis[J].Chin Pharmacol Bull,2010,26(11):1407-9.
[6] Cain R J,Ridley A J.Phosphoinositide3-kinases in cell migration[J].Biol Cell,2009,101(1):13-29.
[7] Ferguson G J,Milne L,Kulkarni S,et al.PI(3)K gamma has an important context-dependent role in neutrophil chemokinesis[J].Nat Cell Biol,2007,9(1):86-91.
[8] Tang M,Iijima M,Kamimura Y,et al.Disruption of Pkb signaling restores polarity to cells lacking tumor suppressor pten[J].Mol Biol Cell,2011,22(4):437-47
[9] 胡剑江,雷洪涛,侯燕鸣,王 毅.肿瘤细胞迁移过程的动态评估方法[J].中国药理学通报,2010,26(1):128-31.
[9] Hu JJ,Lei H T,Hou Y M,Wang Y.A new evaluation method for tumor cell migration process[J].Chin Pharmacol Bull,2010,26(1):128-31.
