多沙唑嗪对映体诱发大鼠心房肌收缩力变化的作用机制
2014-05-15李同荟高玲娜孙家安王亚伟任雷鸣
李同荟,高玲娜,孙家安,王亚伟,任雷鸣
(河北医科大学中西医结合学院,中西医结合研究所,河北石家庄 050017)
多沙唑嗪(doxazosin,DOX)作为一种选择性α1受体阻断剂,可以有效降低血压;同时又是治疗良性前列腺增生(benign prostate hyperplasia,BPH)所致下尿路症状的一线药物;因此对伴有BPH的老年高血压患者是一种理想的降压药物。但是在ALLHAT临床试验中[1],DOX组患者充血性心力衰竭发生率较高,导致α受体阻断剂退出了高血压一线治疗药物。在生理状态下,相对于β受体而言,α1受体对心肌收缩力的影响微不足道[2];因此分析DOX影响心肌收缩功能的非α受体机制成为必然。DOX的分子结构中存在一个手性碳原子,临床应用其消旋体[(±)DOX],后者含有等量的左旋多沙唑嗪[(-)DOX]以及右旋多沙唑嗪[(+)DOX]。我们最近发现,DOX两对映体在大鼠离体心房肌标本,产生了非α1受体介导的、完全相反的两种变力效应[3]。
本研究中,我们首先建立了(-)DOX诱发的大鼠离体左心房正性肌力模型以及(+)DOX诱发的大鼠离体左心房负性肌力模型;继而在使用酚苄明阻断α1受体和α2受体、阿托品阻断M胆碱受体、普萘洛尔阻断β受体、吲哚美辛阻断前列腺素合成、维拉帕米阻断L-型钙通道、亚甲蓝抑制可溶性鸟苷酸环化酶以及H-89抑制cAMP依赖性蛋白激酶条件下,探讨了DOX对映体诱发大鼠心房肌正性肌力或负性肌力作用的机制。
1 材料与方法
1.1 仪器、药品、动物BL-420E+生物机能实验系统,成都泰盟科技有限公司;YSD-4G药理生理实验多用仪,安徽蚌埠医学院无线电二厂;SC-15数控超级恒温槽,宁波天恒仪器厂;50μl微量进样器,上海医疗激光仪器厂;YQY-12型氧气减压器,上海减压器厂有限公司。
甲磺酸左旋多沙唑嗪和甲磺酸右旋多沙唑嗪(二者纯度均大于>0.99),华北制药集团新药研究开发有限责任公司。阿托品、普萘洛尔、酚苄明、吲哚美辛、维拉帕米、亚甲蓝、H-89、二甲基亚砜(DMSO),Sigma公司。氯化钠(NaCl)、硫酸镁(MgSO4)、氯化钾(KCl)、碳酸氢钠(NaHCO3)、磷酸二氢钠(NaH2PO4)、葡萄糖(glucose)、氯化钙(CaCl2),国药集团化学试剂有限公司。
Wistar大鼠,♂,250~350 g,河北省实验动物中心。温度(23±1)℃,相对湿度50±0.05,饲养于明暗各12 h的清洁级动物实验室内,自由进食和饮水。
1.2 方法
1.2.1 Krebs营养液的配制 成份为(mmol·L-1):NaCl 118.3、KCl 4.6、CaCl22.5、MgSO41.2、NaH2PO41.0、NaHCO325.0、葡萄糖 11.1。除 NaHCO3、CaCl2和葡萄糖于实验前临时加入外,其他成份均配成高浓度母液并于临用前稀释至所需浓度。配制好的营养液以0.95 O2+0.05 CO2混合气体充分饱和,调pH至7.2~7.4。
1.2.2 标本的制备 以质量浓度为250 g·L-1乌拉坦(1.5 g·kg-1)腹腔注射麻醉后,颈动脉放血处死,打开胸腔,剪断与心脏相连大血管,取出心脏置于0.95 O2+0.05 CO2预饱和的4℃ Krebs溶液中。沿房室沟剪去心室,剪下左心房,在左心耳两端尖部各系一丝线;一端固定于带有刺激电极的支架上,置于麦氏浴槽底部;另一端连接张力换能器。麦氏浴槽内盛有10 ml Krebs溶液,标本持续通以0.95 O2+0.5 CO2的混合气体,维持浴槽温度在(37±0.25)℃。初始前负荷0.5 g,标本平衡30 min后,电刺激(波宽2 ms,频率4 Hz,120%阈电压)驱动左心房肌收缩。电刺激期间,以0.1 g为单位逐步升高前负荷,直至标本的收缩反应达到最适状态,1 h后开始实验[3]。
1.3 实验分组和处理
1.3.1 阿托品及普萘洛尔对DOX对映体诱发大鼠心房肌变力效应的影响 电刺激30 min,加入10-6mol·L-1的阿托品和 10-5mol·L-1的普萘洛尔,分别阻断M胆碱受体和β受体;10 min后分别加入3、10、30μmol·L-1的(-)DOX或(+)DOX,每个标本只给予一种药物;溶媒对照组给予等体积蒸馏水。标本暴露于各浓度DOX的时间为20 min。以第1次给予DOX时的前3 s内平均收缩反应作为药前值;每次给予DOX后,记录药后第20 min时3 s内平均收缩反应的变化,作为药物的效应。下述实验中,大鼠心房肌收缩反应的记录方法相同。
1.3.2 酚苄明对DOX对映体诱发大鼠心房肌变力效应的影响 电刺激 30 min,加入 10-5mol·L-1的酚苄明,阻断α受体;10 min后,以营养液反复冲洗标本7~8次,将酚苄明冲洗干净(冲洗约10 min);之后分别加入 3、10、30μmol·L-1的(-)DOX或(+)DOX,每个标本只给予一种药物;溶媒对照组给予等体积蒸馏水。
1.3.3 吲哚美辛对DOX对映体诱发大鼠心房肌变力效应的影响 电刺激30 min,加入10-6mol·L-1吲哚美辛(环氧合酶抑制剂),抑制前列腺素(prostaglandin,PG)合成;吲哚美辛作用于标本10 min后,分别加入3、10、30μmol·L-1的(-)DOX或(+)DOX,每个标本只给予一种药物,溶媒对照组给予等体积蒸馏水。
1.3.4 维拉帕米对DOX对映体诱发大鼠心房肌变力效应的影响 电刺激30 min,加入5×10-6mol·L-1维拉帕米,阻断Ca2+通道;维拉帕米作用于标本10 min后,分别加入 3、10、30μmol·L-1的(-)DOX或(+)DOX,每个标本只给予一种药物,溶媒对照组给予等体积蒸馏水。
1.3.5 亚甲蓝对DOX对映体诱发大鼠心房肌变力效应的影响 电刺激 30 min,加入 10-5mol·L-1亚甲蓝,抑制环鸟苷酸(cyclic guanosine monophosphate,cGMP)生成;亚甲蓝作用于标本10 min后,分别加入 3、10、30μmol·L-1的(-)DOX或(+)DOX,每个标本只给予一种药物,溶媒对照组给予等体积蒸馏水。
1.3.6 H-89对DOX对映体诱发大鼠心房肌变力效应的影响 电刺激30min后,加入10-6mol·L-1的H-89,抑制cAMP依赖性蛋白激酶(cyclic AMP-dependent protein kinase,PKA);H-89作用于标本10 min后,分别加入 3、10、30μmol·L-1的(-)DOX或(+)DOX,每个标本只给予一种药物,溶媒对照组给予等体积蒸馏水。
1.4 统计学处理实验数据以实测值和变化率用±s表示。同一药物不同浓度间的显著性检验采用单因素方差分析和Dunnett′s test。两条浓度-反应量效曲线之间的比较,采用双因素方差分析,当F值有显著性(P<0.05)时,进一步采用 Bonferroni′s test比较两对应点间的差异。统计学分析作图使用GraphPad Prism 5.0软件。
2 结果
2.1 DOX对映体对离体大鼠左心房心肌收缩力的影响溶媒对大鼠心肌收缩力无明显影响(P>0.05,Fig 1A),(-)DOX明显增强大鼠左心房心肌收缩力(P<0.01,Fig 1A),(+)DOX明显抑制大鼠左心房心肌收缩力(P<0.05,Fig 1A);3、10、30 μmol·L-1的(+)DOX和(-)DOX抑制和增强大鼠心肌收缩力的百分率见,Fig 1A。
2.2 阿托品及普萘洛尔对DOX对映体诱发大鼠心房肌变力效应的影响以阿托品及普萘洛尔预处理标本后,溶媒对大鼠心肌收缩力无明显影响(P>0.05,Fig 1B)。(-)DOX明显增强大鼠左心房心肌收缩力(P<0.01,Fig 1B),(+)DOX明显抑制大鼠左心房心肌收缩力(P<0.01,Fig 1B);3、10、30 μmol·L-1的(+)DOX和(-)DOX抑制和增强大鼠心肌收缩力的百分率见,Fig 1B。
2.3 酚苄明对DOX对映体诱发大鼠心房肌变力效应的影响以酚苄明预处理标本后,溶媒对大鼠心肌收缩力无影响(P>0.05,Fig 1C)。(-)DOX明显增强大鼠左心房心肌收缩力(P<0.01,Fig 1C),(+)DOX明显抑制大鼠左心房心肌收缩力(P<0.01,Fig 1C);3、10、30μmol·L-1的(+)DOX和(-)DOX抑制和增强大鼠心肌收缩力的百分率见Fig 1C。以乙醇预处理标本后,溶媒对大鼠心肌收缩力无明显影响(P>0.05,Fig 2-A)。(-)DOX明显增强大鼠左心房心肌收缩力(P<0.01,Fig 2A),(+)DOX明显抑制大鼠左心房心肌收缩力(P<0.01,Fig 2A),3、10、30μmol·L-1的(+)DOX和(-)DOX抑制和增强大鼠心肌收缩力的百分率,见Fig 2A。
2.4 吲哚美辛对DOX对映体诱发大鼠心房肌变力效应的影响以吲哚美辛预处理标本后,溶媒对大鼠心肌收缩力无影响(P>0.05,Fig 1D)。(-)DOX明显增强大鼠左心房心肌收缩力(P<0.01,Fig 1D),(+)DOX明显抑制大鼠左心房心肌收缩力(P<0.01,Fig 1D),3、10、30μmol·L-1的(+)DOX和(-)DOX抑制和增强大鼠心肌收缩力的百分率见Fig 1D。以乙醇预处理标本后,(-)DOX明显增强大鼠左心房心肌收缩力(P<0.01,Fig 2A),(+)DOX明显抑制大鼠左心房心肌收缩力(P<0.01,Fig 2A);3、10、30μmol·L-1的(+)DOX和(-)DOX抑制和增强大鼠心肌收缩力的百分率,见Fig 2A。
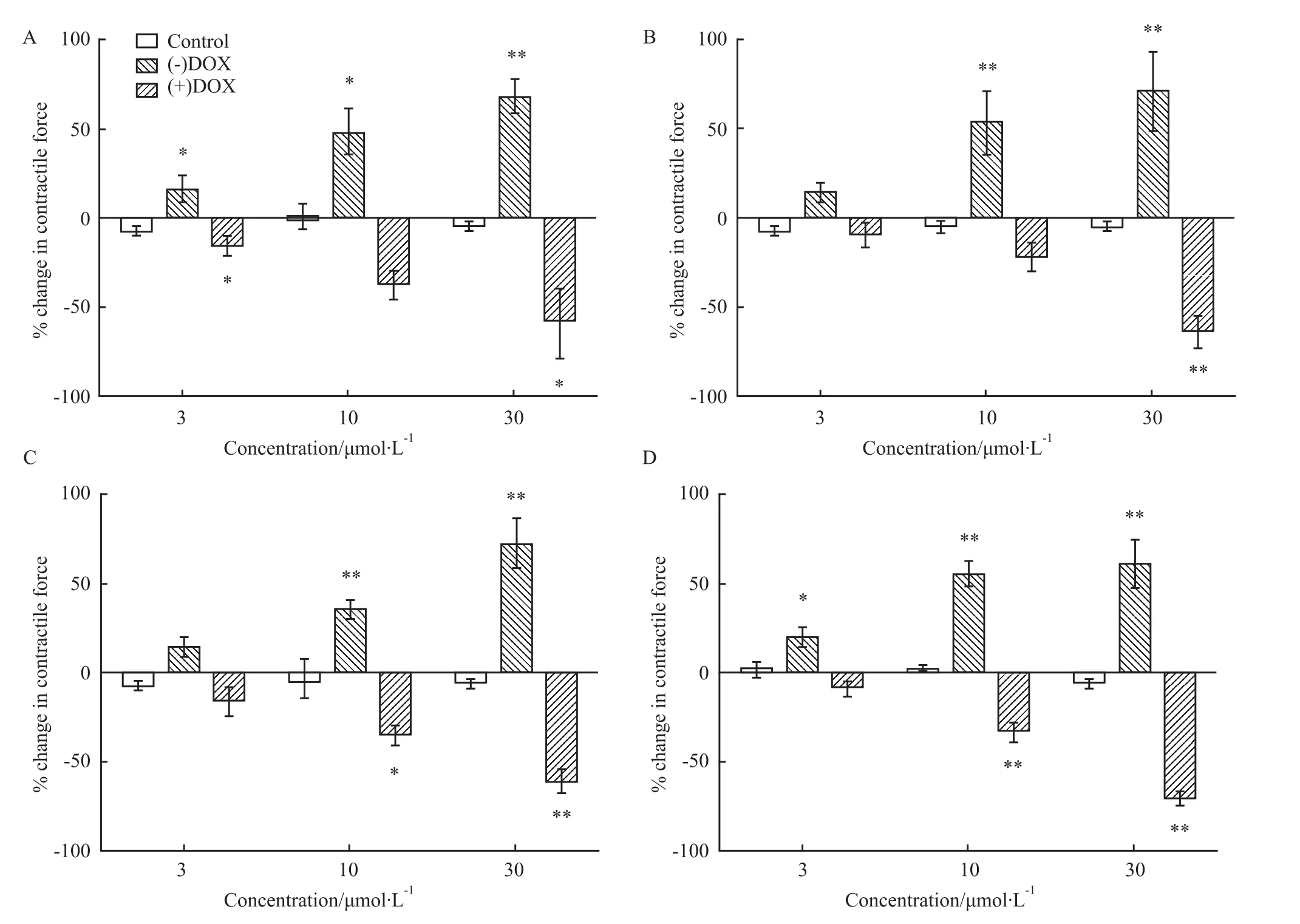
Fig 1 Effects of DOX enantiomers on contractile force in the isolated left atrium of rat(A;n=7);effects of DOX enantiomers on contractile force in the isolated left atrium of rat pretreated with atropine and propranolol(B;n=6);phenoxybenzamine(C;n=6);or indomethacin(D;n=6)
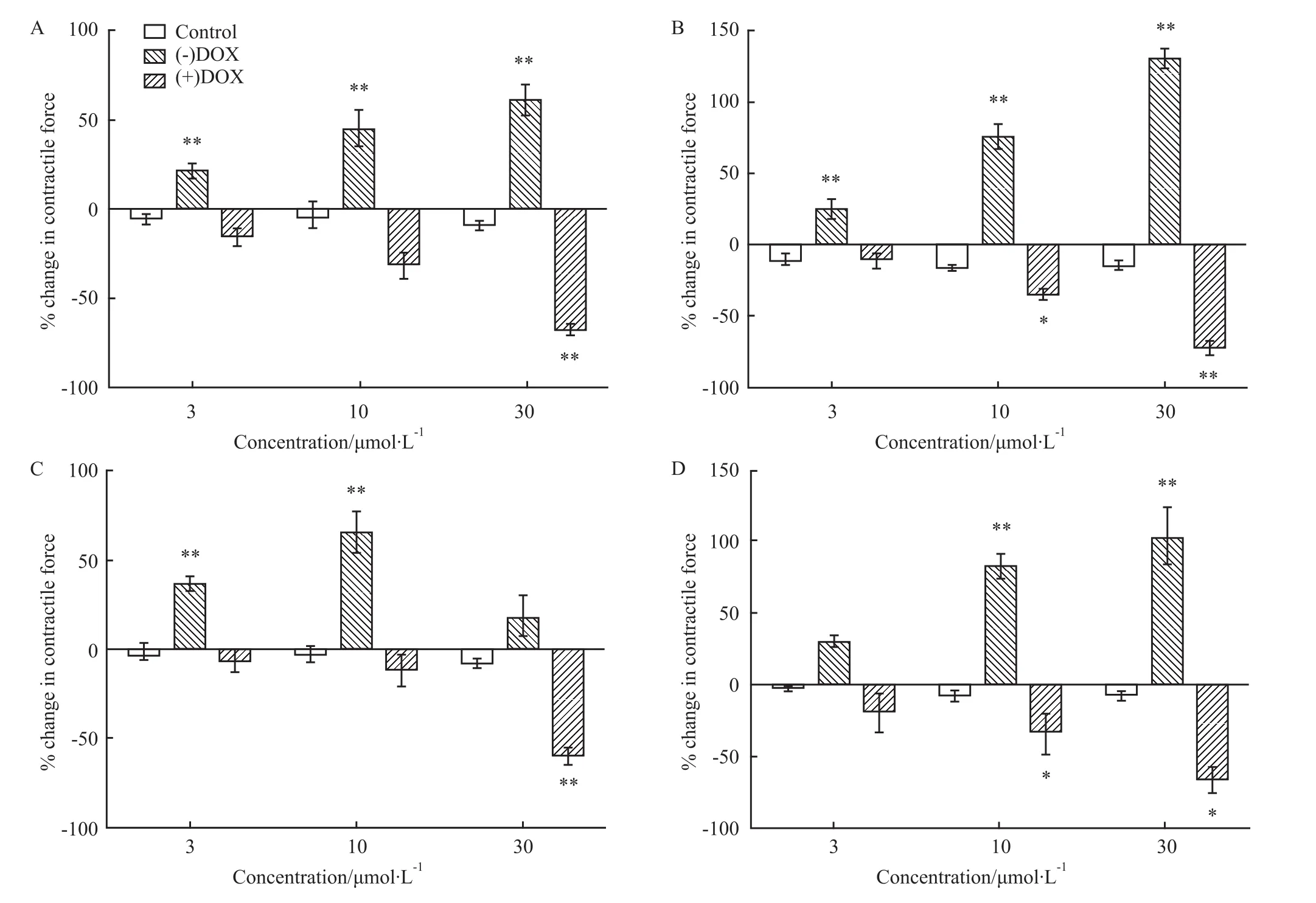
Fig 2 Effects of DOX enantiomers on contractile force in the isolated left atrium ofrat pretreated with ethanol(A;n=6);verapam il(B;n=8);methylene blue(C;n=6);or H-89(D;n=6)
2.5 维拉帕米对DOX对映体诱发大鼠心房肌变力效应的影响以维拉帕米预处理标本后,溶媒对大鼠心肌张力无影响(P>0.05,Fig 2B)。(-)DOX明显增强大鼠左心房心肌收缩力(P<0.01,Fig 2B),(+)DOX明显抑制大鼠左心房心肌收缩力(P<0.01,Fig 2B),3、10、30μmol·L-1的(+)DOX和(-)DOX抑制和增强大鼠心肌收缩力的百分率,见Fig 2B。
2.6 亚甲蓝对DOX对映体诱发大鼠心房肌变力效应的影响以亚甲蓝预处理标本后,溶媒对大鼠心肌收缩力无影响(P>0.05,Fig 2C)。(-)DOX明显增强大鼠左心房心肌收缩力(P<0.01,Fig 2C),3、10、30μmol·L-1的(+)DOX和(-)DOX抑制和增强大鼠心肌收缩力的百分率,见Fig 2C。
2.7 H-89对DOX对映体诱发大鼠心房肌变力效应的影响 以H-89预处理标本后,溶媒对大鼠心肌收缩力无影响(P>0.05,Fig 2D)。(-)DOX明显增强大鼠左心房心肌收缩力(P<0.01,Fig 2D),(+)DOX明显抑制大鼠左心房心肌收缩力(P<0.05,Fig 2D);3、10、30μmol·L-1的(+)DOX和(-)DOX抑制和增强大鼠心肌收缩力的百分率,见Fig 2D。
3 讨论
本研究中(-)DOX明显增强大鼠离体左心房肌条的收缩力。加入酚苄明阻断α受体之后,(-)DOX增强大鼠心房肌收缩力的百分率与对照组相比差异无统计学意义,说明(-)DOX增强大鼠心房肌收缩力的作用与α受体无关。此前也曾有文献报道DOX及哌唑嗪可诱导体外培养大鼠心肌细胞的凋亡,并且这种诱导作用与α受体阻断作用无关[4]。因此有理由认为DOX对心肌细胞的作用存在非α受体机制,并影响心肌细胞的收缩功能。同样,在加入M胆碱受体阻断剂阿托品、β受体阻断剂普萘洛尔以及环氧合酶抑制剂吲哚美辛之后,(-)DOX增强大鼠心房肌收缩力的百分率与各自的对照组相比差异无统计学意义;研究结果表明,心脏的M胆碱受体、β受体以及环氧合酶可能未参与(-)DOX的正性肌力作用。
维拉帕米作为一种Ca2+拮抗剂,主要通过阻断细胞外Ca2+与开放状态的L型Ca2+通道结合,从而抑制开放状态的 L型 Ca2+通道[7-8]。本研究发现Ca2+拮抗剂维拉帕米预处理标本使大鼠左心房标本的心肌收缩力减弱,提示细胞外Ca2+内流以及细胞内Ca2+释放参与了大鼠左心房标本的心肌收缩反应。尽管30μmol·L-1浓度(-)DOX对维拉帕米预处理大鼠心肌标本的收缩力增强百分率,明显强于其对正常且未经处理大鼠心肌标本的作用;统计学分析结果表明,维拉帕米仅对3μmol·L-1浓度(-)DOX的正性肌力作用具有明显的抑制作用(P<0.01)。因此,我们认为维拉帕米对(-)DOX的正性肌力作用呈现一定的拮抗效应;但是随着(-)DOX浓度升高,维拉帕米的拮抗效应逐渐减弱甚至消失,具体机制尚待进一步研究。
细胞内cGMP可激活cGMP依赖性蛋白激酶,调节L型Ca2+通道而减少Ca2+内流[9],降低肌丝对Ca2+的敏感性,最终产生负性肌力作用。另一方面,cAMP可使L型Ca2+通道磷酸化,导致Ca2+通道开放,肌浆网L型Ca2+通道开放可促使细胞内Ca2+释放而产生正性肌力作用[10-11]。cGMP亦可通过激活磷酸二脂酶,而降低cAMP水平。亚甲蓝是可溶性鸟苷酸环化酶的抑制剂,抑制细胞内cGMP生成。本实验中,亚甲蓝预处理标本后,3μmol·L-1浓度(-)DOX的正性肌力作用明显增强(P<0.05);但是,按照百分率计算时,最高浓度(-)DOX的正性肌力作用受到抑制(P<0.05)。该研究结果提示细胞内cGMP可能在某种程度上参与了(-)DOX在大鼠左心房的正性肌力作用。然而,亚甲蓝抑制高浓度(-)DOX对大鼠心房正性肌力作用的机制尚不清楚。
心肌细胞内PKA激活可使胞膜L型钙通道电流(ICaL)增强,导致肌浆网内钙释放,产生正性肌力作用。H-89是PKA的特异性抑制剂。本研究中,H-89对大鼠心肌的收缩力无明显影响;统计学分析结果表明,各浓度所对应的实测值差异均具有显著性(P<0.05~0.01)。我们认为 H-89对(-)DOX的正性肌力作用有明显的增强效应,但是H-89的作用是否与PKA有关尚不清楚。
研究中我们还发现(+)DOX明显抑制离体大鼠左心房肌条的收缩力。M受体阻断剂阿托品、β受体阻断剂普萘洛尔、α受体阻断剂酚苄明、环氧合成酶抑制剂吲哚美辛、Ca2+通道阻滞剂维拉帕米、可溶性鸟苷酸环化酶抑制剂亚甲蓝以及PKA抑制剂H-89,对(+)DOX的负性肌力作用无影响,提示α受体、M胆碱受体、β受体、Ca2+通道、环氧合酶、cGMP及PKA,可能未参与(+)DOX对大鼠左心房的负性肌力作用。
参考文献:
[1]Norman M,Kaplan M D,Donald G.Vidt.The ALLHAT officers and coordinators for the ALLHAT collaborative research group.Major cardiovascular events in hypertensive patients randomized to doxazosin vs chlorthalidone[J].JAMA,2000,283(15):1967-75.
[2]Movsesian M A.Beta-adrenergic receptor agonists and cyclic nucleotide phosphodiesterase inhibitors:shifting the focus from inotropy to cyclic adenosine monophosphate[J].J Am Coll Cardiol,1999,34(2):318-24.
[3]Zhao D,Duan L H,Wang F Y,et al.Chiral recognition of doxazosin enantiomers in 3 targets for therapy as well as adverse drug reactions in animal experiments[J].Can JPhysiol Pharmacol,2012,90(12):1623-33.
[4]Gonzalez-Juanatey JR,Iglesias M J,Alcaide C,et al.Doxazosin induces apoptosis in cardiomyocytes culturedin vitroby a mechanism that is independentof alpha1-adrenergic blockade[J].Circulation,2003,107(1):127-31.
[5]Lee A S,Chen W P,Su M J.Comparison of the cardiac electrophysiological effects between doxazosin and bunazosin[J].J Biomed Sci,2008,15(4):519-28.
[6]孙家安,王亚伟,任雷鸣.多沙唑嗪以及阿夫唑嗪对映体对小鼠离体心房心率和收缩力 的影响[J].中国药理学通报,2010,26(11):1476-80.
[6]Sun JA,Wang YW,Ren LM,Effectsof enantiomers of alfuzosin and doxazosin on heart rate and contractile force in the isolated mouse atrium[J].Chin Pharmacol Bull,2010,26(11):1476-80.
[7]Lee K S,Tsien RW.Mechanism of calcium channel blockade by verapamil,D600,diltiazem and nitrendipine in single dialysed heart cells[J].Nature,1983,302(5911):790-4.
[8]Mery P F,Pavoine C,Belhassen L,et al.Nitric oxide regulates cardiac Ca2+current.Involvement of cGMP-inhibited and cGMP-stimulated phosphodiesterases through guanylyl cyclase activation[J].JBiol Chem,1993,268(35):26286-95.
[9]Sculptoreanu A,Rotman E,TakahashiM,et al.Voltage-dependent potentiation of the activity of cardiac L-type calcium channel alpha 1 subunits due to phosphorylation by cAMP-dependent protein kinase[J].Proc Natl Acad Sci USA,1993,90(21):10135-9.
[10]Witcher D R,Kovacs R J,Schulman H,et al.Unique phosphorylation site on the cardiac ryanodine receptor regulates calcium channel activity[J].JBiol Chem,1991,266(17):11144-52.
[11]Tsai E J,Kass D A.Cyclic GMP signaling in cardiovascular pathophysiology and therapeutics[J].Pharmacol Ther,2009,122(3):216-38.
