5,6-二羟乙基黄芩苷对脑缺血大鼠脑组织能量代谢的影响
2014-05-15华会明曹雪松顾少莉迟天燕纪雪飞邹莉波
华会明,曹雪松,顾少莉,迟天燕,纪雪飞,邹莉波
(沈阳药科大学1.中药学院天然药物化学教研室、2.生命科学与生物制药学院药理学教研室,辽宁沈阳 110016)
研究发现黄芩苷对脑缺血损伤有较好的保护作用[1],但其水溶性较差,还未见注射剂上市。5,6-二羟乙基黄芩苷(5,6-dihydroxyethyl baicalin)由黄芩苷前体制备而成,具有较好的水溶性,有望开发成为注射制剂,以解决脑卒中患者吞咽困难的问题(Fig 1)。本文旨在研究大鼠全脑缺血/再灌注时,5,6-二羟乙基黄芩苷对脑组织能量代谢的影响。选用了夹闭双侧颈总动脉合并降压法制备全脑缺血模型,该模型具有慢性、持续性的特点,能够更好的模拟临床上休克、心功能不全、脑血管严重狭窄等引起的脑组织缺血损伤。
1 材料
1.1 主要试剂5,6-二羟乙基黄芩苷,沈阳药科大学天然药物化学教研室提供(含量:90%)。丙二醛(MDA)、一氧化氮(NO)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、总ATPase、Na+,K+-ATPase、Ca2+,Mg2+-ATPase试剂盒,南京建成生物工程研究所。
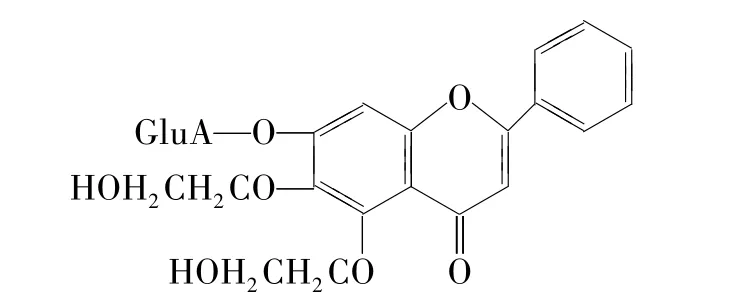
Fig 1 Chem ical structure of 5,6-dihydroxyethyl baicalin
1.2 动物健康♂Wistar大鼠,体质量180~220 g,由中国人民解放军军事医学科学院实验动物中心提供,合格证号:SCXK(军)2007-004。
2 方法
2.1 实验分组及模型制备将60只大鼠,随机分为6组,即假手术组、模型组、尼莫地平(0.36 mg·kg-1)组、5,6-二羟乙基黄芩苷低(45 mg·kg-1)、中(90 mg·kg-1)、高(180 mg·kg-1)剂量组,每组10只动物。采用夹闭双侧颈总动脉合并降压法制备大鼠脑缺血/再灌注损伤模型[2-3]。3.5%水合氯醛(350 mg·kg-1)腹腔注射麻醉后分离双侧颈总动脉,腹腔注射硝普钠(2.5 mg·kg-1),立即夹闭双侧颈总动脉,10 min后再灌注10 min,重复1次,缝合伤口,放入婴儿箱内,待其苏醒后正常饲养。假手术组仅分离双侧颈总动脉。治疗组分别于第2次再灌注后3 h首次iv给药,24 h后第2次给药,以后每天给药1次,共给药7次。
2.2 评价指标末次给药24 h后快速断头取脑,剥离双侧海马及大脑皮质,-80℃低温冰箱保存。进行生化指标检测时,以重量 ∶体积比1∶9加入4℃生理盐水,制成10%的脑组织匀浆,3 000 r·min-1低温离心 15 min,取上清液,按试剂盒说明,用722分光光度计测定大鼠海马及大脑皮质中总 ATP酶、Na+,K+-ATP酶、Ca2+,Mg2+-ATP酶、SOD、CAT活性以及MDA和NO含量。
2.3 统计学处理数据以±s表示,SPSS 17.0统计软件进行数据分析。组间比较采用F检验,两两比较用LSD法进行。
3 结果
3.1 5,6-二羟乙基黄芩苷对脑缺血/再灌注损伤大鼠海马、大脑皮层中总 ATP酶、Na+,K+-ATP酶、Ca2+,M g2+-ATP酶、SOD及CAT活性的影响 见Tab 1,2。
3.2 5,6-二羟乙基黄芩苷对脑缺血/再灌注损伤大鼠海马、大脑皮层中MDA、NO含量的影响 见Tab 3。
4 讨论
脑缺血损伤是一个多环节的病理级联反应过程,首先涉及的是能量代谢障碍。而大脑能量代谢的水平可以通过脑组织中各种ATP酶的活性来反映;MDA和NO的含量能够反映体内氧自由基的生成水平,间接反映细胞膜的损伤程度[4];SOD和CAT在组织中的活性则常被作为清除氧自由基能力的主要指标[5]。研究结果显示:5,6-二羟乙基黄芩苷能明显提高脑缺血/再灌注大鼠海马及大脑皮层组织中总ATP酶、Ca2+,Mg2+-ATP酶、Na+,K+-ATP酶、SOD、CAT的活性,同时减少MDA和NO的含量。提示5,6-二羟乙基黄芩苷有抗自由基过氧化和提高缺血脑组织中各种能量代谢酶活性的作用。
Tab 1 Effects of 5,6-dihydroxyethyl baicalin on activities of T-ATPase,Na+,K+-ATPase,Ca2+,M g2+-ATPase,SOD and CAT in hippocampus of rats with cerebral ischem ia-reperfusion(±s,n=8)
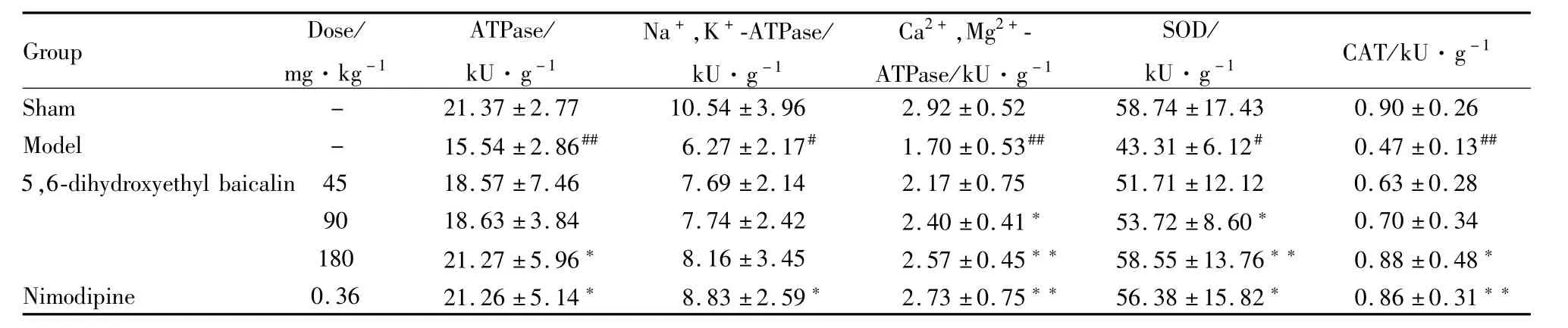
Tab 1 Effects of 5,6-dihydroxyethyl baicalin on activities of T-ATPase,Na+,K+-ATPase,Ca2+,M g2+-ATPase,SOD and CAT in hippocampus of rats with cerebral ischem ia-reperfusion(±s,n=8)
#P<0.05,##P<0.01 vs sham;*P<0.05,**P<0.01 vs model
Group Dose/mg·kg-1 ATPase/kU·g-1 Na+,K+-ATPase/kU·g-1 Ca2+,Mg2+-ATPase/kU·g-1 SOD/kU·g-1 CAT/kU·g-1±17.43 0.90±0.26 Model - 15.54±2.86## 6.27±2.17# 1.70±0.53## 43.31±6.12# 0.47±0.13##5,6-dihydroxyethyl baicalin 45 18.57±7.46 7.69±2.14 2.17±0.75 51.71±12.12 0.63±0.28 90 18.63±3.84 7.74±2.42 2.40±0.41* 53.72±8.60* 0.70±0.34 180 21.27±5.96* 8.16±3.45 2.57±0.45** 58.55±13.76** 0.88±0.48*Nimodipine 0.36 21.26±5.14* 8.83±2.59* 2.73±0.75** 56.38±15.82* 0.86±0.31 Sham - 21.37±2.77 10.54±3.96 2.92±0.52 58.74**
Tab 2 Effects of 5,6-dihydroxyethyl baicalin on activities of T-ATPase,Na+,K+-ATPase,Ca2+,M g2+-ATPase,SOD and CAT in cerebral cortex of ratswith cerebral ischem ia-reperfusion(±s,n=8)

Tab 2 Effects of 5,6-dihydroxyethyl baicalin on activities of T-ATPase,Na+,K+-ATPase,Ca2+,M g2+-ATPase,SOD and CAT in cerebral cortex of ratswith cerebral ischem ia-reperfusion(±s,n=8)
#P<0.05,##P<0.01 vs sham;*P<0.05,**P<0.01 vs model
Group Dose/mg·kg-1 ATPase/kU·g-1 Na+,K+-ATPase/kU·g-1 Ca2+,Mg2+-ATPase/kU·g-1 SOD/kU·g-1 CAT/kU·g-1 14.17 1.40±0.62 Model - 12.62±2.43## 4.56±1.37# 1.77±1.02## 37.60±5.07## 0.67±0.65#5,6-dihydroxyethyl baicalin 45 14.06±5.20 4.89±2.01 1.24±0.82 45.50±9.72 0.52±0.46 90 14.08±1.56 5.47±2.24 1.24±0.64 48.35±12.5* 0.79±0.45 180 17.02±3.56* 6.02±1.30* 3.12±1.45* 48.94±6.00** 1.33±0.51*Nimodipine 0.36 17.95±4.50* 6.16±1.55* 3.06±1.30* 54.74±8.49** 1.35±0.42 Sham - 18.95±4.77 6.81±2.49 3.62±1.35 57.05±*
Tab 3 Effects of 5,6-dihydroxyethyl baicalin on contents of MDA and NO in hippocam pus and cerebral cortex of rats with cerebral ischem ia-reperfusion(±s,n=8)
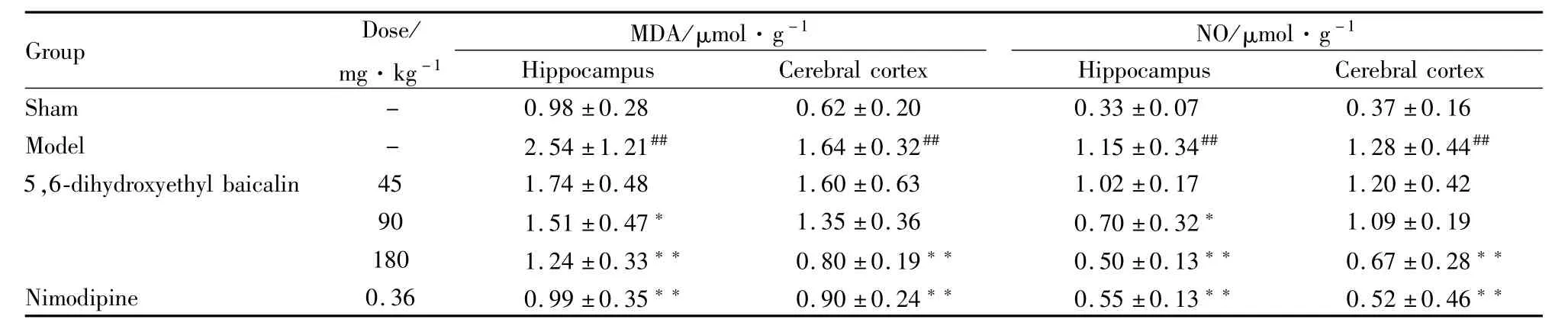
Tab 3 Effects of 5,6-dihydroxyethyl baicalin on contents of MDA and NO in hippocam pus and cerebral cortex of rats with cerebral ischem ia-reperfusion(±s,n=8)
#P<0.05,##P<0.01 vs sham;*P<0.05,**P<0.01 vs model
Group Dose/mg·kg-1 MDA/μmol·g-1 NO/μmol·g-1 16 Model - 2.54±1.21## 1.64±0.32## 1.15±0.34## 1.28±0.44##5,6-dihydroxyethyl baicalin 45 1.74±0.48 1.60±0.63 1.02±0.17 1.20±0.42 90 1.51±0.47* 1.35±0.36 0.70±0.32* 1.09±0.19 180 1.24±0.33** 0.80±0.19** 0.50±0.13** 0.67±0.28**Nimodipine 0.36 0.99±0.35** 0.90±0.24** 0.55±0.13** 0.52±0.46 Hippocampus Cerebral cortex Sham - 0.98±0.28 0.62±0.20 0.33±0.07 0.37±0.Hippocampus Cerebral cortex**
参考文献:
[1]陈 群,曾因明,王建国.黄芩苷的脑保护作用和对微管运动蛋白免疫活性的影响[J].中国药理学通报,2001,17(1):117-8.
[1]Chen Q,Zeng Y M,Wang JG.Protective role of breviscarpin on brain tissue and its effecton immunoreactivity ofmicrotubulemotorprotein[J].Chin Pharmacol Bull,2001,17(1):117-8.
[2]孔令锁,胡宪文,左友梅,等.瑞芬太尼预处理对短暂脑缺血后大鼠学习记忆能力的影响[J].中国药理学通报,2010,26(6):727-30.
[2]Kong L S,Hu X W,Zuo Y M,et al.Effects of remifentanil preconditioning on learning and memory in ratswith transient cerebral ischemia[J].Chin Pharmacol Bull,2010,26(6):727-30.
[3]张 晶,郭继东,谷淑玲,等.羟丁酸钠对沙土鼠脑缺血/再灌注损伤的作用研究[J].中国药理学通报,2002,18(1):50-3.
[3]Zhang J,Guo JD,Gu SL,etal.Experimental research of sodium gamma-hydroxybutyrate on cerebral ischemia-reperfusion injury in gerbils[J].Chin Pharmacol Bull,2002,18(1):50-3.
[4]王菊香,朱新波.姜黄素对缺血缺氧性脑损伤新生鼠脑组织SOD和MDA含量的影响[J].中国药理学通报,2013,29(9):1327-8.
[4]Wang JX,Zhu X B.Effects of curcumin on concents of SOD and MDA in brain of neonatal rats with hypoxic-ischemic encephalopathy[J].Chin Pharmacol Bull,2013,29(9):1327-8.
[5]罗胜勇,董六一,范 丽,等.山茶花总黄酮对大鼠脑缺血/再灌注损伤的保护[J].中国药理学通报,2006,22(11):1383-6.
[5]Luo SY,Dong L Y,Fan L,etal.Protective effectsof total of flacone C on cerebral ischemia-reperfusion injury in rats[J].Chin Pharmacol Bull,2006,22(11):1383-6.