M icro RNA-106b-25簇与肿瘤
2014-05-15孙桂波邢小燕孙晓波
董 曦,孙桂波,邢小燕,孙晓波
(中国医学科学院北京协和医学院药用植物研究所,北京 100193)
Micro RNA(miRNA)是一类内源性小RNA分子,其长度约为22nt,通过降解mRNA或抑制其翻译来调控基因表达[1]。miRNA于1993年被发现,并被证实参与了许多细胞通路的调节,是重要的转录后调节物。曾经的研究认为,绝大部分人类miRNA基因都不成簇存在于基因组内[1]。然而,Altuvia等[2]通过对 miRNA基因进行分析后发现,约37%的已知人类基因是成簇存在的。另一篇关于黑腹果蝇(D.melanogaster)的研究也指出[3],黑腹果蝇的 miRNA也是高度成簇存在于基因组内的。这种排列的方式使得功能上相关的miRNA可以多顺反子的形式被转录。miRNA的功能涉及众多的生物学进程,包括增殖、凋亡、发育以及分化等,其异常表达更是与许多疾病相关。在miRNA分子中,存在一段由6个碱基组成的序列,称为“种子序列”(seed sequences)。种子序列与miRNA与目标mRNA的识别有关,它可以与靶mRNA的3’UTR结合,继而引起转录抑制或mRNA的降解,也因此成为预测miRNA目标mRNA的理论基础[4]。
miR-106b-25簇 micro RNA包括 miR-106b、miR-93和miR-25,位于人第七染色体 MCM-7基因的第13内含子处[5]。虽然miR-106b-25簇以多顺反子的形式被转录,但由于其种子序列不同,miR-106b-25簇分属于两个不同家族:miR-17家族,种子序列为AAAGUG,包括miR-106b、miR-93;miR-25家族,种子序列为AUUGCA,包括miR-25。虽然关于miR-106b-25簇的研究还比较有限,但是miR-106b-25簇涉及肿瘤的凋亡、增殖等生物进程。本文将对最近miR-106b-25簇与肿瘤的研究做一综述。
1 m iR-106b-25与肿瘤凋亡
miR-106b-25簇miRNA在许多肿瘤中表达上调,包括胃癌、食道癌、结肠癌和慢性淋巴细胞白血病等[6-9]。而除了在肿瘤细胞中的异常表达,循环miR-106b及其他一些miRNA在胃癌患者血浆中的浓度也明显提高[10]。
miR-106b-25簇与肿瘤的关系,可首先被理解为抗凋亡。有研究表明[11],miR-25可以抑制Bcl-2家族中Bim的翻译来降低其表达,并最终产生抗凋亡作用。此外,caspase-7也被证实可被miR-106b直接调节[12]。miR-106b-25簇还能够促进肿瘤组织的血管生成。miR-93可以促进肿瘤细胞的增长并增加肿瘤组织内的血管密度,而血管生成作用的增加反过来又促进了肿瘤细胞的增长,这种作用可能是通过miR-93抑制 integrin-β8实现的[13]。
2 m iR-106b-25与肿瘤增殖
miR-106b-25簇还与肿瘤细胞的增殖有关,这一功能主要涉及RB(retinoblastoma)通路。在RB通路中,CDK4/6及cyclin D可以磷酸化RB,使转录因子E2F从RB/E2F复合物中游离出来,继而启动细胞的G1-S期转换。由于MCM-7的启动子部分存在E2F的结合位点,RB可以通过E2F来控制MCM-7及miR-106b-25簇的表达,并且p21及PTEN的mRNA都是miR-106b-25簇的下游靶标,因此,RB通路最终可通过miR-106b-25簇来调节细胞周期,促进细胞进入 S期[14]。尽管还没有研究界定miR-106b-25簇在G1-S期转换中的贡献,但是 miR-106b-25簇至少部分地参与了该转换[11]。而亦有研究指出,miR-106b可以直接调节RB来促进 G1-S期转换[15]。
在调节G1-S期转换的功能上,miR-106b与E2F转录因子的研究更为丰富。由于E2F在G1-S期转换中起到关键作用,因此许多研究者都将目光投向了这里。Trompeter等[16]的研究表明,miR-106b及其他一些miRNA可以提高E2F转录因子的活性来促进G1-S期转换,并促进细胞增殖。由于E2F可以控制 miR-106b-25簇的表达[14,17],因此 E2F与miR-106b-25簇之间可能存在负反馈机制。值得一提的是,抑癌基因 p53及 p21与miR-106b-25簇亦有关联。Brosh等[17]发现,p53可以通过E2F来抑制miR-106b的表达,这样可以阻止DNA损伤的细胞增殖。由于miR-106b或miR-93可以分解p21的mRNA来抑制其表达,p21又是p53的下游靶基因,是p53细胞增殖抑制作用的执行者,因此这可能是miR-106b-25簇致癌的机制之一。此外,miR-106b-25簇还可以调节由p21介导的细胞周期检查点,阻止细胞的G1期阻滞[18]。有意思的是,Bueno等[19]的研究表明,与前面提到的相反,miR-106b-25簇可与其他一些miRNA对细胞进入S期产生消极作用,从而使细胞免受复制应激(replicative stress)的影响。PTEN作为另一种抑制细胞增殖或肿瘤抑制蛋白,也受到miR-106b-25簇的抑制,这种抑制与miR-106b-25簇的成瘤性有关[14]。
3 m iR-106b-25与TGFβ信号通路
miR-106b-25簇可以通过TGFβ信号通路实现其功能。TGFβ信号通路与细胞增殖、分化、凋亡等的调节有关,TGFβ因子可以通过TGFβⅠ型受体(TβRⅠ)和TGFβⅡ型受体(TβRⅡ)以及各种Smad将信号传导至细胞核,继而调节基因表达。TGFβ因子可以介导TβRⅠ和TβRⅡ组装成复合物,该复合物可以激活细胞内的磷酸化级联反应。在此级联反应中,Smad2和Smad3被磷酸化并复合成为Smad4,然后转移至细胞核内,通过与转录因子的相互作用来调节基因的表达。另一方面,Smad6和Smad7可以抑制Smad2/3的信号传导[20-21]。TGFβ信号通路通常作为肿瘤抑制的途径,因此在肿瘤中被抑制。miR-106b簇可以下调作为TGF-β通路效应物的p21与Bim,继而干扰TGFβ依赖的细胞周期阻滞,扰乱胃癌细胞细胞周期检控点(cell cycle checkpoint),并对抗TGF-β依赖的凋亡[22]。在神经细胞中,miR-106b可直接负向调节TβRⅡ表达,其机制是通过与TβRⅡmRNA结合来抑制翻译。此外,还发现在miR-106b稳定转染的神经细胞中,磷酸化 Smad2/3水平下降,而 Smad6/7水平增加[21]。这表明,除了负向调节TβRⅡ表达外,miR-106b簇可能通过与Smad的相互作用来抑制TGFβ通路。在TGFβ缺失的胃癌细胞中,miR-106b-25簇并不能明显改变其增殖和存活,因此有人认为miR-106b-25簇主要通过TGFβ通路发挥作用[20]。
然而,TGFβ信号通路的作用是多样的。在肿瘤进程中,肿瘤细胞会从其抑瘤的作用中逃逸,并将TGFβ的信号“转换”成为一种促进信号,即通过该信号来增强肿瘤细胞的上皮间质转化(EMT)、运动、存活、入侵、血管形成和免疫抑制[23]。Six1可通过上调miR-106b-25簇来转换TGFβ信号,即活化作为促进肿瘤进程TGFβ信号,而这一作用是通过抑制Smad7来实现的[24]。这一结果提示,miR-106b-25簇参与了TGFβ信号通路的抑瘤和促瘤功能。有意思的是,该研究并未发现miR-106b-25簇对TβRⅡ的抑制作用,这与刚才提到的神经细胞[21]中的情况不同,这可能与TGFβ信号转换有关。
除了TGFβ信号通路之外,miR-106b-25簇也是insulin/IGF通路的一部分。尽管相关研究还较少,但是miR-106族的表达可以下调PTEN,而PTEN是insulin/IGF通路中重要的抑制物,并且具有抑制肿瘤和细胞周期进行的功能。除此之外,insulin/IGF通路中许多mRNA都是miR-25的潜在靶mRNA,并且FoxO转录因子—insulin/IGF通路下游的效应物,可以与 miR-106b-25簇的调节区(regulatory region)结合[25-26]。
4 结语
尽管micro RNA发现的时间并不长,但是由于其参与了细胞调控的诸多方面,尤其在肿瘤的发生发展中有着重要作用,各国研究者都将目光投向了该领域。miR-106b-25簇与肿瘤存在着诸多联系,其在肿瘤发展过程中的作用及相关靶点的关系见Tab 1。对miR-106b-25簇的研究,能够更加清晰地描绘肿瘤的发生发展进程,从而对肿瘤的治疗产生积极的影响,如促进肿瘤凋亡,抑制肿瘤增殖等。此外,由于循环miR-106b胃癌患者血浆中的浓度明显提高[10],也可将其作为预测肿瘤预后或发展的生物标记。亦有研究[27]表明miR-106b-25簇与肿瘤干细胞的耐药性有关,该方向也可作为下一步的研究课题。伴随生物信息学的不断发展完善,我们或许能够看清不同micro RNA的复杂联系,以及micro RNA-蛋白质间的网络关系,从而启发我们关于肿瘤治疗的新思路。
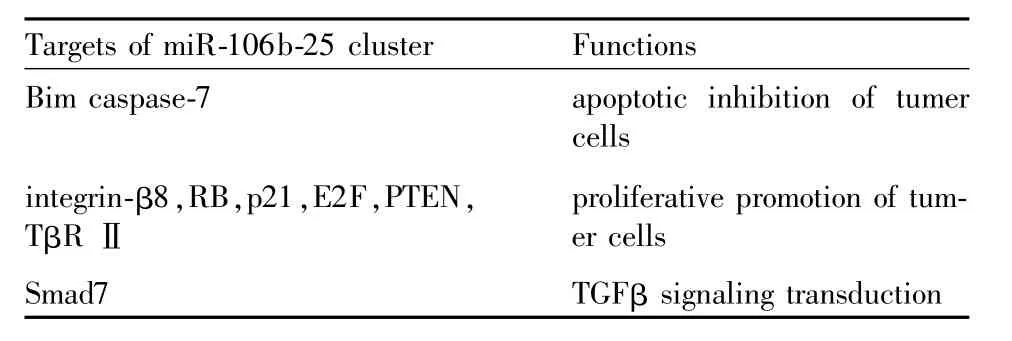
Tab 1 Targets and functions ofm ir-106b-25 cluster
参考文献:
[1] Bartel D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-97.
[2] Altuvia Y,Landgraf P,Lithwick G,et al.Clustering and conservation patterns of human microRNAs[J].Nucleic Acids Res,2005,33(8):2697-706.
[3] Marco A,Ninova M,Ronshaugen M,et al.Clusters ofmicroRNAs emerge by new hairpins in existing transcripts[J].Nucleic Acids Res,2013,41(16):7745-52.
[4] Bartel D P.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-33.
[5] Mendell JT.miRiad roles for the miR-17-92 cluster in development and disease[J].Cell,2008,133(2):217-22.
[6] Zhu L,YanW,Rodriguez-Canales J,etal.MicroRNA analysisof microdissected normal squamous esophageal epithelium and tumor cells[J].Am JCancer Res,2011,1(5):574-84.
[7] Zhu D X,Zhu W,Fang C,et al.miR-181a/b significantly enhances drug sensitivity in chronic lymphocytic leukemia cells via targetingmultiple anti-apoptosis genes[J].Carcinogenesis,2012,33(7):1294-301.
[8] Yao Y,Suo A L,Li Z F,et al.MicroRNA profiling of human gastric cancer[J].Mol Med Report,2009,2(6):963-70.
[9] Wang Y X,Zhang X Y,Zhang B F,et al.Initial study ofmicroRNA expression profiles of colonic cancer without lymph node metastasis[J].JDig Dis,2010,11(1):50-4.
[10]Tsujiura M,Ichikawa D,Komatsu S,et al.Circulating microRNAs in plasma of patients with gastric cancers[J].Br J Cancer,2010,102(7):1174-9.
[11]Ivanovska I,Ball A S,Diaz R L,et al.MicroRNAs in themiR-106b family regulate p21/CDKN1A and promote cell cycle progression[J].Mol Cell Biol,2008,28(7):2167-74.
[12]Hudson R S,YiM,Esposito D,etal.MicroRNA-106b-25 cluster expression is associated with early disease recurrence and targets caspase-7 and focal adhesion in human prostate cancer[J].Oncogene,2013,32(35):4139-47.
[13]Fang L,Deng Z,Shatseva T,et al.MicroRNA miR-93 promotes tumor growth and angiogenesisby targeting integrin-beta8[J].Oncogene,2011,30(7):806-21.
[14]Thangavel C,Boopathi E,Ertel A,et al.Regulation ofmiR106b cluster through the RB pathway:mechanism and functional targets[J].Cell Cycle,2012,12(1):98-111.
[15]Cai K,Wang Y,Bao X.MiR-106b promotes cell proliferation via targeting RB in laryngeal carcinoma[J].JExp Clin Cancer,2011,30:73-8.
[16]Trompeter H I,Abbad H,Iwaniuk K M,et al.MicroRNAs MiR-17,MiR-20a,and MiR-106b act in concert tomodulate E2F activity on cell cycle arrest during neuronal lineage differentiation of USSC[J].PloSOne,2011,6(1):e16138.
[17]Brosh R,Shalgi R,Liran A,et al.p53-Repressed miRNAs are involved with E2F in a feed-forward loop promoting proliferation[J].Mol Syst Biol,2008,4(1):229-43.
[18]Zhao ZN,Bai JX,Zhou Q,etal.TSA suppressesmiR-106b-93-25 cluster expression through downregulation of MYC and inhibits proliferation and induces apoptosis in human EMC[J].PloSOne,2012,7(9):e45133.
[19]Bueno M J,Gomez de Cedron M,Laresgoiti U,et al.Multiple E2F-induced microRNAs prevent replicative stress in response to mitogenic signaling[J].Mol Cell Biol,2010,30(12):2983-95.
[20]Petrocca F,Vecchione A,Croce C M.Emerging role of miR-106b-25/miR-17-92 clusters in the control of transforming growth factor beta signaling[J].Cancer Res,2008,68(20):8191-4.
[21]Wang H,Liu J,Zong Y,etal.miR-106b aberrantly expressed in a double transgenic mouse model for Alzheimer′s disease targets TGF-beta typeⅡ receptor[J].Brain Res,2010,1357:166-74.
[22]Petrocca F,Visone R,Onelli M R,et al.E2F1-regulated microRNAs impair TGFbeta-dependent cell-cycle arrestand apoptosis in gastric cancer[J].Cancer Cell,2008,13(3):272-86.
[23]Inman G J.Switching TGFbeta from a tumor suppressor to a tumor promoter[J].Curr Opin Genet Dev,2011,21(1):93-9.
[24]Smith A L,Iwanaga R,Drasin D J,etal.ThemiR-106b-25 cluster targets Smad7,activates TGF-beta signaling,and induces EMT and tumor initiating cell characteristics downstream of Six1 in human breast cancer[J].Oncogene,2012,31(30):5162-71.
[25]Brett JO,Renault V M,Rafalski V A,et al.The microRNA cluster miR-106b-25 regulates adult neural stem/progenitor cell proliferation and neuronal differentiation[J].Aging,2011,3(2):108-24.
[26]Groszer M,Erickson R,Scripture-Adams D D,etal.PTEN negatively regulates neural stem cell self-renewal bymodulating G0-G1cell cycle entry[J].Proc Nat Acad SciUSA,2006,103(1):111-6.
[27]胡蕴慧,盛梦瑶,张孝云,等.miR-106b-25基因簇增强乳腺癌MCF-7肿瘤干细胞相关耐药性[J].中国药理学通报,2013,29(8):1070-5.
[27]Hu Y H,Sheng M Y,Zhang X Y,et al.Overexpression ofmiR-106b-25 cluster induces chemoresistance through regulating cancer stem cell-like phenotype in MCF-7 cell line[J].Chin Pharmacol Bull,2013,29(8):1070-5.
