双水相提取鱼肉中的有机氯农药残留
2014-05-14李慧芳
李慧芳
(烟台大学文经学院,山东烟台 264005)
有机氯农药(OCPs)是一类由碳氢氯构成的有机化合物(有的种类含硫元素),具有显著的杀虫效果,并对恶性传染病的控制、农林病害的防治等起着非常重要的作用。但由于OCPs为持久性污染物,难于降解,能通过食物链富集于生物体内,故可威胁到食品安全。鱼肉作为人类膳食中蛋白质的重要来源,控制其中的OCPs残留水平对人体健康至关重要。目前,鱼肉中OCPs残留分析的样品前处理方法主要包括固相萃取[1]、固相微萃取[2]、基质固相分散技术[3]、凝胶渗透色谱法[4]、微波消解法[5]等。但是通过实践发现,上述方法存在操作繁琐、耗时、成本高、劳动强度大、试剂用量大、环境污染严重等问题,而且提取净化能力不强。
双水相萃取技术是近年来出现的引人注目、极有前途的新型分离技术,利用物质在互不相溶的两水相间分配系数的差异来进行萃取。该技术已被广泛用于生物化学、细胞生物学和生物化工等领域,可对细胞、膜、病毒、蛋白质、核酸以及其他天然药物有效成分进行分离和提纯[6-15]。然而,传统以高聚物-高聚物或高聚物-盐所形成的双水相体系,由于粘度太大,会干扰萃取结果,而且成本过高,经济上不具优势。所以,需要开发新型的双水相体系,这也成为双水相萃取研究的热点。
研究表明,无机盐、水与乙腈[16-19]、异丙醇[10-20]、丙酮和乙醇[20]等水溶性有机溶剂以适当比例混合时,也能分成两相。这种新型的双水相体系具有操作简单、对分析物无干扰,试剂低毒、低粘度,传质和分相速度快等优点,并已成功的应用于多种金属离子的萃取分析[21-25]。因此,利用OCPs在这种新型双水相体系中具有较大的分配系数,来实现鱼肉中有机氯农药残留的高效提取具有重要意义,而目前还未见有这方面的报道。本研究旨在利用乙腈-无机盐-水双水相体系来提取净化鱼肉中的OCPs残留,建立鱼肉中OCPs残留分析的样品前处理新方法。
1 实验部分
1.1 试剂与仪器
α-BHC、β-BHC、δ-BHC、o,p-DDE、p,p-DDE、o,p-DDD、p,p-DDD、o,p-DDT、p,p-DDT 等 9 种 OCPs均购自 Dr.Ehrenstorfer GmbH,纯度在 97.0% ~99.0%;cleanert C18和 PSA(20 ~40 μm);所有溶剂均为色谱级。
岛津GC2010气相色谱仪(配有ECD检测器);OL-861漩涡振荡器;Hitachi 20PR-520制冷高速离心机;UPWS-超纯水系统。
1.2 色谱分析条件
色谱柱为DB-1毛细管柱;载气为氮气,流速1.0 mL/min;进样口温度 200℃;检测器温度320℃;进样量1 μL,进样方式为分流进样,分流比15∶1;初始温度 150 ℃,保持 2 min,6 ℃/min→270℃,保持8 min。
1.3 试液的配制
9种有机氯标准物质分别称取1 mg于10 mL容量瓶中,正己烷定容,作为混标储备液,于-20℃保存备用。然后配制浓度为 100,50,20,10 μg/kg标准工作液。
1.4 双水相体系的制备
10 mL比色管中加入适量无机盐、5 mL水和适量乙腈,然后加入9种OCPs混标,漩涡1~2 min,室温下静置,待溶液分层后,气相色谱进样检测。然后计算体系的相比、富集因子以及OCPs的萃取率。
1.5 鱼肉样品前处理
称取已匀浆的鲤鱼脊背肉2.5 g,依次加入5 mL水和4 mL乙腈,漩涡1 min后加入2.0 g醋酸钾,漩涡1 min,然后3 500 r/min离心10 min。将上相清液转移至另一离心管中,分别加入1 g无水硫酸镁和 0.1 g PSA固体颗粒,漩涡 1 min后3 500 r/min离心10 min,取上清液,气相色谱进样检测。
1.6 国标方法测定鱼肉中OCPs农药残留
参考国标方法[4],对鱼肉中9种OCPs残留进行了检测。
2 结果与讨论
2.1 双水相体系的制备
2.1.1 无机盐的选择 双水相是由亲水性有机溶剂、无机盐、水组成的两相体系,我们选取了钾盐、钠盐、铵盐作为研究对象,根据文献报道[16-19],这几类常见的无机盐与水、乙腈形成双水相时,分相能力大小顺序为:KC2H3O2> K2CO3>KF>KBr;(NH4)2SO4>Na2CO3>Na3C6H5O7>Na2S2O3>Na2SO4,据 此 首 先 筛 选 了 KC2H3O2、K2HPO4、K2CO3、Na2CO3、NaC2H3O2和(NH4)2SO4这 6 种无机盐。但是通过实际操作发现,六六六在K2CO3和Na2CO3与水、乙腈形成的双水相中会发生降解,故这两种体系不适于分析OCPs残留。实验最终选择KC2H3O2、K2HPO4、NaC2H3O2和(NH4)2SO4这 4 种盐分别与乙腈、水形成双水相。
2.1.2 无机盐含量对相平衡产生的影响 我们分别研究了4种双水相体系中无机盐含量对富集因子(F=V水/V上相)和相比(R=V上相/V下相)的影响。
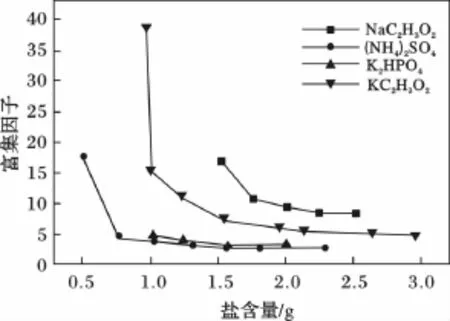
图1 盐含量对富集因子的影响Fig.1 Effect of the amount of salt on enrichment factor
由图1可知,固定体系中加入5.0 mL水和2 mL乙 腈,当 NaC2H3O2、(NH4)2SO4、K2HPO4和KC2H3O2四种盐含量分别为 2.0 ~2.5 g,1.0 ~2.3 g,1.3 ~2.0 g和2.0 ~3.0 g时,富集因子 F 分别稳定在9,3,3和5左右。

图2 盐含量对相比的影响Fig.2 Effect of the amount of salt on the phase-volume ratio
由图2可知,当体系中水和乙腈体积保持不变时,相比会随着盐用量先快速增大,后缓慢减小。所以结合图1和图2,必须同时考虑富集因子和相比对双水相体系萃取OCPs的影响。
2.1.3 无机盐含量对OCPs萃取率的影响 由于高的富集因子和低的相比有利于药物的富集,所以我们比较了不同盐含量的双水相体系对OCPs萃取率的大小。固定体系中加入5.0 mL水、2 mL乙腈和 0.05 μg OCPs,当 NaC2H3O2、(NH4)2SO4、K2HPO4和 KC2H3O2的含量分别为 1.5 ~2.5 g,0.5~2.3 g,1.0 ~2.0 g和 1.0 ~3.0 g时,各体系对 9种OCPs的萃取率大小见图3中a~d所示。结果发现,K2HPO4-CH3CN-H2O体系对α-BHC和o,p-DDT萃取率均偏低;而NaC2H3O2-CH3CN-H2O体系在分相后,上相体积太小,不便于实际样品的检测;其余两种盐(NH4)2SO4和KC2H3O2,使用一定的量与乙腈、水组成双水相体系,对9种OCPs的萃取不但高效而且稳定。

图3 不同盐含量的双水相体系对9种OCPs的萃取率Fig.3 Extraction efficiency of 9 OCPs in acetonitrile-salt-H2O with different amount of salt
2.1.4 乙腈含量对富集因子和OCPs萃取率的影响 根据2.1.2节和2.1.3节讨论,固定各双水相体系中水含量为5 mL,醋酸钾和硫酸铵的含量分别为1.6 g和1.5 g,比较乙腈含量对体系富集因子及OCPs萃取率的影响,结果见表1和表2。
由表1、表2可知,随着乙腈含量的增加,两种体系的富集因子均明显下降,而OCPs萃取率却是缓慢升高后趋于平衡。由于高的萃取率和合适的富集因子是痕量分析的关键,结合此两种因素,并且考虑到实际操作可行性,发现醋酸钾-乙腈-水体系不但萃取率高,而且富集效果明显优于硫酸铵-乙腈-水体系,所以最终选择乙腈、醋酸钾、水配比为2.0~3.0 mL ∶1.6~2.1 g ∶5 mL 的双水相体系来萃取OCPs。
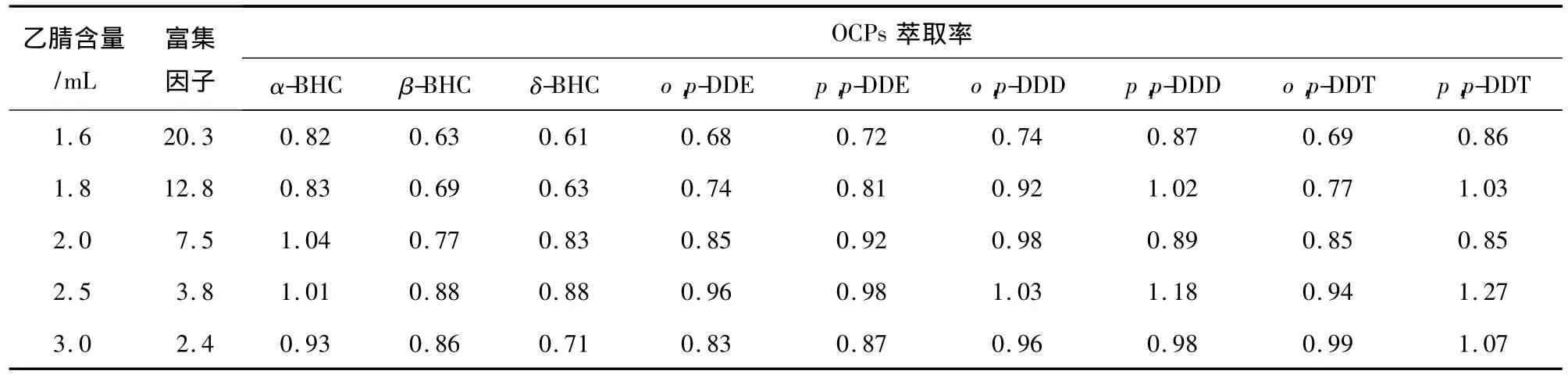
表1 乙腈-醋酸钾-水体系中乙腈含量对OCPs萃取率的影响Table 1 Effect of the volume of acetonitrile on extraction efficiencies of 9 OCPs in CH3CN-KC2H3O2-H2O

表2 乙腈-硫酸铵-水体系中乙腈体积对OCPs萃取率的影响Table 2 Effect of the volume of acetonitrile on extraction efficiencies of 9 OCPs in CH3CN-(NH4)2SO4-H2O
2.1.5 温度对OCPs萃取率的影响 实验研究了不同温度下,乙腈-醋酸钾-水体系对OCPs萃取率的大小,结果见图4(以 α-BHC、o,p-DDD、o,p-DDE、o,p-DDT和p,p-DDT这5种OCPs为例)。
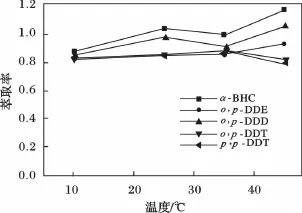
图4 温度对OCPs萃取率的影响Fig.4 Effect of temperature on the extraction efficiencies of OCPs
由图4可知,当温度低于20℃时,不同极性的OCPs萃取率均有不同程度的下降;当温度介于20~40℃时,萃取率稳定在80%以上;当温度大于40℃时,极性小的OCPs萃取率有所增大,极性大的却呈下降趋势。综合各种因素,实验最佳操作温度应为20~30℃。
综上所述,配比 2.0 ~3.0 mL ∶1.6 ~2.1 g ∶5 mL的乙腈-醋酸钾-水双水相体系在室温下萃取9种OCPs的效果相对最好,可用于鱼肉中OCPs残留分析的样品前处理中。
2.2 净化剂的选择
由于鱼肉基质杂质较多,若要分析其中的OCPs残留,在双水相萃取净化的基础上,还需要加入有效的净化剂。根据文献报道[26],实验筛选了2种净化效果较好的PSA和C18作吸附剂、硫酸镁作干燥剂,研究2种净化剂对OCPs的吸附作用,结果见表3(以 α-BHC、o,p-DDD、o,p-DDE、o,p-DDT 和 p,p-DDT这5种OCPs为例)。
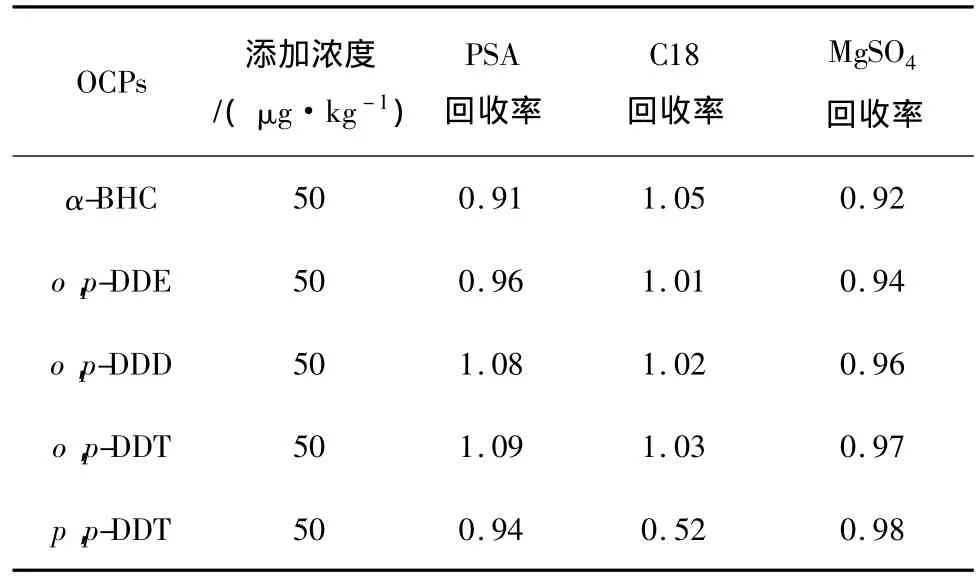
表3 吸附剂对OCPs回收率的影响Table 3 Effect of sorbents on recoveries of OCPs
由表3可知,PSA和硫酸镁对有机氯农药的吸附作用很小,基本可忽略不计,而C18对极性大的p,p-DDT有较强的吸附,会对萃取结果造成很大影响。故针对鱼肉中的OCPs残留,以乙腈-水-醋酸钾体系作提取剂时,应使用PSA和硫酸镁作为净化剂。
2.3 标准曲线和检测限
将所配制的系列浓度混合标准溶液,经GC测定。各药物检测限为3倍基线噪音对应的浓度。9种OCPs的保留时间、回归方程(y为峰面积,x为质量浓度,μg/kg)、相关系数以及检测限见表4。

表4 9种OCPs的保留时间、回归方程、相关系数和检测限Table 4 Retention time,regression equations,correlation coefficients and detection limits for the determination of OCPs
2.4 样品测定
考虑到鱼肉中的水分含量,实验选择了适当配比的乙腈-醋酸钾-水双水相体系结合分散固相萃取法,来提取鱼肉中不同添加水平的OCPs残留,并与国标法作了比较(见表5)。9种OCPs加标样品色谱图,见图5。
结果证明,双水相体系结合分散固相萃取净化的前处理方法效果很好,不仅可以将提取、基质去除与净化一次完成,而且9种药物提取回收率可达78% ~106%,相对标准偏差均小于11%,和国标法相比有了很大提高。

表5 鱼肉中9种OCPs添加回收率及精密度Table 5 The recoveries of 9 OCPs in fish by different pretreatment methods(n=4)
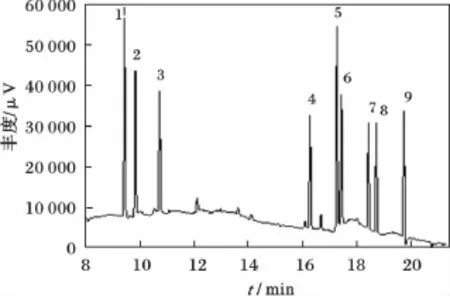
图5 浓度为50 μg/kg的鱼肉加标样品色谱图Fig.5 GC chromatogram of fish samples at a fortified level at 50 μg/kg
3 结论
室温下一定配比的乙腈-醋酸钾-水体系对OCPs萃取率不但高效而且稳定,由此建立了一种全新的样品前处理技术,即以乙腈-醋酸钾-水双水相体系为提取剂,以PSA颗粒为吸附剂,无水硫酸镁为干燥剂,经离心分离去基质后,气相色谱直接进样分析的方法来提取测定鱼肉样品中的9种OCPs残留。该方法操作简单、耗时少,不仅有很好的净化效果,而且提取回收率较高,明显优于国标法,完全能够满足鱼肉中OCPs残留的即时高效检测。
[1]吕惠卿,寿林飞,黄亮,等.加速溶剂萃取/固相萃取净化/气相色谱质谱联用法测定浙贝母中13种有机氯及拟除虫菊酯类农药残留[J].药物分析杂志,2010,30(3):491-494.
[2]Natalia F U,Giusepp C,Elisa B G,et al.Solid-phase microextraction as a clean-up and preconcentration procedures for organochlorine pesticides determination in fish tissue by gas chromatography with electron capture detection[J].J Chromatogr A,2003,1017:35-44.
[3]宋兴良,王江涛.加速溶剂萃取-逆基质分散固相萃取-气相色谱质谱法测定海洋生物中六六六残留量[J].理化检验-化学分册,2010,46(9):985-988.
[4]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 5009.19—2008食品中有机氯农药多组分残留量的测定[S].北京:中国标准出版社,2008.
[5]李攻科,何小青,熊国华,等.用微波消解气相色谱法测定鱼肉中的有机氯农药[J].分析测试学报,1999,18(4):5-8.
[6]Philipson L,Albertsson P ,Frick G.The purification and concentration of viruses by aqueous polymer phase systems[J].Virology,1960,11(3):553-571.
[7]Huddleston J,Veide A,Khler K,et al.The molecular basis of partitioning in aqueous two-phase systems[J].Trends Biotechnol,1991,9(1):381-388.
[8]Raghavarao K S M S,Rastogi N K,Gowthaman M K,et al.Aqueous two-phase extraction for downstream processing of enzymes/proteins[J].Enfors S O Lyddiatt A Adv Appl Microbiol,1995,41:97-171.
[9]Trindade I P,Diogo M M,Prazeres D M F,et al.Purification of plasmid DNA vectors by aqueous two-phase extraction and hydrophobic interaction chromatography[J].J Phys Chem A,2005,1082(2):176-184.
[10]Liu H L,He C Y,Wen D W,et al.Extraction of testosterone and epitestosterone in human urine using 2-propanolsalt-H2O system[J].Anal Chim Acta,2006,557(1/2):329-336.
[11]Rosa P A J,Azevedo A M,Ferreira I F,et al.Affinity partitioning of human antibodies in aqueous two-phase systems[J].J Phys Chem A,2007,1162(1):103-113.
[12]Chethana S,Nayak C A,Raghavarao K S M S.Aqueous two phase extraction for purification and concentration of betalains[J].J Food Eng,2007,81(4):679-687.
[13]Li S H,He C Y,Gao F,et al.Extraction and determination of morphine in compound liquorice using an aqueous twophase system of poly(ethylene glycol)/K2HPO4coupled with HPLC[J].Talanta,2007,71(2):784-789.
[14]Patil G,Chethana S,Madhusudhan M C,et al.Fractionation and purification of the phycobiliproteins from Spirulina platensis[J].Bioresour Technol,2008,99(15):7393-7396.
[15]Ferreira L A,Teixeira J A,Mikheeva L M,et al.Effect of salt additives on partition of nonionic solutes in aqueous PEG-sodium sulfate two-phase system[J].J Phys Chem A,2011,1218(31):5031-5039.
[16]Renard J A,Oberg A G.Ternary systems:Water-acetonitrile-salts[J].J Chem Eng Data,1965,10(2):152-155.
[17]Renard J A.Ternary systems:Water-acetonitrile-salts[J].J Chem Eng Data,1966,11(2):169-171.
[18]Renard J A.Ternary system:Water-acetonitrile-salts[J].J Chem Eng Data,1967,12(1):33-36.
[19]Renard J A,Heichelheim H R.Ternary system:Wateracetonitrile-salts[J].J Chem Eng Data,1968,13(4):485-488.
[20]王志华,马会民,马泉莉,等.双水相萃取体系的研究[J].应用化学,2001,18(3):173-175.
[21]Chung N H,Tabata M.Selective extraction of gold(III)in the presence of Pd(II)and Pt(IV)by salting-out of the mixture of 2-propanol and water[J].Talanta,2002,58(5):927-933.
[22]Chung N H,Nishimoto J,Kato O,et al.Selective extraction of thallium(III)in the presence of gallium(III),indium(III),bismuth(III)and antimony(III)by saltingout of an aqueous mixture of 2-propanol[J].Chim Acta,2003,477(2):243-249.
[23]Nagaosa Y.Extraction-polarographic determination of cobalt(II)and nickel(II)as 2,2'-bipyridine complexes in acetonitrile[J].Anal Chim Acta,1980,115:81-88.
[24]Yoshida M,Akane A,Nishikawa M,et al.Extraction of thiamylal in serum using hydrophilic acetonitrile with subzero-temperature and salting-out methods[J].Anal Chem,2004,76(16):4672-4675.
[25]Tabata M,Kumamoto M,Nishimoto J.Ion-pair extraction of metalloporphyrins into acetonitrile for determination of copper(II)[J].Anal Chem,1996,68(5):758-762.
[26]Li H F,Yin J G,Liu Y M,et al.Effect of protein on the detection of fluoroquinolone residues in fish meat[J].J Agric Food Chem,2012,60:1722-1727.
