血清TNF-α升高对糖尿病肾脏脂质积聚的影响研究
2014-05-14郑书深
张 松,朱 琳,郝 军,郑书深
糖尿病肾病是危害糖尿病病人生命的重要并发症之一[1],其发生涉及高血流灌注、氧化应激[2]、糖基化末端产物、高血糖[3]、高胰岛素和血脂异常等。有研究发现,糖尿病病人和实验动物的肾组织均出现脂滴积聚,进一步证实脂质积聚在糖尿病肾病的发生中发挥重要作用[4]。固醇调节元件结合蛋白1(sterol regulatory element binding protein-1,SREBP-1)是1993年首次从体外培养的人HeLa细胞核抽提物中纯化出来的,该蛋白属于螺旋-环-螺旋-亮氨酸锌指转录因子家族,其在脂质代谢中起着重要调节作用,其高表达往往激活脂质合成相关的酶基因,引起脂肪酸、甘油三酯的合成增多[5]。脂肪分化相关蛋白(adipose differentiation related protein,ADRP)是一种重要的脂滴表面蛋白,也是细胞内脂质积聚的特征性指标[6]。
本课题组前期研究发现,糖尿病大鼠肾小管上皮细胞内出现明显脂滴,脂质代谢的重要转录因子SREBP-1明显上调并伴有脂肪酸合成酶(fatty acid synthase,FASN)的升高;进一步的体外研究又证实,给予人肾小管上皮细胞高糖刺激可上调SREBP-1,进而增加 FASN和乙酰辅酶 A羧化酶(Acetyl CoA carboxylase,ACC)的表达[7],细胞内脂滴增多,提示高糖是糖尿病导致肾小管上皮细胞脂质积聚的原因之一,然而是否还有其他因素也参与其中还未完全阐明。
细胞因子已被证实参与了糖尿病的发生发展[8],其中肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)是其中重要的细胞因子。有研究揭示:TNF-α在肝细胞[9]和皮脂腺细胞中[10],均可上调SREBP-1表达,导致细胞内脂质积聚。然而,TNF-α是否参与了糖尿病肾脏脂质积聚还未见报道,因此,本课题组拟构建糖尿病小鼠模型,检测血清中TNF-α和肾脏脂质的含量,明确二者之间的关系。对于阐明糖尿病肾脏脂质积聚的机制有重要意义,也为将来的临床治疗提供可靠的靶点和理论支持。
1 材料与方法
1.1 材料 SREBP-1抗体(可同时识别SREBP-1a和SREBP-1c)和 β-actin抗体购自于 Epitomics公司,ADRP抗体购自Santa Cruz公司。链脲佐菌素购自Sigma公司。SP法免疫组织化学试剂盒和DAB购自北京中杉金桥试剂公司。抗小鼠TNF-αELISA试剂盒购自欣博盛公司。
1.2 方法
1.2.1 糖尿病小鼠模型构建 动物实验使用CD1小鼠,拟分为以下两组:对照组和糖尿病组,每组7只。糖尿病模型采用腹腔注射链脲佐菌素150 mg·kg-1体重(streptozotocin,STZ,溶于 0.1 mol·L-1枸橼酸盐缓冲液中,pH值4.5),对照组只注射相当体积的枸橼酸盐缓冲液,72 h后,空腹血糖大于16.7 mmol·L-1者确定为1型糖尿病模型。每周检测血糖,剔除血糖恢复的小鼠(2只)。喂养1个月后,水合氯醛麻醉小鼠,眼球摘除取血,并处死动物切取肾脏。全血室温放置约1 h后3 000 r·min-1离心10 min,收集血清;肾脏切取皮质,部分置于中性福尔马林固定,制作石蜡切片,部分液氮速冻后-70℃冰箱保存。
1.2.2 ELISA ELISA方法检测正常和糖尿病小鼠血清的TNF-α水平。从冰箱中取出预包被的酶标板,平衡至室温,空白孔加通用稀释液,标准孔加不同浓度的标准品用于制作标准曲线(0、15.6、31.25、62.5、125、250、500和 1 000 ng·L-1),样品孔加待测的样品100μl,封板胶纸封住反应孔,36℃ 孵育90 min,后续步骤参照说明书进行,最后酶标仪上测量每个孔的OD450值,制作标准曲线,计算待测样品的TNF-α浓度。
1.2.3 免疫组织化学 采用SP法,以PBS代替一抗作阴性对照。石蜡切片常规脱蜡至水,抗原修复后3%过氧化氢室温孵育20 min,血清37℃封闭30 min,一抗(1∶100稀释),37℃孵育 2 h,PBS洗 3次,滴加生物素标记的二抗,37℃孵育30 min,PBS洗3次,滴加辣根过氧化物酶标记的链霉亲和素37℃孵育30 min,PBS洗3次,DAB显色、苏木精复染、分化、返蓝、脱水封片。
1.2.4 Western blot 肾组织块加入10倍体积的冰冷裂解液,经研磨后置于EP管中,4℃、12 000 r·min-1离心20 min,吸取上清,考马斯亮蓝法测定上清液蛋白浓度。每孔加80μg总蛋白,经7.5%SDS-PAGE凝胶电泳后电转移至PVDF膜;5%BSA封闭,一抗(1∶1 000稀释)4℃过夜。辣根过氧化物酶标记的二抗(1∶5 000稀释)室温孵育2 h;滴加ECL发光试剂,在暗室中压片、显影和定影。条带分析使用Gel-Pro analyzer软件,目的蛋白条带与内参β-actin条带的积分光密度(integrated optical density,IOD)比值作为相对表达量。
1.3 统计学分析 所有数据用¯x±s表示,采用SPSS13.0统计软件进行统计分析,组间比较采用t检验,相关分析采用Pearson相关性分析。
2 结果
2.1 糖尿病小鼠血清中TNF-α明显升高 正常CD1小鼠血糖平均值为11.3 mmol·L-1,糖尿病小鼠的血糖平均值为30.78 mmol·L-1。ELISA检测显示正常对照小鼠血清TNF-α浓度平均为31.05 ng·L-1,糖尿病小鼠血清TNF-α浓度平均为240 ng·L-1。相比于正常对照组小鼠,糖尿病小鼠的血清TNF-α升高了大约7.73倍,经t检验统计分析P<0.05,差异有统计学意义(Fig 1)。

Fig 1 Serum TNF-αconcentration of normal and diabetic mice
2.2 糖尿病小鼠肾脏脂质代谢相关基因SREBP-1和ADRP明显升高 免疫组织化学检测显示,糖尿病小鼠肾脏SREBP-1和ADRP表达主要定位于肾小管上皮细胞的胞质,呈明显的棕黄色,颗粒状,而正常小鼠肾脏仅见少量肾小管上皮细胞有棕黄色颗粒(Fig 2)。
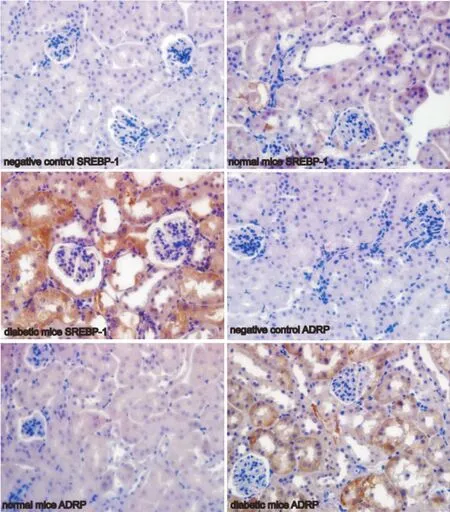
Fig 2 SREBP-1 and ADRP expression in kidney of normal control mice and diabetic mice by immunohistochemistry(×400)
Western blot检测结果见Fig 3,糖尿病小鼠肾脏SREBP-1前体片段、成熟片段和ADRP均明显升高,分别是正常小鼠的2.31倍、1.74倍和1.72倍,经统计分析差异有统计学意义(P<0.05)。

Fig 3 Expression of SREBP-1 and ADRP in kidney of normal control mice and diabetic mice by Western blot
2.3 小鼠血清TNF-α含量和肾脏ADRP表达呈正相关 采用Pearson相关分析对小鼠血清TNF-α含量和肾脏ADRP表达进行了分析,结果证实在正常小鼠和糖尿病模型小鼠,随着血清中TNF-α含量的增加,肾脏ADRP表达也明显增强,二者经统计分析显示有正相关,相关系数为0.914,P<0.05,差异有统计学意义(Fig 4)。
3 讨论
糖尿病是一种以血糖升高为临床特征的慢性疾病,并发症的出现严重危害人类健康,其中糖尿病肾病以肾脏高血流灌注、系膜细胞增生肥大、肾小管上皮细胞转分化及肾间质纤维化为特征,可导致肾功能不全,甚至引起患者死亡。研究揭示多种因素参与了糖尿病肾病的发生和发展,例如:高血糖、高血脂、糖基化终末产物、细胞因子、氧化应激。近年来,不断有研究发现,实验动物及糖尿病患者肾脏出现脂质积聚,在系膜细胞和肾小管上皮细胞内出现较多的脂滴。然而,具体的机制还未阐明[11]。

Fig 4 Correlation analysis between serum TNF-α and renal ADRP in mice
大量的研究已证实,免疫及炎症反应在糖尿病肾病发生、发展中发挥重要作用。糖尿病肾病可看作一种由代谢紊乱引起的炎症性疾病[12]。炎症因子可通过旁分泌和自分泌方式发挥病理生理作用,促进肾脏细胞增生及细胞外基质分泌和聚积、细胞肥大等,并且与疾病晚期肾小管间质纤维化(tubular interstitial fibrosis,TIF)关系密切[13]。然而,炎症因子是否和糖尿病肾脏的脂质代谢异常相关目前尚未见报道。
肿瘤坏死因子有2种亚型:TNF-α和 TNF-β。TNF-α又被称为恶质素,主要由巨噬细胞分泌,其在体内有两种存在形式,一种为跨膜型(tmTNF-α),分子质量为26 ku;另一种为游离型TNF-α,分子质量为17 ku。其中,过多游离型TNF-α会引起一系列的炎性感染及自身免疫性疾病[14]。
本研究揭示糖尿病小鼠血清TNF-α水平明显升高,这和 Hussain等[15]及 Kayal等[16]的研究相似,他们分别在糖尿病患者和实验动物体内发现血清TNF-α的明显升高。本研究还发现糖尿病肾脏脂质代谢调控因子SREBP-1和脂滴标记物ADRP也明显高于正常对照小鼠,提示糖尿病状态下,高TNF-α可能是引起肾脏脂质调控因子升高的因素之一。进一步对血清TNF-α水平和肾脏ADRP之间的表达进行了相关性分析,结果揭示随着血清TNF-α的升高,肾脏表达 ADRP也相应上调。相似地,Endo等[9]在小鼠的研究发现腹腔注射TNF-α后,很快引起了血清游离脂肪酸升高和肝脏的脂质积聚,同时肝脏脂肪酸合成酶和SREBP-1c mRNA水平的表达也明显升高。Choi等[10]在SZ95人皮脂腺细胞的研究也揭示:TNF-α刺激人皮脂腺细胞,增加细胞内脂滴形成,同时伴有脂肪酸合成酶上调和SREBP-1激活,但对PPARs未产生影响。综上所述,血清TNF-α升高可能是导致糖尿病肾小管上皮细胞脂质积聚的因素。然而,涉及这一调控的具体机制还不清楚,有待深入的体外细胞实验研究。
参考文献:
[1] Arora M K,Singh U K.Molecular mechanisms in the pathogenesis of diabetic nephropathy:an update[J].Vascul Pharmacol,2013,58(4):259-71.
[2] Chang C C,Chang C Y,Wu Y T,et al.Resveratrol retards progression of diabetic nephropathy through modulations of oxidative stress,proinflammatory cytokines,and AMP-activated protein kinase[J].J Biomed Sci,2011,18(1):47.
[3] 郝 军,朱 琳,戎赞华,段惠军.SREBP-1在1型糖尿病大鼠肾脏的表达和胰岛素的干预性研究[J].中国药理学通报,2009,25(1):95-9.
[3] Hao J,Zhu L,Rong Z H,Duan H J.Expression of SREBP-1 in kidney of type 1 diabetic rats and insulin intervention[J].Chin Pharmacol Bull,2009,25(1):95-9.
[4] Wang X X,Jiang T,Shen Y,et al.Diabetic nephropathy is accelerated by farnesoid X receptor deficiency and inhibited by farnesoid X receptor activation in a type 1 diabetes model[J].Diabetes,2010,59(11):2916-27.
[5] Bakan I,Laplante M.Connecting mTORC1 signaling to SREBP-1 activation[J].Curr Opin Lipidol,2012,23(3):226-34.
[6] Takahashi K,Sasabe N,Ohshima K,et al.Glucagon regulates intracellular distribution of adipose differentiation-related protein during triacylglycerol accumulation in the liver[J].J Lipid Res,2010,51(9):2571-80.
[7] Jun H,Song Z,Chen W,et al.In vivo and in vitro effects of SREBP-1 on diabetic renal tubular lipid accumulation and RNAimediated gene silencing study[J].Histochem Cell Biol,2009,131(3):327-45.
[8] Liu Q,Liu S,Shi Y,et al.Suppressors of cytokine signaling inhibit tubular epithelial cell-myofibroblast transdifferentiation[J].Am J Nephrol,2011,34(2):142-51.
[9] Endo M1,Masaki T,Seike M,et al.TNF-alpha induces hepatic steatosis in mice by enhancing gene expression of sterol regulatory element binding protein-1c(SREBP-1c)[J].Exp Biol Med(Maywood),2007,232(5):614-21.
[10]Choi JJ,Park M Y,Lee H J,et al.TNF-αincreases lipogenesis via JNK and PI3K/Akt pathways in SZ95 human sebocytes[J].J Dermatol Sci,2012,65(3):179-88.
[11]Karihaloo A.Anti-fibrosis therapy and diabetic nephropathy[J].Curr Diab Rep,2012,12(4):414-22.
[12]Lim A K,Tesch GH.Inflammation in diabetic nephropathy[J].Mediators Inflamm,2012,2012:146154.
[13]Lewis A,Steadman R,Manley P,et al.Diabetic nephropathy,inflammation,hyaluronan and interstitial fibrosis[J].Histol Histopathol,2008,23(6):731-9.
[14]Richter C,Messerschmidt S,Holeiter G,et al.The tumor necrosis factor receptor stalk regions define responsiveness to soluble versus membrane-bound ligand[J].Mol Cell Biol,2012,32(13):2515-29.
[15]Hussain G,Rizvi SA,Singhal S,et al.Serum levels of TNF-αin peripheral neuropathy patients and its correlation with nerve conduction velocity in type 2 diabetes mellitus[J].Diabetes Metab Syndr,2013,7(4):238-42.
[16]Kayal R A,Siqueira M,Alblowi J,et al.TNF-alpha mediates diabetes-enhanced chondrocyte apoptosis during fracture healing and stimulates chondrocyte apoptosis through FOXO1[J].J Bone Miner Res,2010,25(7):1604-15.
