运动可能通过下调肾脏Notch-1信号改善Ⅱ型糖尿病大鼠肾功能
2014-05-14朱洪竹肖国强朱梅菊
朱洪竹,肖国强,朱梅菊
运动可能通过下调肾脏Notch-1信号改善Ⅱ型糖尿病大鼠肾功能
朱洪竹1,肖国强2,朱梅菊1
目的:观察有氧游泳运动对Ⅱ型糖尿病大鼠肾脏损伤的改善效果,并探讨其可能的机制。方法:45只4周龄健康雄性SD大鼠,随机抽取10只为正常对照组,基础饲料喂养;其余35只经高糖高脂喂养5周后,配合腹腔注射STZ(35 mg/kg.bw)诱导建立Ⅱ型糖尿病大鼠模型;7周后,将成模大鼠随机分为糖尿病安静组和糖尿病运动组,每组14只。3组大鼠均采用基础饲料喂养;糖尿病运动组大鼠进行8周有氧游泳运动;正常对照组、糖尿病安静组2组大鼠均自由活动,不施加任何干预。结果:(1)8周有氧游泳运动后,糖尿病运动组肾脏在电镜下的形态表现为肾小球三层结构较清晰,基底膜增厚不明显,足突融合减少,溶酶体增多现象等均有一定程度减少,较糖尿病安静组有明显改善;(2)糖尿病运动组血糖浓度和24 h UA排泄量较糖尿病安静组显著降低(分别为P<0.05或P<0.01);(3)糖尿病运动组肾皮质Jagged-1、Val1744NICD和Hes-1蛋白的表达较糖尿病安静组均显著降低(P<0.05或P<0.01)。结论:运动可提高Ⅱ型糖尿病大鼠肾功能,改善大鼠肾脏损伤,可能与其下调Ⅱ型糖尿病状态下激活的Notch-1信号通路有关。
Ⅱ型糖尿病;有氧运动;肾脏损伤;Notch-1信号通路;动物实验
Ⅱ型糖尿病引起的肾脏病变以肾小球滤过屏障损害为主要特征,与进展性肾小球硬化关系密切,是导致糖尿病患者死亡的重要原因。
肾小球足细胞是糖尿病肾病变特征性标志——蛋白尿发生发展的中心靶标[1]。糖尿病状态下,高血糖可活化Notch-1信号,其在肾小球足细胞内的激活有可能是包括糖尿病肾病变在内的肾小球疾病的一个新的发病机制[2]。运动可降低血糖,保护糖尿病大鼠肾功能[3]。运动的肾保护作用是否依赖其对Notch-1信号的调节,目前尚不清楚。有关Notch-1信号与运动抗糖尿病肾脏损伤方面的报道尚无,且国内外运动医学领域有关Notch-1信号的研究甚少。本研究通过高糖高脂饲料喂养加腹腔注射低剂量链脲佐菌素(STZ)诱导建立Ⅱ型糖尿病大鼠模型,观察运动对Ⅱ型糖尿病大鼠肾脏病变的改善效果,并对其作用机制进行探讨,以期探寻运动保护糖尿病肾脏新的作用靶点,为糖尿病肾脏病变运动疗法的开展提供新的理论基础。
1 研究材料与方法
1.1 实验动物
45只雄性SD大鼠,4周龄,SPF级,体重(140±20)g,购自中国科学院上海实验动物中心湖南斯莱克景达实验动物公司,许可证号SCXK(湘)2009-0004。大鼠分笼喂养,5只/笼,自由饮食和饮水,动物房温度(22±0.3)℃,湿度50%~60%。每日保持12 h光照,动物房每周紫外线消毒1次。高糖高脂饲料(Co60辐照大鼠无菌颗粒料)组成:20%蔗糖、10%猪油、5%蛋黄粉、0.5%胆酸盐、1%胆固醇、63.5%常规饲料,购于广东省中医药大学实验动物中心。
1.2 模型建立与动物分组
参照REED等[4]方法建立Ⅱ型糖尿病大鼠模型。SD大鼠购进后,适应性喂养1周后,随机分为正常对照组(10只)和造模组(35只)。正常对照组大鼠以标准啮齿类普通饲料常规喂养,造模组大鼠以高糖高脂饲料喂养。5周后,造模组经口服葡萄糖耐量实验和胰岛素敏感性实验确定存在胰岛素抵抗后,禁食12 h后按35 mg/kg.bw[5]剂量腹腔注射STZ,对照组大鼠同等条件下以同等剂量的柠檬酸-柠檬酸三钠缓冲液注射。STZ注射3天和7天后,尾静脉采血测定血糖,以随机血糖≥16.7 mmol/L为暂成模标准。高血糖大鼠继续观察1周后,再次测量血糖,以随机血糖仍≥16.7 mmol/L为造模成功[6]。剔除未达标和死亡大鼠,共有28只成模大鼠,将成模大鼠随机分为糖尿病安静组(14只)和糖尿病运动组(14只)。实验过程中,2组大鼠死亡7只,至实验末,糖尿病安静组余10只,糖尿病运动组余11只。
1.3 运动方案
参照PLOUG等[7]方法结合预实验经验,建立大鼠无负重有氧游泳运动方案。运动前1周,先让大鼠进行10 min/天(5天/周)的适应性游泳。正式运动时间为,第1周30 min/天,第2周45 min/天,第3周起60 min/天,每周6天,维持此运动量连续运动8周结束。圆形游泳池规格100 cm×80 cm×80 cm,水深45 cm,水温维持在(31±1)℃[8]。每桶3~4只大鼠,采用人为驱赶的方式让大鼠保持持续游泳,个别大鼠游泳中若出现疲劳状态,则予以短暂性休息,但所有运动大鼠保证每次游泳总时间不变。
1.4 主要试剂
免抗鼠Jagged-1和Hes-1均为多克隆抗体,购于北京博奥森公司;免抗鼠Val1744 NICD多克隆抗体购于英国abcam公司;大鼠尿微量白蛋白ELISA测试盒购于美国RB公司;STZ、戊二醛购于美国Sigma公司;锇酸、醋酸铀为英国Johnson Matthey化学有限公司;环氧树脂Epon 812为上海树脂厂;枸橼酸铀为北京化工厂。
1.5 实验取材与指标检测
1.5.1 实验取材 8周运动干预停止36 h后,过夜禁食12 h,麻醉处死大鼠。大鼠麻醉前一天代谢笼留取24 h尿液,留尿期间禁食不禁水,记录尿量体积后从中取3 mL,离心(2 000 r/min,10 min),弃去下层沉渣和残留物,存于-80℃冰箱待测24 h尿微量白蛋白指标。依次以10%的水合氯醛(剂量:0.35~0.40 mL/kg)麻醉大鼠,打开腹腔,迅速摘取两侧肾脏,去除双肾包膜后,分离肾皮质,取大鼠左侧肾脏髓质交界处皮质部分,迅速置于电镜固定液(4℃预冷,2.5%戊二醛溶液)中,切成1 mm3大小组织数块,用玻璃吸管转移到标本瓶中,用作透射电镜检查。另取部分肾皮质,标记分装后放入液氮保存以做Western-blotting检测。
1.5.2 指标检测 (1)电镜标本制备及观察。常规方法制作电镜标本,Tecnai G2 S-Twin透射电镜(美国,FEI公司)主要观察肾小球内皮细胞、基底膜、足细胞等形态结构。(2)血糖,采用生化法(德国,ECOM-F1624型半自动生化分析仪)。(3)24 h尿微量白蛋白,ELISA酶联免疫法(芬兰,352型酶标仪)。(4)Jagged-1、Val1744NICD、Hes-1指标Western-blotting检测。
称取100 mg大鼠肾皮质组织,加入PIPA裂解液(PMSF临用时再加),匀浆充分,离心(4℃,12 000 rpm×10 min),取上清。BCA法总蛋白定量:取25 ug总样品电泳后,将蛋白转移到硝酸纤维膜(PVDF膜);10%脱脂奶粉封闭液封闭2 h或过夜,加免抗鼠一抗孵育,各抗体工作浓度是Jagged-1(1:500),Val1744 NICD(1:1 000),Hes-1(1:500);二抗室温反应1 h。洗膜充分后依次曝光、显影、定影、扫描。用EC3凝胶电泳成像分析软件(America)系统记录每条蛋白电泳带的灰度值,进行定量分析。目的蛋白相对含量=目的蛋白(OD)/内参GAPDH(OD)。
1.6 数据处理
所有实验数据以均数±标准差(Mean±SD)表示,采用SPSS16.0统计软件进行统计学分析。2组间比较采用两样本均数T检验,多组比较采用单因素方差分析,Plt;0.05为显著性差异,Plt;0.01为极显著性差异。
2 实验结果
2.1 各组大鼠血糖浓度的变化
干预前,糖尿病安静组和糖尿病运动组2组大鼠血糖浓度高于正常对照组(Plt;0.01);干预后,糖尿病运动组血糖浓度自干预第4周起呈下降趋势,第6周血糖较对应周糖尿病安静组进一步降低,第8周降低更为明显(Plt;0.05),而糖尿病安静组血糖仍处于较高水平(Plt;0.01)(见表1)。
2.2 各组大鼠24 h尿微量白蛋白的变化
干预前,糖尿病安静组和糖尿病运动组2组大鼠的24 h尿微量白蛋白(UA)排泄量均显著高于正常对照组(Plt;0.01);干预后,糖尿病安静组24 h UA排泄量表现出随病程延长逐渐增加,而糖尿病运动组自干预第6周起较糖尿病安静组大鼠呈下降趋势,至第8周降低更为明显(Plt;0.01)(见表2)。
2.3 电镜观察结果
电镜下,正常对照组大鼠肾小球基底膜内、中、外3层结构清晰,厚度均匀,足细胞排列规划、整齐,足突分布均匀未见融合(见图1);肾小管(近曲段)上皮细胞核呈圆形,线粒体排列紧密(见图2)。糖尿病安静组肾小球3层结构不清,基底膜厚薄不均,呈节段性增厚,足细胞排列紊乱,足突融合增加等(见图3、图4);肾小管上皮细胞线粒体肿胀,胞质内可见增多的溶酶体和小空泡,细胞凋亡等(见图5)。镜下显示,与糖尿病安静组比较,糖尿病运动组肾小球基底膜尚均匀一致,足突只见部分融合,基底膜增厚不明显等(见图6);肾小管上皮细胞线粒体肿胀、溶酶体增多现象明显改善(见图7)。
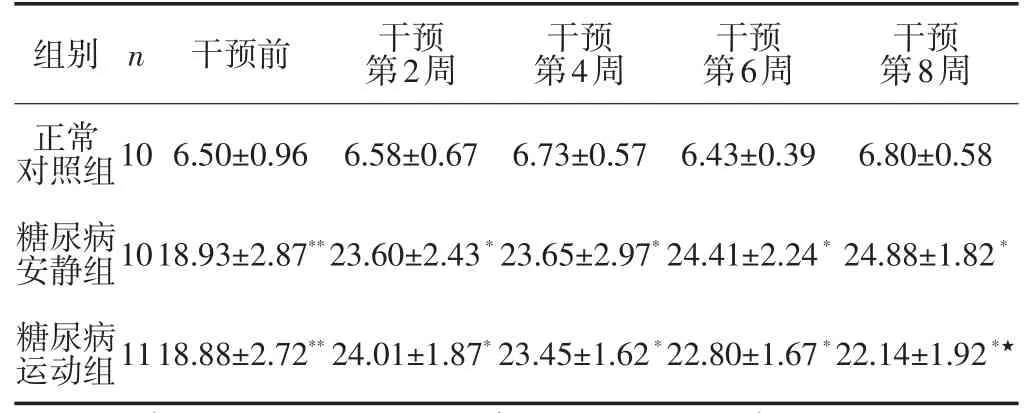
表1 各组大鼠血糖浓度的变化/mmol·L-1Table1 Changes of the blood glucose concentrations of rats in various groups/mmol·L-1
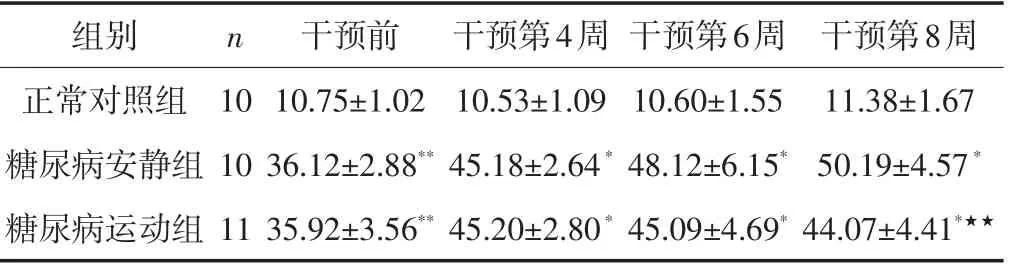
表2 各组大鼠24 h尿微量白蛋白的变化/mg·24 h-1Table2 Changes of the excretion of microalbuminuria of rats in various groups/mg·24 h-1
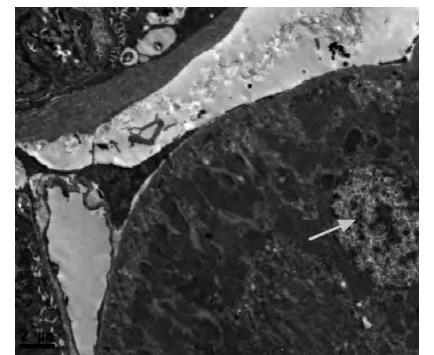
图2 正常对照组肾小管(×3 900)Figure2 Normal control group renal tubules(×3 900)
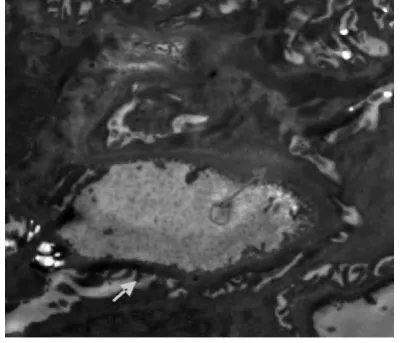
图3 糖尿病安静组肾小球(×5 800)Figure3 Diabetic control group renal glomerulus(×5 800)
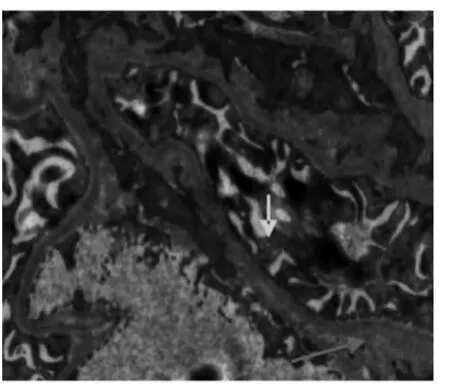
图4 糖尿病安静组肾小球(×9 700)Figure4 Diabetic control group renal glomerulus(×9 700)
2.4 各组大鼠肾皮质Jagged-1、Val1744NICD、Hes-1蛋白表达的变化
与正常对照组相比,糖尿病安静组肾皮质Jagged-1、Val1744NICD和Hes-1蛋白的表达都明显增加(Plt;0.01);与糖尿病安静组相比,糖尿病运动组肾皮质Jagged-1、Val1744NICD和Hes-1蛋白的表达均显著降低(Plt;0.05或Plt;0.01),但仍高于正常对照组(Plt;0.01)(见表3,图8~图10)。
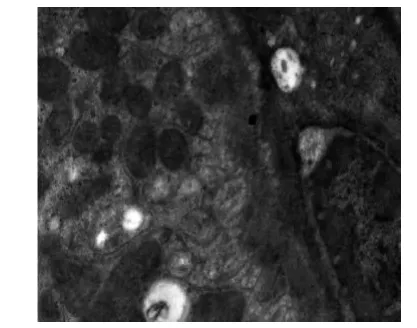
图5 糖尿病安静组肾小管(×18 500)Figure5 Diabetic control group renal tubules(×18 500)
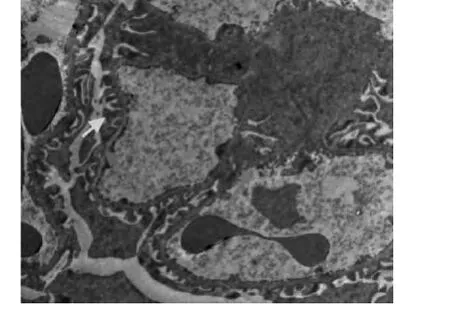
图6 糖尿病运动组肾小球(×5 800)Figure6 Diabetic exercise group renal glomerulus(×5 800)
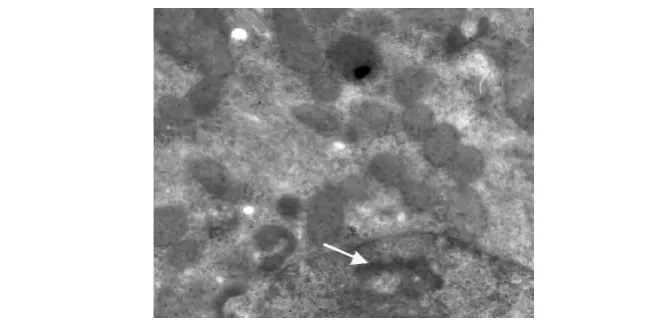
图7 糖尿病运动组肾小管(×18 500)Figure7 Diabetic exercise group renal tubules(×18 500)

表3 干预第8周末各组大鼠肾皮质Notch-1信号通路关键蛋白的相对表达量(n=3)Table3 The relative protein expression of the components of Notch-1 signaling pathway of the renal cortex of rats in various groups after the intervention of the 8thweek(n=3)
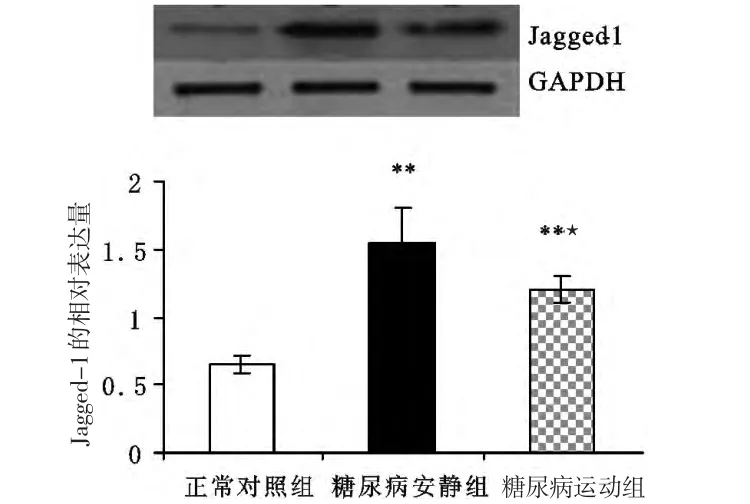
图8 各组大鼠肾皮质Jagged-1蛋白相对表达量的变化Figure8 Changes of the relative protein expression of Jagged-1 of the renal cortex of rats in various groups
3 讨论
3.1 有氧运动对Ⅱ型糖尿病大鼠肾功能和肾脏结构损伤的影响
尿微量白蛋白(microalbuminuria,简称UA)是目前临床作为诊断糖尿病早期肾脏病变的标准,反映肾脏结构及功能的早期受损或轻度受损[9-10]。本研究结果显示,干预前,糖尿病安静组和糖尿病运动组2组的24 h UA排泄量未见明显统计学差异,但均明显高于正常对照组(Plt;0.01)。说明,5周的高糖高脂饮食饲喂的胰岛素抵抗大鼠诱发糖尿病时,在干预前大鼠肾脏结构和功能已发生变化,随着血糖的逐渐增高,进一步加重对肾脏的损害。对肾脏超微结构的检测结果表明,电镜下的糖尿病安静组大鼠出现了肾小球,3层结构不清,基底膜呈节段性增厚,足细胞排列紊乱,足突融合增加等病理变化特征。这进一步从形态学方面佐证了本研究的模型大鼠已出现肾脏早期损害[11]。
经有氧游泳运动干预8周后,糖尿病运动组24 h UA排泄量和肾组织形态变化均较糖尿病安静组有明显改善,提示运动能提高Ⅱ型糖尿病大鼠肾功能,减轻肾脏损伤。POORTMANS等[12]指出,运动诱导的蛋白尿直接与运动强度有关,而不是运动时间。过度或急性运动可减少肾脏有效血流量和肾小球滤过率,引起蛋白尿的排泄增加,肾功能受损,肾脏出现损害[3];规律运动可减少蛋白尿的排出,改善肾功能,保护肾脏[13]。本研究结果与前人研究报道[13]相一致。
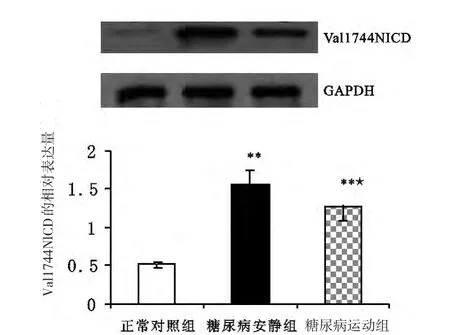
图9 各组大鼠肾皮质Val1744NICD蛋白相对表达量的变化Figure9 changes of the relative protein expression of Val1744NICD of the renal cortex of rats in various groups
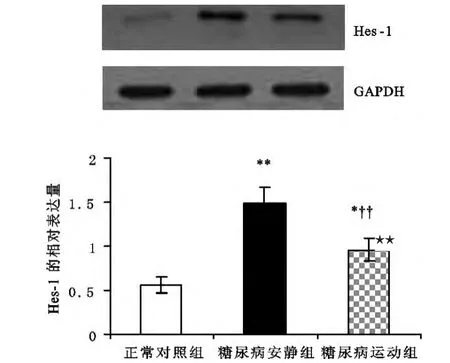
图10 各组大鼠肾皮质Hes-1蛋白相对表达量的变化Figure10 changes of the relative protein expression of Hes-1 of the renal cortex of rats in various groups
3.2 有氧运动改善Ⅱ型糖尿病大鼠肾脏损伤的可能机制
Ⅱ型糖尿病引起的肾脏病变,同许多肾脏疾病一样,是以肾小球滤过屏障损害和功能失调而引起的蛋白尿出现为早期主要特征[14]。滤过膜的改变是肾功能下降的关键因素,而位于滤过膜外侧的足细胞是维持肾小球滤过膜结构与功能正常的关键细胞之一[14]。运动能有效改善Ⅱ型糖尿病大鼠肾脏病变,其是否通过对足细胞的影响来实现?其作用机制是什么?目前研究尚不明确。
Notch-1信号通路是最近研究的一个新的通路。最新研究发现,其在肾小球足细胞内的激活有可能是包括糖尿病肾病变在内的肾小球疾病的一个新的发病机制[2],而激活的Notch-1信号可促蛋白尿的发生和肾小球功能异常[2,14]。本研究发现,糖尿病安静组肾皮质中,Val1744 NICD蛋白表达水平较正常对照组显著增加。同时,Western-blotting方法也检测到Jagged-1和Hes-1蛋白,其在糖尿病安静组大鼠的表达较正常对照组大鼠均显著增加,而在正常对照组肾皮质中均少见表达,这与先前研究[2]相一致。Notch(包括Notch-1)信号通路活化需要细胞与细胞的接触,Notch受体与邻近配体(如Jagged-1)结合后,导致Notch受体的一系列溶蛋白性裂解,最后释放有活性的Notch胞内段(Notch intracellular domain,NICD/ICN1),然后移位于核与别的转录子结合,引起靶基因(如Hes-1基因)的转录,而Hes-1基因又能激活其他基因转录,从而使Notch信号的传递得到放大[15]。本研究表明,Notch-1信号在实验性Ⅱ型糖尿病模型SD大鼠肾小球内可被激活。现已知,高血糖是Notch-1信号通路活化的直接诱因[2,14]。结合血糖的检测结果(见表1)和糖尿病安静组肾组织形态的变化,认为,本研究糖尿病大鼠体内高浓度血糖可能诱导了Notch-1信号通路活化;其表达上调可能是糖尿病致肾脏病变的一个显著的特征[2,14,16]。
Notch-1信号通路与糖尿病肾病变关系密切,下调或阻断Notch-1信号通路,可逆转肾小球疾病和减少蛋白尿的发生[2,14,17]。Notch-1信号通路的调节有可能是糖尿病肾病变的一个新的治疗靶标[18]。本研究已发现,运动对Ⅱ型糖尿病大鼠肾脏有一定保护作用,但运动的肾保护效应是否依赖于Notch-1信号通路的调节?目前不清楚。为此,本研究检测了有氧游泳运动干预8周后,Ⅱ型糖尿病大鼠肾皮质Notch-1信号通路中配体Jagged-1、Notch-1活化形式(NICD)的特异性抗体Val1744和靶基因Hes-1蛋白的活性或含量。结果发现,有氧运动干预8周后,糖尿病运动组肾皮质Jagged-1、Val1744 NICD和Hes-1蛋白均显著低于糖尿病安静组。这表明,运动能下调Notch-1信号通路活性。同时本研究也发现,运动干预的Ⅱ型糖尿病大鼠血糖明显降低,其肾功能和肾组织结构损伤亦得到明显的改善,提示,运动保护肾脏的作用可能与其降低血糖及下调由高血糖激活的Notch-1信号通路蛋白的表达有关。这在关于Notch-1信号通路与运动机体的报道相对较少[19],而在糖尿病肾病变实验研究中有关运动对Notch-1信号通路的影响目前还未见有相关报道。本文也是首次发现,有氧运动能明显下调Notch-1信号通路中Jagged-1、Val1744 NICD、Hes-1的活性,并减弱其通路引起的致Ⅱ型糖尿病大鼠肾损伤的效应,有氧运动改善Ⅱ型糖尿病大鼠肾脏损伤的可能机理图见图11。
4 结 论
8周有氧游泳运动可降低Ⅱ型糖尿病状态下升高的血糖,提高Ⅱ型糖尿病大鼠肾功能、减轻大鼠肾脏损伤。这可能与其下调Ⅱ型糖尿病条件下激活的Notch-1信号通路中Jagged-1、Val1744 NICD和Hes-1的蛋白表达水平,在一定程度上阻断Notch-1信号转导有关。

图11 有氧运动改善Ⅱ型糖尿病大鼠肾脏损伤的可能机理Figure11 The possible mechanism of improvement of aerobic exercise on renal injury in type 2 diabetic rats
[1]ZIYADEH F N,WOLF G.Pathogenesis of the podocytopathy and proteinuria in diabetic glomerulopathy[J].Curr Diabetes Rev,2008,4(1):39-45.
[2]NIRANJAN T,BIELESZ B,GRUENWALD A,et al.The Notch pathway in podocytes plays a role in the development of glomerular disease[J].nature medicine,2008,14(3):290-298.
[3]HATICE K,SUNAY S,NILAY E.The effects of regular aerobic exercise on renal functions in streptozotocin induced diabetic rats[J].Journal of Sports Science and Medicine,2010(9):294-299.
[4]REED M J,MESZAROS K,ENTES L J,et al.A new rat model of type 2 diabetes:the fat fed,streptozotoc in treated rat[J].Metabolism,2000,49:1390-1394.
[5]MAHMOUD A M,ASHOUR M B,ABDEL-MONEIM A,et al.Hesperidin and naringin attenuate hyperglycemia-mediated oxidative stress and proinflammatory cytokine production in high fat fed/streptozotocin-induced type 2 diabetic rats[J].J Diabetes Complications,2012 ,26(6):483-490.
[6]REES D A,ALCOADO J C.Animal models of diabetes mellitus[J].Diabetic Medicine,2005,22:359-370.
[7]PLOUG T,STALLKNECHT B M,PEDERSEN D,et al.Effeet of endurance training on glucose transport capacity and glucose transporter expression in rat skeletal muscle[J].A m J Physiol,1990,259:778-786.
[8]LEE Y,KIM J H,HONG Y,et al.Prophylactic effects of swimming exercise on autophagy-induced muscle atrophy in diabetic rats[J].Lab Anim Res,2012,28(3):171-179.
[9]殴阳涓,姜傥.肾脏的损伤性诊断[J].中华检验医学杂志,2005,28(8):77-879.
[10]MOGENSEN C E,CHRISTENSEN C K.Predicting diabetic nephropathy in insulin-dependent patients[J].N Engl J Med,1984,311(2):89-93.
[11]CHEN K H,HUNG C C,HSU H H,et al.Resveratral ameliorates early diabetic nephropathy associated with suppression of augmented TGF-β/smad and ERK1/2 signaling in streptozotocin induced diabetic rats[J].Chem Biol Interact,2011,190(1):45-53.
[12]POORTMANS J R,MATHIEU N,DE PLAEN P.Influence of running different distances on renal glomerular and tubular impairment in humans[J].European Journal of Applied Physiology and Occupational Physiology,1996,72:522-527.
[13]LAZAREVIC G,ANTIC S,VLAHOVIC P,et al.Effects of aerobic exercise on microalbuminuria and enzymuria in type 2 diabetic patients[J].Ren Fail,2007,29(2):199-205.
[14]LIN C L,WANG F S,HSU Y C,et al.Modulation of Notch-1 Signaling Alleviates Vascular Endothelial Growth Factor–Mediated Diabetic Nephropathy[J].Diabetes,2010,59(8):1915-1925.
[15]HAYWARD P,KALMAR T,ARIAS A M.Wnt/Notch signaling and information processing during development[J].Development,2008,135:411-424.
[16]MUREA M,PARK J K,SHARMA S,et al.Expression of Notch pathway proteins correlates with albuminuria,glomerulosclerosis,and renal function[J].International Society of Nephrology,2010,78(5):514-522.
[17]MUREA M,PARK J K,SHARMA S,et al.Reversible tubular proteinuria precedes Microalbuminuria and correlates with the metabolic status in diabetic children[J].Pediatr Nephrol,1993,7(1):23-26.
[18]MERTENS P R,RAFFETSEDER U,RAUEN T.Notch receptors:a new target in glomerular diseases[J].Nephrol Dial Transplant,2008,23(9):2743-2745.
[19]TSIVITSE S K,PETERS M G,STOY A L,et al.The effect of downhill running on Notch signaling in regenerating skeletal muscle[J].Eur J Appl Physio l,2009,106(5):759-767.
Aerobic Swimming Exercise can Improve Renal Function for Type 2 Diabetes Rats through Downregulating the ActivityofNotch-1Signaling
ZHU Hongzhu1,XIAO Guoqiang2,ZHU Meiju1
(1.School of PE and Sports Science,Jinggangshan University,Ji’an 343009,China;2.School of PE and Sports Science,South China Nor⁃mal University,Guangzhou 510631,China)
Objective:To investigate the effect of aerobic swimming exercise on improving renal injury in type 2 diabetic rats and its mechanism.Methods:Forty-five male Sprague-Dawley(SD)rats for 4 weeks were randomly selected 10 SD rats as normal control group by normal diet feeding.The model of type 2 diabetic rats was duplicated in the study through 35 SD rats fed high-sugar-fat diet for five weeks together with intraperitoneal infecting of low dose of STZ(35mg/kg.bw).After 7 weeks the model rats were randomly divided into diabetic control group(N=14)and diabetic exercise group(N=14).The three groups were all fed by normal diet feeding.Diabetic exercise group was underwent the intervention of swimming exercise for 8 weeks,while normal control group and diabetic control group moved freely without any intervention.Results:(1)After swimming exercise for 8 weeks,the group treated by exercise could be found through electron microscope that it had clearer glomerular structure,such as no-obvious thickened glomerular basement membrane,decreased fusion of foot process,and reduced lysosome of renal tubular cells,and so on,which improved significantly comparing with diabetic control group.(2)Compared with dia⁃betic control group,the concentrations of blood glucose and the 24h microalbuminuria excretion in diabetic exercise group decreased significantly(P<0.05 or P<0.01).(3)Compared with diabetic control group,diabetic exercise group of Jagged-1 and Val1744NICD and Hes-1 expressions in the renal cortex de⁃creased significantly(P<0.05 or P<0.01).Conclusions:Exercise can protect renal function and improve renal injury for type 2 diabetes,which may be relat⁃ed to downregulating the activity of Notch-1 signaling stimulated under type 2 diabetes conditions.
type 2 diabetes;aerobic exercise;renal injury;Notch-1 signaling pathway;animal experiment
G 804.5
A
1005-0000(2014)01-001-05
2013-09-02;
2013-12-13;录用日期:2013-12-14
国家自然科学基金项目(项目编号:31360255);国家自然科学基金项目(项目编号:31160217);江西省高等学校自然科学研究项目(项目编号:JZB1313)
朱洪竹(1971-),女,湖南娄底人,博士,讲师,研究方向为运动与慢性病的防治与机理研究;通信作者:朱梅菊(1968-),女,湖南双峰人,教授,博士后,研究方向为运动与慢性病的防治与机理研究。
1.井冈山大学体育学院,江西吉安343009;2.华南师范大学体育科学学院,广东广州510631。
