培美曲塞联合卡铂治疗铂类敏感复发转移卵巢癌38例临床观察
2014-05-12陈凯英方美玉
陈凯英,方美玉
(1.浙江省鄞州人民医院妇产科,宁波 315040;2.浙江省肿瘤医院肿瘤内科,杭州 310010)
全世界每年有23万例卵巢癌被确诊[1]。卵巢癌患者大部分发现时已经为晚期,临床处理上是以化疗为主的综合治疗。虽然大部分患者对含铂方案敏感,但是其中绝大部分患者最终会出现复发,再次治疗的疗效则明显下降。首次含顺铂治疗疗效持续6月以上者,属于对顺铂敏感者,再次治疗的标准是再次含铂类化疗[2]。紫杉醇联合顺铂是目前治疗晚期卵巢癌的金标准[3],但是多次治疗后患者会出现加重的消化道和血液系统及神经系统的毒性,其中紫杉醇主要以神经和血液学毒性为剂量显著性毒性反应,而消化道和肾毒性是顺铂的剂量限制性毒性反应,因此临床迫切寻求能有效替代紫杉醇联合顺铂的治疗方案。
培美曲塞是一种多靶点的叶酸抑制剂。被广泛应用于胸膜间皮瘤和非小细胞肺癌的一线、二线治疗中,临床前研究显示卵巢癌细胞对其敏感[4];卡铂是顺铂的类似物,但是和顺铂有不一样的毒副反应,也是对卵巢癌有效的药物之一。研究发现,培美曲塞联合卡铂在胸膜间皮瘤的治疗中疗效和耐受性均较好[5-6]。Sehouli等[7]用此方案治疗晚期卵巢癌的I期研究发现患者的耐受性较好。基于此,我们采用培美曲塞联合卡铂治疗前次顺铂治疗后复发或转移的晚期卵巢癌38例,和同期紫杉醇联合顺铂再次治疗的晚期卵巢癌40例作对比,分析了两种方案治疗晚期卵巢癌的疗效和毒副反应。现将结果报告如下。
一、资料和方法
1.一般资料:我院和协作医院浙江省肿瘤医院在2009年1月至2010年12月间有38例顺铂治疗后复发的晚期卵巢癌病例接受了培美曲塞联合卡铂治疗(观察组)。患者年龄在24~72周岁之间,平均54.7岁;所有的患者均经病理确诊为卵巢上皮细胞癌(33例)或混合型上皮癌(5例);均为接受过含顺铂方案化疗后超过6个月后再出现复发的病例。所有患者均为进展期(局部晚期+远处转移),未接受过放疗和靶向治疗,均为无法耐受或者拒绝进一步减瘤术的患者。其中腹膜转移者有16例,肝脏转移6例,盆腔内转移有10例,另外6例为多脏器转移患者。
同期紫杉醇联合顺铂治疗组共计40例(对照组),均为初次化疗后复发或转移的复治卵巢上皮癌,前次含铂类化疗结束后超过6个月。
2.治疗方法:每个周期化疗前所有的患者都进行常规的血液学、影像学和体格状况检查,患者的肝肾功能和心肺功能无明显异常。采用3周方案(21天为1周期)。观察组培美曲塞以500mg/m2、卡铂以AUC 5来计算,治疗前1周进行叶酸和维生素B12以及类固醇激素的预处理,叶酸的治疗维持到停用培美曲塞后3周。对照组患者接受紫杉醇175 mg/m2、顺铂75mg/m2。所有患者接受2周期化疗后评价疗效。如果患者出现无法耐受的毒性反应或者出现肿瘤进展(PD)则停止化疗,其余的患者至少接受6周期化疗。所有患者化疗同时未接受放疗、手术等其他抗肿瘤治疗(无法耐受或者拒绝),治疗前签署知情同意书。
3.随访:化疗结束后2年内每隔3个月复查一次,复查内容为胸腹盆CT和常规血液学检查。随访时间1~24个月,中位11月,随访率为100%。
4.疗效及毒副反应评估:(1)疗效评定采用RECIST标准[8]:完全缓解(CR,所有靶病灶消失)、部分缓解(PR,靶病灶最长径之和与基线状态比较,至少减少30%)、疾病稳定(SD,介于部分缓解和疾病进展之间)和疾病进展(PD,靶病灶最长径之和与治疗开始之后所纪录到的最小的靶病灶最长径之和比较,增加20%,或者出现一个或多个新病灶)。其中CR+PR判定为有效;(2)毒性反应采用 WHO化疗毒性标准[9]分为Ⅰ~Ⅳ度。
无进展生存期(PFS):是指从患者接受化疗至出现肿瘤进展或者出现任何原因的死亡的时间;生存期:从患者接受治疗到死亡的时间。末次随访时患者仍旧未出现进展或者死亡,则算截尾(censor)。
5.统计方法:采用SPSS13.0进行统计分析,寿命表法进行生存分析。以P<0.05为差异有统计学意义。
二、结果
1.患者基本资料:两组患者平均年龄、ECOG评分、病例类型、FIGO分期及前次治疗的PFS见表1。
2.两种方案的疗效比较:(1)观察组38例患者均可评价疗效,共化疗140个周期,平均3.7个;有14例评定为有效(1例CR和13例PR),有效率36.8%(95%CI19.7-45.3);(2)对照组40例患者,共化疗121周期,平均3.0个;无CR病例,有12例PR,有效率30.0%。两组总体疗效比较无统计学差异(P>0.05)(表2);(3)观察组中位随访期为11月,中位PFS为9.74月(95%CI8.5-13.3);对照组患者中位随访期11.2月,中位PFS为9.0个月(95%CI6.3-12.3)。两组中位PFS比较无统计学差异(P>0.05)(表2,图1)。
至随访结束有较多的患者尚存活,其中观察组有25例,对照组22例生存,导致截尾数据较多,因此无法计算总生存期。

表1 两组患者基本资料(n)

表2 两组患者疗效比较(n)
3.前次含铂类治疗PFS对再次治疗效果的影响:观察组中前期顺铂方案治疗PFS>12个月者(n=13)此次联合治疗中位PFS达12.24个月,而前期顺铂方案PFS 6~12个月者(n=25)此次中位PFS为9.23个月,两者比较有统计学差异(P=0.002)(图2A);同样,对照组也观察到类似结果,前期PFS>12个月者(n=13)和6~12个月者(n=27)此次中位PFS分别为11.0和7.7个月,两者比较有统计学差异(P=0.034)(图2B)。
4.两组患者不良反应比较:(1)血液学毒性:为两种治疗方案的主要不良反应,Ⅲ~Ⅳ度骨髓抑制表现为粒细胞下降、血小板减少和贫血。出现Ⅲ~Ⅳ度粒细胞下降的患者均接受粒细胞集落因子的治疗,出现Ⅲ~Ⅳ度血小板下降的患者均接受白细胞介素-11的治疗。两组血液学毒性反应比较,无统计学差异(P>0.05)。(2)消化道毒性:观察组消化道反应多为Ⅰ~Ⅱ度,有26例患者出现轻微的恶心和呕吐,1例恶心呕吐Ⅲ度,2例患者出现Ⅲ度腹泻,经止泻补液治疗后好转。对照组14例出现Ⅲ~Ⅳ度消化道反应,显著高于观察组(P<0.05)。(3)神经毒性及其他:观察组有3例出现I度神经毒性,表现为四肢末梢的麻木不适,但均在停药1周后缓解。其他轻度反应主要为乏力和皮疹。对照组有7例Ⅲ度以上神经毒性和19例Ⅲ度以上的脱发,均高于观察组(P<0.05)(表3)。
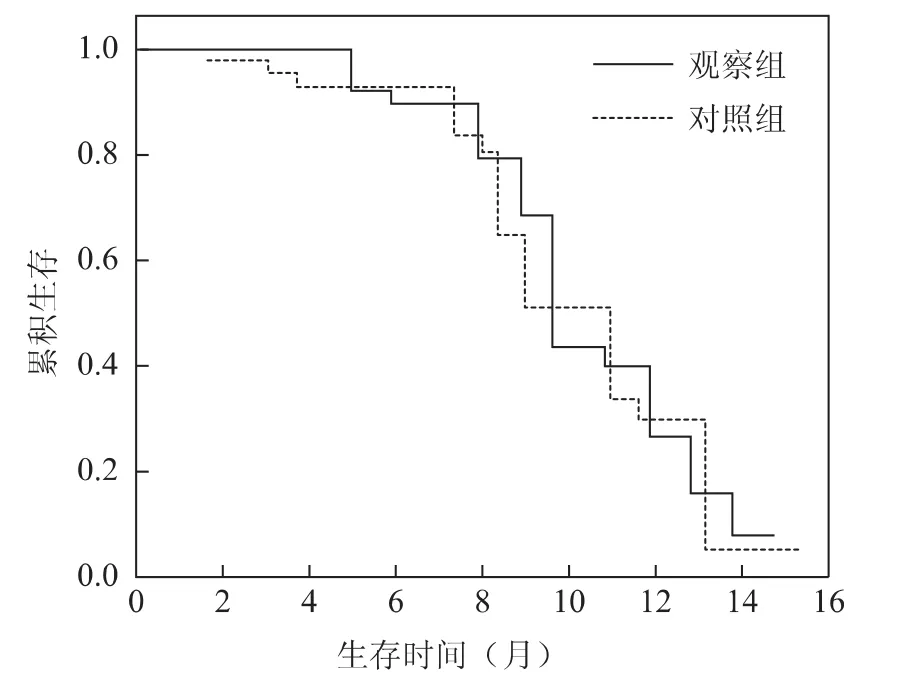
图1 复发卵巢癌患者两种治疗方案的生存函数

图2 复发卵巢癌患者按前次治疗PFS分层分析的生存函数
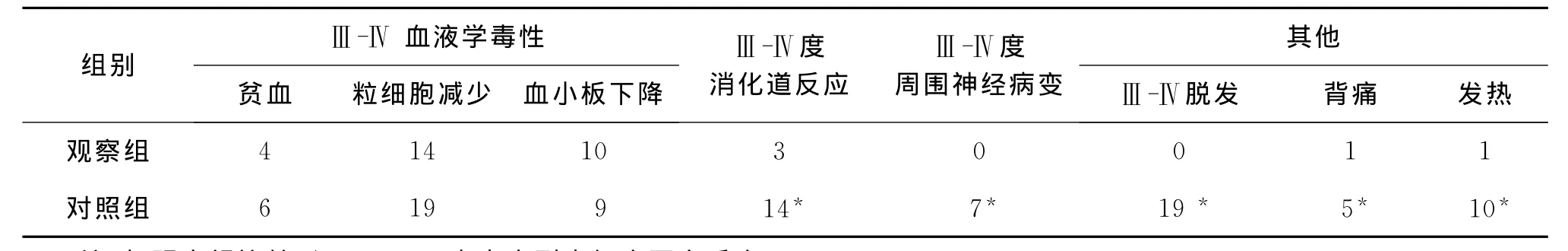
表3 两组患者不良反应比较(n)
三、讨论
卵巢恶性肿瘤是女性生殖器常见的三大恶性肿瘤之一,发病率虽非首位,但由于卵巢位于盆腔深部,早期病变不易发现,晚期病例也缺乏有效的治疗手段,因此其致死率居妇科恶性肿瘤首位,已成为严重威胁妇女生命和健康的主要肿瘤。含顺铂的一线化疗方案虽然敏感性较高,但是有许多患者会出现复发和耐药。对于顺铂敏感的复发病例,临床上复治方案是再次含铂类药物治疗。
本研究采用培美曲塞联合卡铂治疗复发铂类敏感性卵巢癌,有效率36.8%,中位PFS 9.74个月,与紫杉醇联合顺铂方案疗效相当。同时研究发现,再次含铂类药物治疗,无论是培美曲塞联合卡铂方案,还是紫杉醇联合顺铂方案,其疗效均与首次顺铂治疗疗效相关,前次治疗PFS长者,本次治疗的PFS也较长。表明患者对首次含铂类药物治疗的敏感程度,可在很大程度上预测再次含铂类药物方案的预后。
与紫杉醇联合顺铂比较,培美曲塞联合卡铂方案的优势在于明显减轻的消化道和神经毒性,而且未见严重脱发病例。相对较轻的副反应还可带来患者治疗依从性/耐受性的改善,培美曲塞方案组平均完成的治疗周期数就要高于紫杉醇组(分别为3.7和3.0),而紫杉醇联合方案因患者不耐受而中断治疗的情况更多。可见培美曲塞联合卡铂方案的疗效确切,毒副反应可耐受程度提升,这与 Matulonis等[10]的研究结果类似。
总之,培美曲塞联合卡铂治疗铂类敏感复发卵巢癌疗效确切,安全性高,值得大样本随机对照研究进一步探讨。
[1] American Cancer Society.Global Cancer Facts &Figures 2007.Atlanta:American Cancer Society,2007[M/OL].Available at:http://www.cancer.org/acs/groups/content/@nho/documents/document/globalfactsandfigures2007rev2p.pdf
[2] Hennessy BT,Coleman RL,Markman M.Ovarian cancer[J].Lancet,2009,374:1371-1382.
[3] Pujade-Lauraine E,Wagner U,Aavall-Lundqvist E,et al.Pegylated liposomal doxorubicin and carboplatin compared with paclitaxel and carboplatin for patients with platinumsensitive ovarian cancer in late relapse[J].J Clin Oncol,2010,28:3323-3329.
[4] Corona G,Giannini F,Fabris M,et al.Role of folate receptor and reduced folate carrier in the transport of 5-methyltetrahydrofolic acid in human ovarian carcinoma cells[J].Int J Cancer,1998,75:125-133.
[5] Naumann RW,Coleman RL.Management strategies for recurrent platinum-resistant ovarian cancer[J].Drugs,2011,30:71:1397-1412.
[6] Hughes A,Calvert P,Azzabi A,et al.Phase I clinical and pharmacokinetic study of pemetrexed and carboplatin in patients with malignant pleural mesothelioma[J].J Clin Oncol,2002,20:3533-3544.
[7] Sehouli J,Camara O,Mahner S,et al.A phase-I trial of pemetrexed plus carboplatin in recurrent ovarian cancer[J].Cancer Chemother Pharmacol,2010,66:861-868.
[8] Therasse P,Eisenhauer EA,Verweij J.RECIST revisited:A review of validation studies on tumour assessment[J].Eur J Cancer,2006,42:1031-1039.
[9] 孙燕 主编 .内科肿瘤学[M].北京:人民卫生出版社,2003:388-390.
[10] Matulonis UA,Horowitz NS,Campos SM,et al.Phase II study of carboplatin and pemetrexed for the treatment of platinum-sensitive recurrent ovarian cancer[J].J Clin Oncol,2008,26:5761-5766.
