离子对氧化铁纳米颗粒水中聚集作用的影响
2014-05-11蒋丹烈胡霞林尹大强
蒋丹烈,胡霞林,王 锐,尹大强
(同济大学环境科学与工程学院,长江水环境教育部重点实验室,上海200092)
离子对氧化铁纳米颗粒水中聚集作用的影响
蒋丹烈,胡霞林,王 锐,尹大强*
(同济大学环境科学与工程学院,长江水环境教育部重点实验室,上海200092)
研究了不同电解质(NaCl、CaCl2、KCl、K2SO4和 K2CrO4)对氧化铁纳米颗粒(Fe2O3NP)聚集作用的影响,并用聚集效率来衡量聚集作用变化,用DLVO理论对各因素的影响进行解释.实验表明:浓度和价态的升高会显著增强NP的聚集作用;阴离子对NP聚集作用的影响强于阳离子(以KCl为对照,K2SO4引起了比CaCl2更显著的变化);K2CrO4的影响显著大于其他离子(0.5mmol/L的K2CrO4即可引起剧烈的聚集).通过DLVO理论发现:离子在较低浓度增长或价态的上升,会同时降低ζ电位和双电层厚度以促进聚集作用;阴离子和K2CrO4较阳离子,会更显著地降低ζ电位,从而加速聚集作用;浓度在较高区间变化时ζ电位相对稳定,此时双电层的压缩是促进聚集作用的主要原因.
纳米颗粒;离子;聚集作用;DLVO理论
氧化铁纳米颗粒(Fe2O3NP)由于具有较好的吸附性和流动性,可用于水处理中处理重金属[1]和有机物污染物[2];由于其催化能力、光敏、具有磁性等特点,在化工、生化和医疗之中也有广泛的应用[3-4].已有研究表明氧化铁、磁铁等铁的NP对人体和鱼体、藻类都会产生毒害作用[5-7].但要评价NP的风险还需要评估NP进入环境的量和 NP在环境中的迁移能力这两个指标,因此需要明确NP在水处理应用以及在水环境中的行为和归趋[8].与游离态污染物(如重金属、有机污染物等)不同,NP在水中以胶体形式存在,会发生聚集作用,形成团状或链状的聚集体.在实际应用中,聚集作用可能会影响到NP的使用效果,而且决定NP是否容易从处理设施或修复的区域中进入到其他水体[9].另外,在风险评估中,聚集作用的强弱决定了NP的迁移距离和被生物摄取的可能性,影响NP的风险大小[10].因此,研究NP的聚集作用具有重要意义.
在环境中影响聚集作用的因素很多,水中电解质是研究者最为关注的因素之一[11].一方面, NP聚集作用的改变往往取决于电解质对 ζ电位的影响.Keller等[12]研究发现,由于盐度的巨大差别,导致几种金属氧化物NP在海水和淡水中分别呈现急剧沉降和不易沉降的两种环境行为,他们认为是 ζ电位的不同所导致的.Thio等[13]也指出随着离子浓度的升高,AgNP的聚集作用会不断增强,且不同的离子会产生不同程度的影响,他们也认为是因为ζ电位的变化导致了聚集作用的变化.而另一方面,也有研究不仅仅考虑 ζ电位,而是利用 Derjaguin-Landau-Verwey-Overbeek理论(DLVO理论)计算颗粒之间的净势能判断聚集作用的强弱[14].通过DLVO理论的计算,研究者分别解释了盐度对Fe2O3NP和TiO2NP聚集作用的影响[15-16].但是,以往的研究往往针对离子的某个指标的影响,因此在解释离子对 NP聚集作用的影响时原理的选取并不严谨.因此,到底是直接用 ζ电位进行判定,还是有其他重要的指标,有待应用DLVO理论进行更深入的分析.
为研究离子对NP聚集作用的影响(包括浓度、价态和电性三个因素),本研究以氧化铁NP为模式NP,选择了常见的5种离子进行试验,利用聚集效率(α,即实际聚集速率与最快聚集速率之比)来表征NP的聚集作用,分别基于DLVO理论(针对圆柱体颗粒)对聚集行为的变化进行了解释,为NP的实际应用和水环境风险评价提供理论基础.
1 材料与方法
1.1 纳米材料的表征
氧化铁针状颗粒(Sigma Aldrich Co.,美国)用 X射线衍射仪(XRD,D8Advance X,Bruker optics Inc.,德国)对颗粒的成分进行了表征,采用透射电子显微镜(TEM,JEM-2010,JEOL Ltd.,Tokyo,日本)对颗粒的形态和粒径进行了观测.悬浮液浓度用火焰原子吸收法(FAAS, AA400,PerkinElmer Corp.,美国)测定.用 zeta电位仪(Zetasizer Nano ZS90,Malvern Instruments Ltd.,英国)测定了ζ电位随 pH 值的变化.用量子扰动超导探测器(superconducting quantum interference device, SQUID, MPMS SQUID VSM, Quantum Design Inc.,美国)测定磁性.
1.2 聚集作用的测定
为研究离子价态和类型的影响,选择 NaCl和 CaCl2作为阳离子试剂,选择 KCl、K2SO4和K2CrO4作为阴离子试剂.Na+、Ca2+、K+、Cl-和SO42-是自然水体中常见的阴阳离子,CrO42-则代表常见的重金属污染物.为研究离子浓度的影响,每个离子测试了多个浓度梯度.NP悬浮液(50mgFe/L)分别加入各种电解质,用超声仪分散至溶液清澈透明,pH值通过 HCl和 NaOH (10mmol/L)控制在 7.1±0.4(自然水体正常的 pH值范围),利用DLS(Zetasizer Nano ZS90,Malvern Instruments Ltd.,英国)对颗粒的聚集作用进行测定,测试温度 25℃.由于各个离子对聚集作用的影响能力大小不同,通过预实验确定了各离子浓度区间(即从0到临界凝聚浓度, CCC,表1).用准一级反应动力学方程计算聚集体粒径增长的速率,用式(1)计算颗粒在各个状况下的 α[17].式(1)中:kij为测试状况下聚集体粒径增长的速率;kji(fast)为聚集最快的状况下(当离子浓度很高的时候,本研究中设为 1mol/L)聚集体粒径增长的速率.为了解释颗粒在不同状况下不同的聚集作用,用zeta电位仪测定了各个离子浓度对颗粒ζ电位的影响(样品同DLS测试,温度25℃).
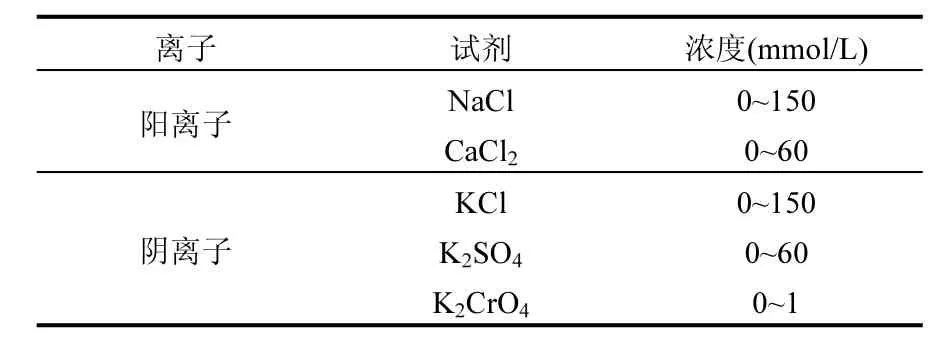
表1 各离子测试的浓度区间Table 1 Concentration interval of the tested electrolytes

1.3 颗粒间作用力的计算
为进一步解释不同聚集作用的原因,利用DLVO理论计算颗粒间的势能大小,即范德华力势能(Uvdw)和静电斥力势能(Uel)之和(所用Fe2O3NP磁性很小,无需考虑磁力势能).本文Fe2O3NP为针状颗粒,因此选用针对圆柱体颗粒的计算方法:Uvdw通过式(1)和式(2)计算得出,Uel通过式(3)~式(5)计算得出[18].若计算结果为正,说明颗粒间净势能为斥力势能;反之,则为引力势能.

式中:A为哈梅克常数,通过式(3)计算得出;A1和A2分别为颗粒和溶剂的哈梅克常数,氧化铁和水的A值分别为10-19N·m和4.4×10-20N·m;a1和a2为颗粒的半径,m;H为颗粒表面之间的距离,m. κ为德拜常数的倒数,m-1,当加入 1-1电解质时(NaCl和KCl)通过式(5)得出,当加入2-1电解质时(CaCl2、K2SO4和K2CrO4)通过式(6)得出;εr为水的相对介电常数;ε0为真空介电常数;ζ为颗粒的ζ电位值,mV. M为电解质浓度,mol/L;NA为阿伏伽德罗常数;e为电子电荷;kb为伯尔兹曼常数;T为绝对温度,K.
2 结果与讨论
2.1 纳米颗粒的表征结果
通过XRD和TEM分析晶体结构和颗粒形态(图 1),可见所用氧化铁为针状颗粒,半径为(20±3)nm,长(204±9)nm.通过ζ电位测试,发现pH值的测试区间内(3~9)颗粒都带正电.饱和磁化强度为2kA/m,基本上没有磁性.
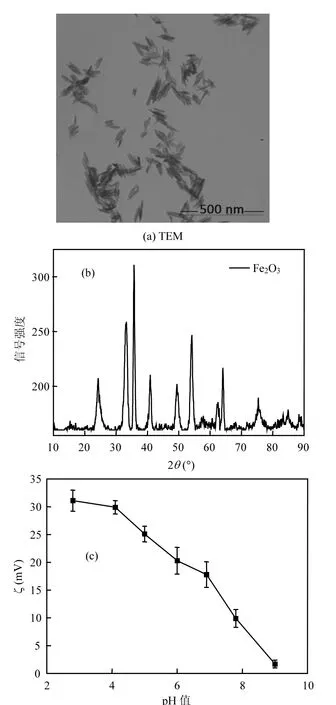
图1 TEM、XRD图、zeta电位随pH值的变化Fig.1 TEM, XRD, ζ as a function of pH
2.2 离子对颗粒聚集作用的影响
由图2可见,α的变化遵循规律:悬浮液电解质浓度越高颗粒越容易聚集,当到达CCC后NP聚集作用保持最大;悬浮液中离子价态越高颗粒越容易聚集,主要体现在CCC随着价态的升高显著减小;阴离子价态的升高对 NP聚集作用的影响比阳离子要强,如 SO42-(K2SO4)的 CCC (30mmol/L)比 Ca2+(CaCl2)小(50mmol/L);尽管CrO42-(K2CrO4)的价态电性和SO42-(K2SO4)一样,但CrO42-在非常低的浓度下(CCC=0.5mmol/L)就会急剧加快颗粒的聚集作用.这和前人的研究所总结的规律一致,如离子浓度和价态的变化会对CeO2和TiO2NP产生相似的影响[19-20].
2.3 离子对ζ电位的影响
为了解释聚集效率的变化,测试了电解质浓度对颗粒ζ电位的影响.从图3可看出,随着5种电解质浓度的上升,ζ电位在最初都会有所下降;但当浓度达到一定大小后,ζ电位会趋于稳定,不会发生显著的变化.其次,较低价离子(NaCl和 KCl)而言,高价离子(CaCl2和 K2SO4)的加入会更显著降低颗粒的 ζ电位.但对于高价阳离子,当离子浓度较高时价态的影响会逐渐消失(NaCl和 CaCl2的浓度大于40mmol/L之后,ζ电位基本在同一范围波动);而阴离子的价态则始终会产生比较明显的影响(K2SO4组的ζ电位始终低于10mV,而KCl组的ζ电位则维持在15~20mV之间波动).这是因为在试验条件下(pH值为7.1±0.4)氧化铁NP带正电(图 1),高价的阴离子相比高价的阳离子对颗粒表面电荷影响更大.此外,K2CrO4对ζ电位产生了显著的降低(0.1mmol/L K2CrO4使得 ζ电位接近0mV),可能是颗粒对K2CrO4有特异吸附.

图2 α随电解质浓度的变化Fig.2 α as a function of electrolytes concentration
图2和图3对比发现ζ电位并不能很好地解释离子浓度和价态的变化对颗粒聚集作用的影响.同种电解质不同浓度间的比较:CaCl2浓度为20mmol/L和 40mmol/L时,ζ电位分别为(17.5± 1.7)mV和(16.9±0.4)mV,几乎没有差别,无法造成聚集作用上如此巨大的差异(图 2).价态不同的电解质之间的比较:40mmol/L NaCl和 40mmol/L CaCl2的 ζ电位分别为(17.9±1.3)mV 和(16.9± 0.4)mV,没有很大差别;但是40mmol/L NaCl下NP并不容易聚集,40mmol/L CaCl2却使NP的聚集作用达到最大.因此,还有其他因素需要考虑.
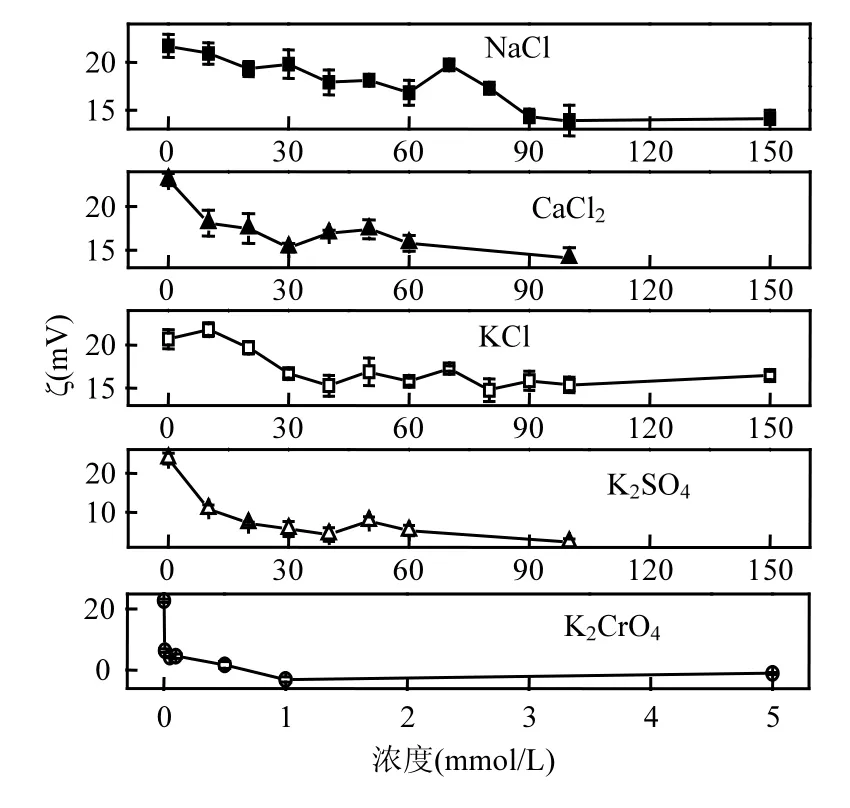
图3 ζ电位随离子浓度的变化Fig.3 ζ as a function of electrolytes concentration
2.4 DLVO理论计算结果
根据DLVO理论计算结果(图4)可见,电解质浓度的升高会导致颗粒间斥力势能的降低,离子价态的升高也会对颗粒间的斥力势能产生影响(20mmol/L K2SO4已经使颗粒间的斥力势能基本消失,而20mmol/L CaCl2组的颗粒间还存在能量壁垒).对比图 2,可以发现当斥力势能存在时,颗粒就能保持相对稳定不发生剧烈的聚集(如40mmol/L NaCl/KCl、 20mmol/L CaCl2、0.01mmol/L K2CrO4);当斥力势能消失时颗粒的聚集作用就进入最快阶段(如 40mmol/L CaCl2/ K2SO4,0.1mmol/L K2CrO4).因此可见DLVO理论可以比较准确的解释和预测离子对NP聚集作用的影响,特别是2.3小节中所指出的ζ电位不能很好解释的情况.

图4 颗粒间势能随颗粒间距离的变化Fig.4 Change of UTaccording to the distance of interacting NPs
2.5 基于DLVO理论的机理解释
根据DLVO理论可以发现, Fe2O3NP的静电斥力势能主要取决于ζ电位和κ值[式(4)],综合分析两个因素的变化才能解释实验中的各类现象.根据Stern理论,离子浓度、价态、电性以及颗粒是否会对离子产生特殊吸附都会影响ζ电位[21].κ值的倒数代表了颗粒外双电层的厚度,双电层越厚则颗粒的静电斥力势能就越大,颗粒就越不易聚集[22].与ζ电位类似,κ值同样取决于电解质的浓度以及离子的价态.大部分情况下离子对 ζ电位和 κ值都会产生较大程度的影响.如离子浓度在较低区间变化时(如 KCl浓度从 0增加到40mmol/L时)以及离子价态升高时(如 NaCl和CaCl2间比较),ζ电位明显的下降了(2.3节),而且κ值也会上升(即双电层被压缩).此时ζ电位和κ值都会对聚集作用产生不可忽视的影响,因而要算出颗粒间的势能变化以综合考虑两者的影响.
有时候ζ电位变化非常剧烈但κ值没有受到显著的影响,则 ζ电位可作为主要影响因素来判断NP的胶体稳定性.如较阳离子而言,阴离子价态的升高对ζ电位的影响更显著(2.3小节),但是阴阳离子的价态一样、浓度区间相近(见表1),对κ值影响相近;又如K2CrO4较K2SO4会明显的降低ζ电位(2.3小节),但是试验所设的K2CrO4浓度很低(0~1mmol/L),因而对 κ值影响很小.然而,有些情况下(如 NaCl浓度上升到一定程度后)ζ电位变化不大,此时κ值就成为了主要的影响因素.
2.6 环境意义
当水中有一种离子的浓度超过NP在该pH值下的CCC或某几种离子的浓度接近了CCC,则NP在这一水体系中有可能比较容易沉降.当然,其他因素也会影响到NP的聚集作用,如表面活性剂的存在可以降低聚集作用[9],pH值能显著地改变NP的ζ电位从而使NP的聚集作用产生变化[20].这些因素对NP聚集作用的影响还需要进一步的研究.
在水处理过程中往往需要NP能很好的分散以得到最佳的处理效果[23],在使用完 NP之后需要尽量将其回收以降低对环境的影响.通过控制水中离子浓度可以做到这一点.另外,如果水中存在如 CrO42-这样会对 Fe2O3NP的聚集行为产生显著影响的离子,那么 NP在水中可能很难保持很好的分散,此时Fe2O3NP就很易沉降而不易进入自然水体.Zhang.等[24]的研究测试了影响去除水中6种金属氧化物NP的因素后,发现电解质浓度的变化能使得 NP产生显著的沉降,去除率为80%;而加入Al离子则可以完全去除NP(>95%).
通过环境因素预测NP在环境中的聚集作用,有助于预测NP在环境中的迁移能力和被生物摄取的可能性,从而预测 NP的环境风险,降低 NP环境风险评估中的不确定性[10].如在水环境中,将水中离子成分、盐度硬度等指标跟NP的CCC进行比较,就可以判断 NP在该水体系之下是否会聚集沉降;通过NP的离子浓度-α曲线(图2),可以预测 NP在某离子强度之下的胶体稳定性.Mylon等[17]测试了不同自然水体对 Fe2O3NP聚集作用的影响发现离子强度大小是重要的因素之一,指出当水中的Na+、Ca+、Mg2+和K+浓度分别达到220mmol/L、26mmol/L、5mmol/L和5mmol/L时,NP将非常容易聚集.
3 结论
3.1 离子的浓度和价态的上升都会加快聚集作用.由于 Fe2O3NP表面带正电,所以相比阳离子,阴离子价态的升高对NP的聚集作用产生的影响更强烈.CrO42-虽然是负二价,却对Fe2O3NP的聚集作用产生比测试的其他离子都要显著的促进作用.
3.2 通过DLVO理论计算颗粒间的势能变化可以较好地解释本研究中离子产生的各种影响,并可以确定离子的各类变化主要会改变 Fe2O3NP的 ζ电位和双电层这两个指标,进而影响了Fe2O3NP的聚集作用.
[1] Chen Y-H, Li F-A. Kinetic study on removal of copper(II) using goethite and hematite nano-photocatalysts [J]. Journal of Colloid and Interface Science, 2010.347(2):277-281.
[2] 司雄元,司友斌,陈 涛,等.纳米Fe, Si 体系对3, 3’, 4, 4’-四氯联苯的脱氯降解 [J]. 中国环境科学, 2011,31(5):423-430.
[3] 刘双枝,王天喜,成庆堂.氧化铁的制备及光催化降解水溶性活性染料的研究 [J]. 西部大开发: 中旬刊, 2009,(11):84-84.
[4] 陈明义,田 京.超顺磁性氧化铁纳米颗粒在肿瘤靶向治疗中的应用进展 [J]. 天津医药, 2013,41(6):618-620.
[5] Chen P J, Tan S W, Wu W L. Stabilization or Oxidation of Nanoscale Zerovalent Iron at Environmentally Relevant Exposure Changes Bioavailability and Toxicity in Medaka Fish [J]. Environmental Science and Technology, 2012,46(15):8431-8439.
[6] 刘红云,白 伟,张智勇,等.纳米氧化物对斑马鱼胚胎孵化率的影响 [J]. 中国环境科学, 2009,29(1):53-57.
[7] Zhu M T, Wang B, Wang Y, et al. Endothelial dysfunction and inflammation induced by iron oxide nanoparticle exposure: Risk factors for early atherosclerosis [J]. Toxicology Letters, 2011, 203(2):162-171.
[8] Wiesner M R, Lowry G V, Jones K L, et al. Decreasing uncertainties in assessing environmental exposure, risk, and ecological implications of nanomaterials [J]. Environmental Science and Technology, 2009,43(17):6458-6462.
[9] Saleh N, Kim H J, Phenrat T, et al. Ionic strength and composition affect the mobility of surface-modified Fe-0nanoparticles in water-saturated sand columns [J]. Environmental Science and Technology, 2008,42(9):3349-3355.
[10] Hotze E M, Phenrat T, Lowry G V. Nanoparticle Aggregation: Challenges to understanding transport and reactivity in the environment [J]. Journal of Environmental Quality, 2010,39(6): 1909-1924.
[11] Klaine S J, Alvarez P J J, Batley G E, et al. Nanomaterials in the environment: Behavior, fate, bioavailability, and effects [J]. Environmental Toxicology and Chemistry, 2008,27(9):1825-1851.
[12] Keller A A, Wang H T, Zhou D X, et al. Stability and aggregation of metal oxide nanoparticles in natural aqueous matrices [J]. Environmental Science and Technology, 2010,44(6):1962-1967.
[13] Thio B J R, Montes M O, Mahmoud M A, et al. Mobility of capped silver nanoparticles under unvironmentally relevant conditions [J]. Environmental Science and Technology, 2011, 46(13):6985–6991.
[14] Petosa A R, Jaisi D P, Quevedo I R, et al. Aggregation and deposition of engineered nanomaterials in aquatic environments: Role of physicochemical interactions [J]. Environmental Science and Technology, 2010,44(17):6532-6549.
[15] Baalousha M. Aggregation and disaggregation of iron oxide nanoparticles: Influence of particle concentration, pH and natural organic matter [J]. Science of the Total Environment, 2009, 407(6):2093-2101.
[16] 吴其圣,杨 琛,胡秀敏,等.环境因素对纳米二氧化钛颗粒在水体中沉降性能的影响 [J]. 环境科学学报, 2012,7:1596-1603.
[17] Mylon S E, Chen K L, Elimelech M. Influence of natural organic matter and ionic composition on the kinetics and structure of hematite colloid aggregation: Implications to iron depletion in estuaries [J]. Langmuir, 2004.20(21):9000-9006.
[18] Ohshima H. Electrical phenomena at interfaces and biointerfaces: Fundamentals and applications in nano-, bio-, and environmental sciences [M]. Hoboken, New Jersey: Wiley, 2012.
[19] Li K, Zhang W, Huang Y, et al. Aggregation kinetics of CeO2nanoparticles in KCl and CaCl2solutions: Measurements and modeling [J]. Journal of Nanoparticle Research, 2011,13(12):1-9.
[20] French R A, Jacobson A R, Kim B, et al. Influence of ionic strength, pH, and cation valence on aggregation kinetics of titanium dioxide nanoparticles [J]. Environmental Science and Technology, 2009,43(5):1354-1359.
[21] Vincent B, Bijsterbosch B H, Lyklema J. Competitive adsorption of ions and neutral molecules in the stern layer on silver iodide and its effect on colloid stability [J]. Journal of Colloid and Interface Science, 1971,37(1):171-178.
[22] Cosgrove T. Colloid science: principles, methods and applications [M]. United Kingdom: John Wiley & Sons Ltd, 2010.
[23] Sun Y-P, Li X-Q, Zhang W-X, et al. A method for the preparation of stable dispersion of zero-valent iron nanoparticles [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2007,308(1-3):60-66.
[24] Zhang Y, Chen Y, Westerhoff P, et al. Stability of commercial metal oxide nanoparticles in water [J]. Water Research, 2008, 42(8/9):2204-2212.
Influence of ions on the aggregation behavior of hematite nanoparticle in aqueous system.
JIANG Dan-lie, HU Xia-lin, WANG Rui, YIN Da-qiang*
(Key Laboratory of Yangtze River Water Environment, Ministry of Education, State Key Laboratory of Pollution Control and Resources Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China). China Environmental Science, 2014,34(10):2545~2550
Influences of electrolytes (NaCl, CaCl2, KCl, K2SO4and K2CrO4) on the hematite nanoparticle (Fe2O3NP) aggregation were investigated. The attachment efficiency (α) was applied to assess the alternations of aggregation behavior, and the Derjaguin-Landau-Verwey-Overbeek (DLVO) theory was utilized to elucidate the mechanisms underlying the observed changes. Results clearly showed that the aggregation behaviors were enhanced by electrolytes of higher valence and/or at higher concentration; anions exhibited greater effects on the aggregation of NPs than cations (e.g., K2SO4had induced more significant aggregation than CaCl2as comparing to KCl); K2CrO4could enhance the aggregation more significantly than other electrolytes (0.5 mmol/L of K2CrO4could induce great aggregation). Based on the DLVO theory, we suggested that increasing the concentration (within a relatively low range) and valence of electrolytes would promote the aggregation by decreasing the zeta potential (ζ) and the Debye length simultaneously; the greater impacts of anions and K2CrO4on aggregation of NPs comparing to the cations were mainly induced by the dramaticall decrease of ζ; the ζ would remain relatively steady within relatively high concentration ranges of electrolytes, whereas the reduction of Debye length would become the key factor in promoting aggregation behaviors.
t:nanoparticle;ions;aggregation;DLVO theory
X703.5
:A
:1000-6923(2014)10-2545-06
蒋丹烈(1988-),男,江西南昌人,同济大学博士研究生,主要从事纳米材料环境风险研究.发表论文3篇.
2013-12-21
国家自然科学基金资助项目(21007047);中央高校科研专项资金(0400219155);国际科技合作计划(2010DFA91800)
* 责任作者, 教授, yindq@tongji.edu.cn
