麻栎不同种源的表型性状变异分析
2014-05-11张元燕虞木奎方炎明
张元燕,虞木奎,方炎明,①
(1.南京林业大学森林资源与环境学院,江苏南京210037;2.中国林业科学研究院亚热带林业研究所,浙江富阳311400)
麻栎不同种源的表型性状变异分析
张元燕1,虞木奎2,方炎明1,①
(1.南京林业大学森林资源与环境学院,江苏南京210037;2.中国林业科学研究院亚热带林业研究所,浙江富阳311400)
以来源于广西、广东、贵州、湖南、浙江、安徽、江苏、湖北、四川、陕西、河南和山东的28个麻栎(Quercus acutissima Linn.)地理种源为研究对象,分析了6个表型性状(包括叶长、叶宽、叶柄长和叶长宽比4个叶片性状及株高和地径2个生长性状)的变异状况;研究了种源间及种源内各性状的变异系数(CV)和相对极差(R°)及种源间各叶片性状的表型分化系数(Vst);并进行了各性状的相关性分析及主成分分析;此外,还对28个种源进行了聚类分析。结果表明:各种源间6个表型性状均有极显著差异(P<0.01);而种源内仅叶宽和叶长分别具有极显著和显著(P<0.05)差异。种源间4个叶片性状的Vst平均值为23.98%,其中叶宽的Vst值最大(42.39%)。在6个表型性状中,叶柄长的CV平均值最大(33.60%)、地径的CV平均值最小(16.25%);在不同种源中,陕西汉中种源各性状的CV平均值最小(14.39%),而江苏句容、四川万源和山东沂水种源各性状的CV平均值均超过30%。各种源间表型性状的R°值差异明显,其中,四川万源种源的R°值最大(60.99%),湖南新宁和陕西汉中种源的R°值较小(30%以下);而6个性状间R°值差别不大,为34.93%~44.98%,表明麻栎种源间的极端差异程度有明显不同,而表型性状间的极端差异程度差异不大。4个叶片性状中,仅叶宽与叶长宽比呈极显著负相关,其他性状间均呈极显著正相关;叶片性状与生长性状间均呈负相关,而株高与地径则呈极显著正相关。麻栎种源表型性状变异的第1和第2主成分的贡献率分别为43.663%和27.695%,第1主成分中叶性状变异占主导地位,而第2主成分则主要反映生长性状的变异。通过聚类分析可将28个种源分为2大类,分别包含22和6个种源,但聚类分析结果与其地理分布没有明显相关性。研究结果显示:麻栎种源具有丰富的遗传变异,且其表型性状变异主要存在于种源内。
麻栎;地理种源;表型性状;变异系数;相对极差;聚类分析
麻栎(Quercus acutissima Linn.)为高大乔木,隶属于壳斗科(Fagaceae)栎属(Quercus Linn.),广泛分布于东亚地区,主产中国;从中国东北部的辽宁到西南部的云南均有分布,分布海拔为100~2 200 m[1],是中国温带落叶阔叶林以及亚热带落叶阔叶林的优势植物。麻栎分布范围广,分布区内生态环境复杂,由此形成了不同的生态类型,种群间遗传差异明显[2]。麻栎是一种良好的硬质木材树种,具有很高的经济价值;由于其木材可用于烧制优良白炭,近年来则被经营作为一种能源树种[3]。有关麻栎的研究涉及多个方面,包括种源收集、种子地理变异、幼苗扦插繁殖以及组织培养、幼苗地理变异和抗逆性研究等[4-10]。
表型多样性研究是物种多样性研究的重要组成部分,具有观察直观、实验操作简单等优点,是研究遗传多样性最为直接有效的方法之一[11];而叶片性状、株高和地径等指标是表型多样性研究中常用的指标[12]。种源实验通常可用于检测植物对不同生态环境响应的遗传变异,通过种源实验可以筛选出适合本地生境的优良种源[13-14];而不同种源表型地理变异的研究,可以为造林提供合格苗木,同时也是了解不同种源苗期遗传变异规律的重要手段。
为了解麻栎种源的地理变异规律,作者以4个叶片性状(包括叶长、叶宽、叶柄长和叶长宽比)和2个生长性状(即株高和地径)为观测指标,采用巢式方差分析、表型分化系数和相对极差等方法分析了麻栎不同地理种源间以及种源内的表型性状变异幅度,并对供试种源进行聚类分析,以期为麻栎种源遗传多样性的研究以及优良种源的筛选提供基础实验数据。
1 研究地自然概况和研究方法
1.1 研究地自然概况
研究地点位于安徽省滁州市南谯区红琊山林场,地理坐标为东经118°04′、北纬32°10′,属华中湿润带向华北半干旱温带的过渡地区;年平均气温15.2℃,年降水量1 041.6 mm;地带性植被为落叶阔叶林;海拔100~300 m;土壤多为黄棕壤,土层较薄。
供试28个麻栎种源的种子分别引自12个省区,各种源的产地及地理坐标见表1。于2008年春营造麻栎种源试验林,供试幼苗为1年生种子实生苗。采用完全随机区组设计(6×6),株距2 m、行距3 m,试验区四周设有2行保护行。
1.2 表型性状测定方法
于2010年9月进行表型性状测定,每个种源选取样株10株;在每一样株上随机选取5~8片健康、无病虫害且完整的叶片,用直尺分别测量叶长、叶宽和叶柄长;用测杆和皮尺分别测量各样株的株高;用游标卡尺测量各样株的地径。
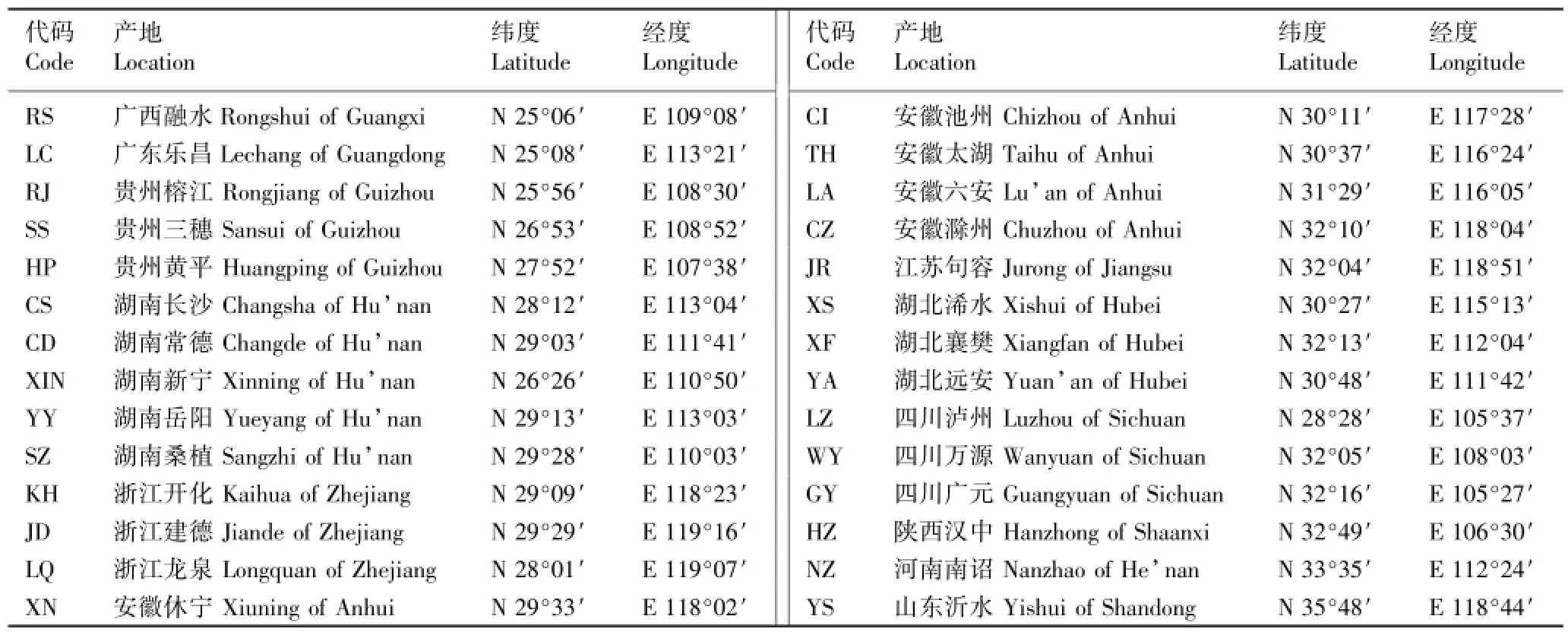
表1 28个麻栎种源的产地和地理坐标Table 1 Location and geographic coordinate of 28 provenances of Quercus acutissima Linn.
1.3 统计分析方法及参数计算
采用二因素巢式设计进行各表型性状的方差分析。用变异系数(CV,coefficient of variation)表示表型性状的离散程度,用表型分化系数(Vst,phenotypic differentiation coefficient)表示群体间的表型变异占总遗传变异的百分比,用相对极差(R°)表示极端差异程度。计算公式分别为:CV=(δ/X¯)×100%,其中,δ为标准差、X¯为群体平均值;Vst=〔σ2t/s/(σ2t/s+σ2s)〕× 100%,其中,σ2t/s为群体间的方差分量、σ2s为群体内的方差分量[15];R°=R′/R,其中,R′为群体内极差、R为性状总极差。
利用SPSS 19.0统计分析软件、采用Pearson相关分析方法对28个麻栎种源6个表型性状进行双变量相关性分析,并根据种源间各性状的欧氏距离进行聚类分析。
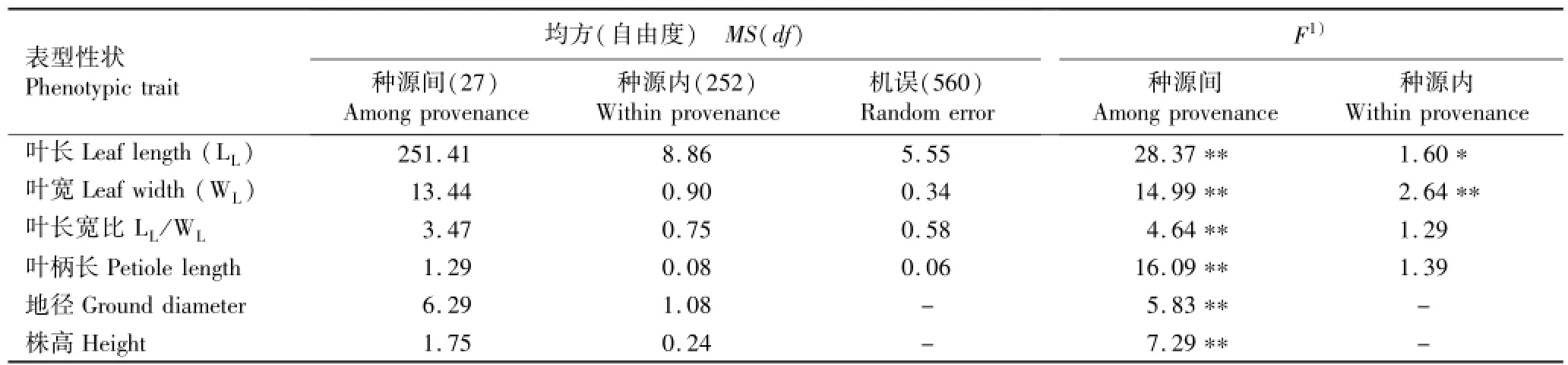
表2 麻栎种源间和种源内表型性状的方差分析结果Table 2 Variance analysis result of phenotypic traits among and within provenances of Quercus acutissima Linn.
2 结果和分析
2.1 麻栎种源间及种源内的表型分化分析
供试麻栎种源间及种源内表型性状的方差分析结果见表2;而4个叶片表型性状在种源内和种源间的方差分量及在种源间的表型分化系数见表3。
由表2可以看出:麻栎的叶长、叶宽、叶长宽比、叶柄长、株高和地径在各种源间均有极显著差异(P<0.01);而在种源内,仅叶宽和叶长2个性状分别有极显著和显著差异(P<0.05),叶长宽比和叶柄长则无显著差异。
由表3可见:在4个叶片性状的总方差分量中,种源间的方差分量占3.33%,种源内的方差分量占9.63%,而机误则占87.04%。从种源间单一性状的变异幅度看,种源间叶长宽比的变异最小,方差分量百分率仅为0.78%;而叶长的变异最大,方差分量百分率为5.54%。从种源内单一性状的变异幅度看,叶长的方差分量百分率最大、其次为叶柄长、第3为叶长宽比,而叶宽的方差分量百分率最小。种源间4个叶片性状的表型分化系数(Vst)为7.58%~42.39%,其中叶长宽比的Vst最小、叶宽的Vst最大;Vst的平均值为23.98%,表明种源间4个性状的变异仅占总变异的23.98%。因此,麻栎种源的表型性状变异主要存在于种源内。
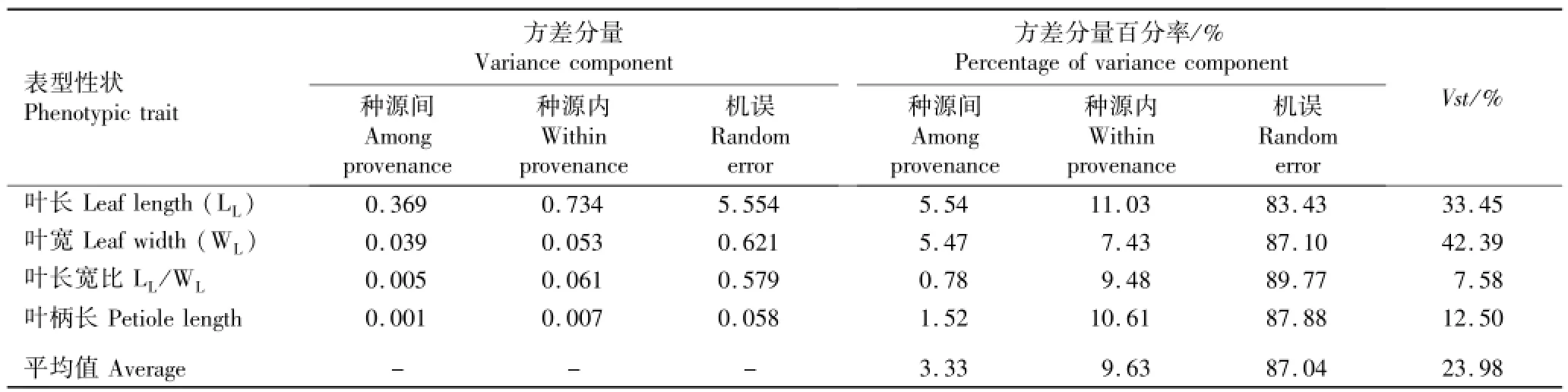
表3 麻栎叶片表型性状在种源间和种源内的方差分量及在种源间的表型分化系数(Vst)Table 3 Variance components am ong and within provenances and phenotypic differentiation coefficient(Vst)am ong provenances of leaf phenotypic traits of Quercus acutissima Linn.
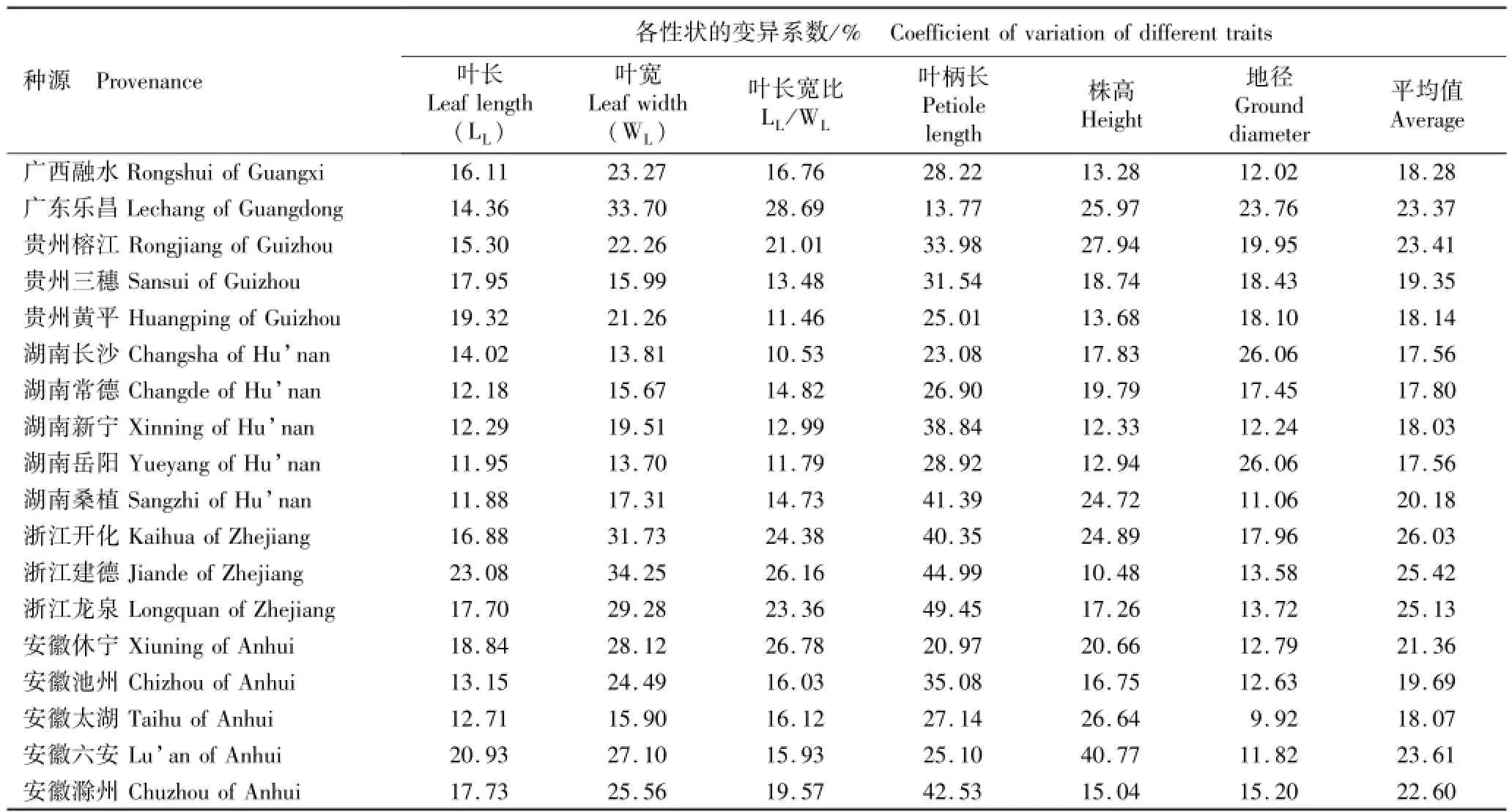
表4 28个麻栎种源表型性状的变异系数Table 4 Coefficient of variation of phenotypic traits of 28 provenances of Quercus acutissima Linn.
2.2 麻栎种源内表型性状的变异特征
供试28个麻栎种源6个表型性状的变异系数见表4;各表型性状的相对极差见表5。
由表4可见:4个叶片性状和2个生长性状的平均变异系数均有一定差异。在叶片性状方面,叶柄长的平均变异系数最大(33.60%),其后依次为叶宽(22.91%)、叶长宽比(19.14%)和叶长(18.56%)。不同种源同一性状的变异系数差异程度不同,叶长、叶宽、叶柄长、叶长宽比、株高和地径的变异系数分别为11.88%~31.65%、13.70%~34.25%、13.77%~
61.97%、10.33%~39.37%、10.48%~46.06%和7.52%~26.06%,说明不同麻栎种源的表型性状变异较大。在28个种源中,陕西汉中种源各表型性状的平均变异系数最小,仅为14.39%;而江苏句容、四川万源和山东沂水种源各表型性状的平均变异系数较大,均在30%以上。
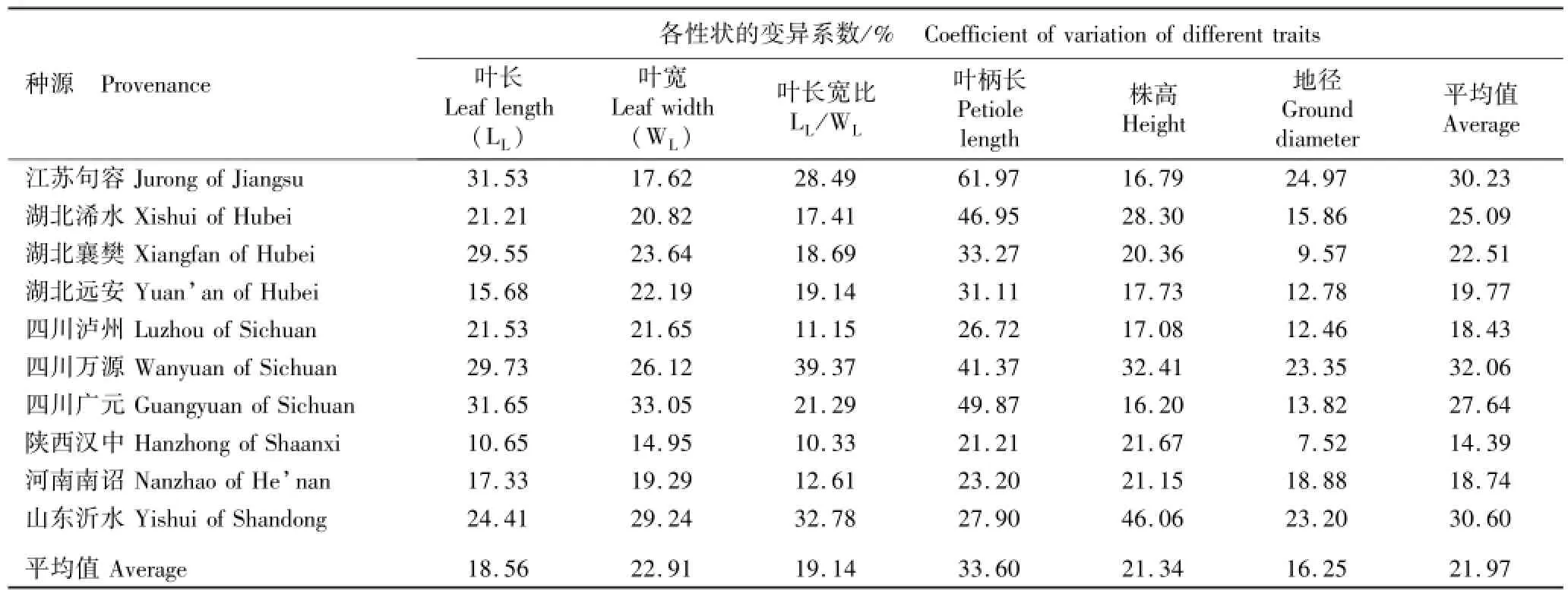
续表4 Table4(Continued)
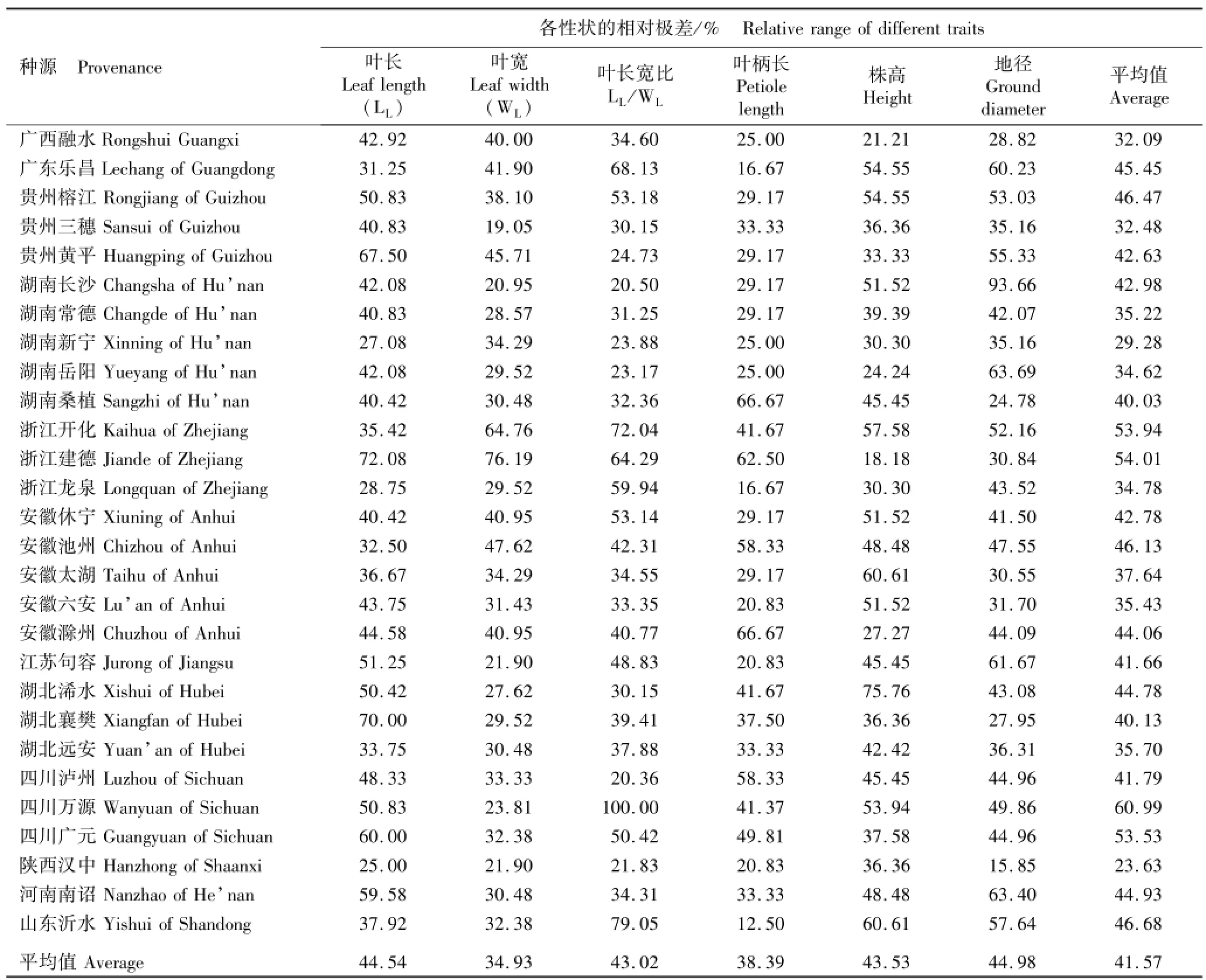
表5 28个麻栎种源表型性状的相对极差Table 5 Relative range of phenotypic traits of 28 provenances of Quercus acutissima Linn.
由表5可见:各种源6个性状的平均相对极差有明显差异,其中,四川万源种源的平均相对极差最大,达到60.99%;浙江开化和建德及四川广元3个种源的平均相对极差也在50%以上,分别为53.94%、54.01%和53.53%;湖南新宁和陕西汉中2个种源的平均相对极差较小,均在30%以下,分别为29.28%和23.63%;其余种源的平均相对极差在30%至50%之间。6个性状(叶长、叶宽、叶柄长、叶长宽比、株高和地径)的平均相对极差为34.93%~44.98%,差别不大;其中,叶宽的平均相对极差最小,而株高和地径的平均相对极差相近,分别为43.53%和44.98%。值得注意的是,四川万源种源叶柄长的相对极差达到100.00%,而浙江建德种源叶长和叶宽的相对极差均最大,湖南桑植种源叶长宽比相对极差最大(66.67%),湖北浠水和湖南长沙种源的株高和地径的相对极差最大(分别为75.76%和93.66%); 6个性状相对极差的最小值为25.00%(叶宽)至12.50%(叶长宽比),且出现的种源也各不相同。由于相对极差表示表型性状的极端差异程度,因而,供试28个麻栎种源间的极端差异程度明显不同,而6个表型性状间的极端差异程度则无明显差异。
2.3 麻栎种源各表型性状的相关性分析
供试麻栎种源6个表型性状的相关系数见表6。由表6可见:在4个叶片性状中,仅叶宽与叶长宽比呈极显著负相关,其他叶片性状两两间均呈极显著正相关;其中,叶长与叶宽的相关系数达到0.747。叶片性状与生长性状间均呈负相关,其中,叶长与株高和地径分别呈极显著负相关,叶宽与株高呈显著负相关;其他叶片性状与生长性状间也均呈负相关但相关性不显著;而株高与地径则呈极显著正相关。
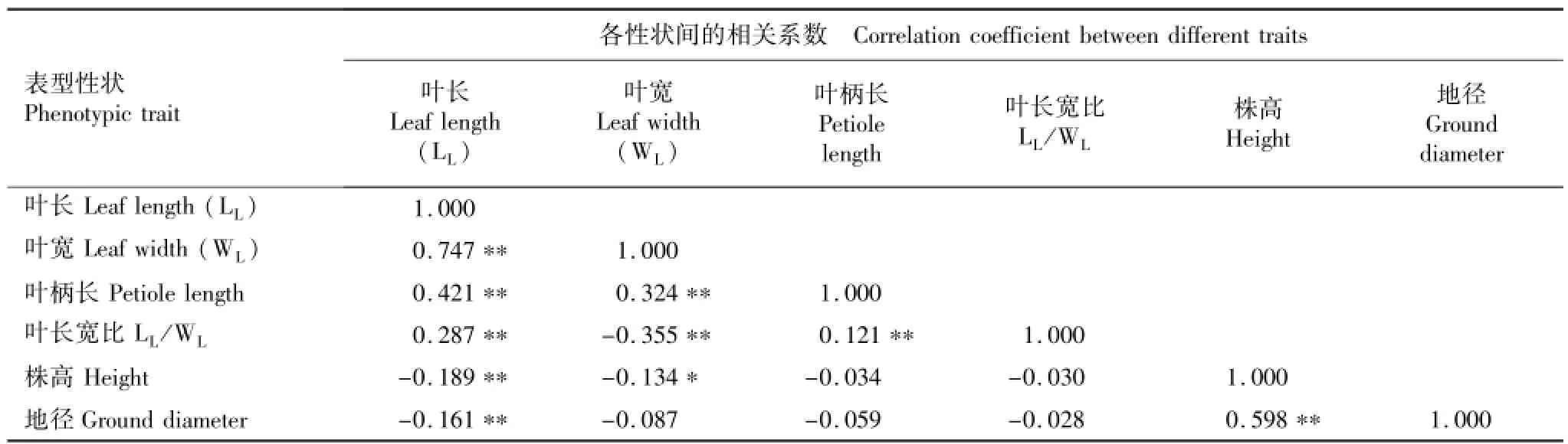
表6 麻栎种源表型性状间的相关系数1)Table 6 Correlation coefficient am ong phenotypic traits of Quercus acutissima Linn.provenances1)
2.4 供试28个麻栎种源的聚类分析结果
基于欧氏距离对28个麻栎种源进行聚类分析,结果见图1。28个麻栎种源可明显分为2大类:第1大类包括广西融水、贵州榕江、贵州三穗、贵州黄平、湖南长沙、湖南常德、湖南新宁、湖南岳阳、湖南桑植、浙江开化、浙江建德、安徽休宁、安徽池州、安徽太湖、安徽六安、安徽滁州、湖北浠水、湖北襄樊、湖北远安、四川泸州、陕西汉中和河南南诏22个种源;第2大类包括广东乐昌、浙江龙泉、江苏句容、四川万源、四川广元和山东沂水6个种源。
2.5 麻栎种源表型性状变异的主成分分析
供试麻栎种源表型性状变异的主成分分析结果见表7。结果显示:麻栎种源表型性状变异的第1和第2主成分的贡献率分别为43.663%和27.695%;在第1主成分中叶片性状占主导地位,其中叶长的贡献率占71.358%;在叶片性状中叶长的特征向量最大,达到0.912。在第2主成分中,株高与地径的贡献率都达到80%以上,第2主成分主要反映生长性状;其中,4个叶片性状中仅叶柄长的特征向量为正值,其他叶片性状的特征向量均为负值。
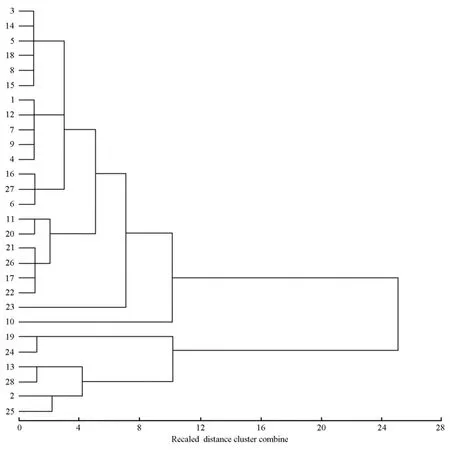
图1 基于表型性状变异的28个麻栎种源的聚类分析结果Fig.1 Cluster analysis result of 28 provenances of Quercus acutissima Linn.based on phenotypic trait variation
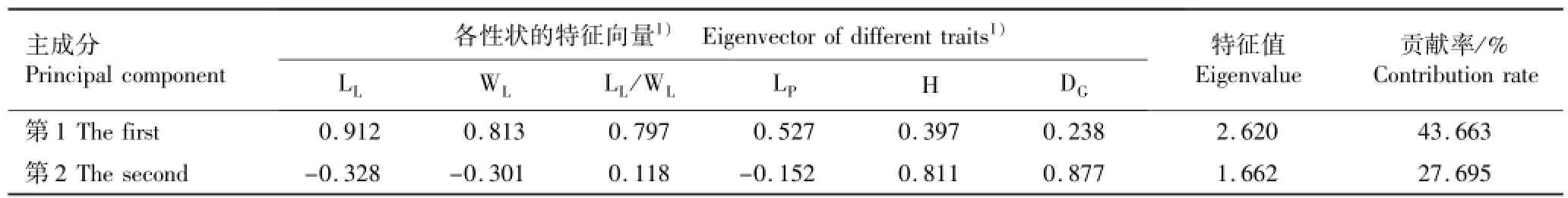
表7 麻栎种源表型性状变异的主成分分析结果Table 7 Result of principal component analysis of phenotypic trait variation of Quercus acutissima Linn.provenances
3 讨论和结论
3.1 麻栎种源的表型性状变异式样
根据巢式方差分析结果可知:麻栎种源间叶长、叶宽、叶长宽比、叶柄长、株高和地径6个性状的差异均达到极显著水平;而种源内叶宽的差异也达到极显著水平、叶长的差异则达到显著水平。从单一性状的变异系数看,叶长变异较小、而叶宽变异较大。可见,麻栎种源间的叶长较其他性状稳定,而叶宽变异较大,说明叶片长度的变异小于叶片宽度的变异。从生长性状来看,株高变异大于地径变异,而在所有性状中地径的变异系数也最小,说明在6个表型性状中地径的稳定性最高。用相对极差进一步描述6个表型性状的极端变异程度,6个性状的相对极差平均值为34.93%~44.98%,差别不大,其中,叶宽的极端变异程度最小;而株高和地径的相对极差平均值分别为43.53%和44.98%,表明它们的极端变异程度相近。
3.2 麻栎种源的表型分化
供试麻栎种源叶片性状的表型分化系数(Vst)平均值为23.98%,意味着种源间4个叶性状的变异占总变异的23.98%,因而,麻栎种源的表型性状变异主要存在于种源内。麻栎叶片的大小(长度和宽度)变异幅度较大,而形状(叶长宽比)相对稳定、变异较小。麻栎不同种源间生长性状(株高和地径)的变异幅度较大,其中地径最大值比最小值约高1倍。一般认为,群体(种源)间差异是遗传和环境共同作用的结果,麻栎种源间呈现的极显著表型差异表明其种源间不同个体的遗传差异及其所承受的环境压力差异都比较大,从而产生了不同的表型变异,这些变异是麻栎优良种源选择和多样性保护的基础。
3.3 麻栎种源表型性状的相关性
在麻栎种源的4个叶片性状中,仅叶宽与叶长宽比呈极显著负相关,其他叶片性状两两间均呈极显著正相关;而叶片性状与生长性状间均呈负相关;在生长性状中,株高与地径则呈极显著正相关。由此可见,麻栎种源的各叶片性状间具有极显著正相关性,而生长性状间也具有极显著正相关性,但叶片性状与生长性状间则呈负相关性,体现了麻栎生长过程中各部位生长发育的协调性。
3.4 麻栎种源的聚类分析
根据聚类分析结果,供试28个麻栎种源可分为2大类,第1大类包括22个种源,第2大类包括6个种源;而从各种源的地理分布看,聚类分析结果与各种源的地理分布间无明显相关性。由于表型特征在不同的环境条件下能产生很强的可塑性,而用表型性状指标检测种源的遗传变异则具有一定的局限性[16],因而,基于表型性状变异的聚类分析结果并不一定能反映麻栎种源内在的遗传多样性。本研究采用4个叶片性状,而叶片是对环境变化较敏感且可塑性较大的器官,在不同选择压力下能形成各种适应类型[17]。
3.5 麻栎种源表型多样性与分子遗传多样性的比较
表型性状和分子标记是用于分析植物遗传多样性的2个不同的指标,表型性状是呈连续型变异的数量性状,而分子标记数据则呈离散型分布,两者具有不同的变异模式,可从不同水平反映麻栎种源的遗传变异状况。
供试28个麻栎种源表型性状变异的23.98%来源于种源间,表明麻栎种源表型性状变异主要来源于种源内。RAPD和SSR分析结果[18-19]也表明麻栎的遗传变异主要来自于种源内,但变异程度各不相同; RAPD标记分析结果表明麻栎遗传变异的13%来源于种源间,而SSR标记分析结果则表明麻栎遗传变异的16%来源于种源间。2种分子标记分析结果类似但与表型性状分析结果的差异较大,这表明因响应环境效应而产生的表型及分子变异的程度有一定差异,但差异幅度无法明确定量[20]。
表型性状的变异分析以及分子水平的遗传变异分析均表明麻栎种源具有丰富的遗传变异。麻栎种源间或种源内6个表型性状的变异都达到了极显著或者显著水平,各表型性状的变异系数为16.25%~33.60%;RAPD标记分析结果[18]表明麻栎种源的多态位点百分率为74.24%,总的Nei’s遗传多样性指数为0.240 9;SSR标记分析结果[19]表明麻栎种源间的期望杂合度平均值为0.760 3,平均等位基因数为8个。这些结果均从不同角度反映了麻栎不同种源间具有丰富的遗传变异。
基于表型性状分析、采用聚类分析方法可将供试的28个麻栎种源分成2大类:第1大类包括22个种源,第2大类包括江苏句容、四川万源、浙江龙泉、山东沂水、广东乐昌和四川广元6个种源。而基于RAPD标记分析的聚类分析结果[18]则将供试的17个麻栎种源中的16个聚在第1组,仅浙江龙泉种源单独聚为第2组;基于SSR标记分析的聚类分析结果[19]则将28个麻栎种源聚为2大组,第1大组包括17个种源,第2大组包括贵州榕江、广西融水、湖南桑植、贵州三穗、贵州黄平、广东乐昌、陕西汉中、湖南新宁、四川广元、四川万源和四川泸州11个种源。总的来看,基于分子标记的聚类分析结果较为一致,其中,基于RAPD标记分析划分的第1组的16个种源均出现在基于SSR标记分析划分的第1大组内,因而,采用不同的分子标记对麻栎种源进行聚类分析其结果可能更接近。
[1] HUANG C J,ZHANG Y T,BARTHOLOMEW B.Fagaceae[M]∥WU Z Y,RAVEN P H.Flora of China:Vol.4.Beijing:Science Press,1999:314-400.
[2] 徐立安.栎属群体与进化遗传研究进展[J].南京林业大学学报:自然科学版,2002,26(6):73-77.
[3] FANG S Z,LIU Z L,CAO Y D,et al.Sprout development, biomass accumulation and fuelwood characteristics from coppiced plantations of Quercus acutissima[J].Biomass and Bioenergy, 2011,35(7):3104-3114.
[4] 王 标,虞木奎,孙海菁,等.盐胁迫对不同种源麻栎叶片光合特征的影响[J].应用生态学报,2009,20(8):1817-1824.
[5] 唐罗忠,赵 丹,田 野,等.不同处理下的麻栎扦插成活率和内含物含量[J].福建林学院学报,2012,32(2):113-119.
[6] 唐罗忠,赵 丹,诸葛强,等.麻栎组织培养外植体选择与灭菌方法[J].江苏林业科技,2010,37(5):23-25.
[7] 刘志龙,虞木奎,唐罗忠,等.不同种源麻栎种子形态特征和营养成分含量的差异及聚类分析[J].植物资源与环境学报, 2009,18(1):36-41.
[8] 刘志龙,虞木奎,马 跃,等.不同种源麻栎种子和苗木性状地理变异趋势面分析[J].生态学报,2011,31(22):6796-6804.
[9] 廖 婧,方炎明,虞木奎.麻栎茎段体胚发生和组织学观察初报[J].植物研究,2011,31(5):575-578.
[10] 廖 婧,方炎明,虞木奎.麻栎成熟合子胚外植体体胚发生和植株再生[J].西北植物学报,2012,32(2):0398-0402.
[11] 顾万春.统计遗传学[M].北京:科学出版社,2004.
[12] SHUTYAEV A M.GIERTYCH M.Genetic subdivisions of the range of Scots pine(Pinussylvestris L.)based on a transcontinental provenance experiment[J].Silvae Genetica,2000,49(3):136-151.
[13] SCHMIDTLING R C.Use of provenance tests to predict response to climatic change:loblolly pine and Norway spruce[J].Tree Physiology,1994,14:805-817.
[14] MÁTYÁSC.Climatic adaptation of trees:rediscovering provenance tests[J].Euphytica,1996,92:45-54.
[15] 葛 颂,王明庥,陈岳武.用同工酶研究马尾松群体的遗传结构[J].林业科学,1988,24(4):399-409.
[16] XU F,GUO W H,XU W H,et al.Habitat effects on leaf morphological plasticity in Quercus acutissima[J].Acta Biologica Cracoviensia:Series Botanica,2008,50(2):19-26.
[17] 李兰芳,包维楷.植物叶片形态解剖结构对环境变化的影响与适应[J].植物学通报,2005,22(增刊):118-127.
[18] ZHANG Y Y,FANG Y M,YU M K,et al.Molecular characterization of sawtooth oak(Quercus acutissima)germplasm based on random ly amplified polymorphic DNA[J].Plant Systematics and Evolution,2013,299:1829-1837.
[19] ZHANG Y Y,FANG Y M,YU M K,et al.Molecular characterization and genetic structure analysis of Quercus acutissima germp lasm in China using microsatellites[J]. Molecular Biology Reports,2013,40(6):4083-4090.
[20] GÖMÖRY D,FOFFOVÁE,KMEˇT J,et al.Norway spruce〔Picea abies(L.)Karst.〕provenance variation in autumn cold hardiness: adaptation or acclimation?[J].Acta Biologica Cracoviensia:Series Botanica,2010,52(2):42-49.
(责任编辑:惠 红,张明霞)
Analysis on phenotypic trait variation of different provenances of Quercus acutissima
ZHANG Yuanyan1,YU Mukui2,FANG Yanming1,①(1.College of Forest Resources and Environment,Nanjing Forestry University,Nanjing 210037,China;2.Research Institute of Subtropical Forestry,Chinese Academy of Forestry,Fuyang 311400,China),J.Plant Resour.&Environ.2014,23(3):36-44
Taking twenty-eight geographical provenances of Quercus acutissima Linn.from Guangxi, Guangdong,Guizhou,Hu’nan,Zhejiang,Anhui,Jiangsu,Hubei,Sichuan,Shaanxi,He’nan and Shandong as research objects,variation status of six phenotypic traits including four leaf traits(leaf length,leafwidth,petiole length and ratio of leaf length to leafwidth)and two growth traits(heightand ground diameter)was analyzed.Coefficient of variation(CV)and relative range(R°)of all traits among and within provenances and phenotypic differentiation coefficient(Vst)of all leaf traits among provenances were studied,and analyses on correlation and principal component of all traits were also carried out.Moreover,the cluster analysis on twenty-eight provenanceswas also done.Results show that there are extremely significant(P<0.01)differences in six phenotypic traits among different provenances,while within provenances,there are extremely significant and significant(P<0.05) differences only in leaf width and leaf length,respectively.Average value of Vst of four leaf traits among provenances is 23.98%,in which Vst value of leaf width is the biggest(42.39%).In six phenotypictraits,CV average value of petiole length is the biggest(33.60%)and that of ground diameter is the smallest(16.25%),and among different provenances,CV average value of all traits of provenance from Hanzhong of Shaanxi is the smallest(14.39%),while that from Jurong of Jiangsu,Wanyuan of Sichuan and Yishui of Shandong all is above 30%.There are obvious difference in R°value of all traits among provenances,in which,R°value of provenance from Wanyuan of Sichuan is the biggest(60.99%),and that from Xinning of Hu’nan and Hanzhong of Shaanxi is smaller(less than 30%),while that among six phenotypic traits is 34.93%-44.98%with a little difference,meaning the difference in extreme variation degree is obvious among provenances,and that is not obvious among phenotypic traits.In four leaf traits,there is highly significant negative correlation only between leaf width and ratio of leaf length to leaf width,while there is highly significant positive correlation in other traits.There is a negative correlation between leaf traits and growth traits,while there is a highly significant positive correlation between height and ground diameter.The contribution rate of the first and the second principal components for phenotypic trait variation of Q.acutissima provenances is 43.663%and 27.695%, respectively,in which,leaf trait variation plays a dominant role in the first principal component and growth trait variation responsesmainly in the second principal component.According to cluster analysis result,twenty-eight geographical provenances can be divided into two groups containing twenty-two and six provenances,respectively,but there is no obvious relationship between cluster analysis result and geographical distribution of provenance.It is suggested that there are rich genetic variations in Q. acutissima provenances,and their phenotypic trait variation existsmostly within provenances.
Quercus acutissima Linn.;geographical provenance;phenotypic trait;coefficient of variation;relative range;cluster analysis
S792.181.01
A
1674-7895(2014)03-0036-09
10.3969/j.issn.1674-7895.2014.03.05
2013-09-26
国家自然科学基金资助项目(31370666);江苏高校优势学科建设工程资助项目(PAPD)
张元燕(1984—),女,四川西昌人,博士,主要从事发育植物学及分子生物学研究。
①通信作者E-mail:jwu4@njfu.edu.cn
