电刺激对大鼠废用性肌萎缩的抑制作用及调控机制研究
2014-05-11杜长亮贡建伟
杜长亮 贡建伟
南京航空航天大学体育部(南京 210016)
废用性肌萎缩主要指肢体在运动减退、制动、失重等状态下,骨骼肌所发生的生理、生化、形态学及功能的变化,临床上许多疾病(如瘫痪、肌肉拉伤)或治疗措施(如骨骼固定等)常常伴有运动减退或要求制动。目前,电刺激在临床中应用非常广泛,关于电刺激治疗肌肉萎缩的机制和效果虽然还不完全清楚,但其安全性和有效性在临床实践的许多领域得到证实,如肌电生物反馈改善药物吸收、电刺激镇痛、肌肉控制运动和姿势、促进慢性伤口愈合等[1-3],相关研究也表明,电刺激可以兴奋神经肌肉组织,每个脉冲都有可能引起一次运动反应[4,5]。本文利用大鼠废用性肌萎缩模型,探讨电刺激对腓肠肌和比目鱼肌萎缩肌肉的恢复效果及相关分子调控机制,为临床应用提供实验支持和依据。
1 材料与方法
1.1 动物分组和电刺激方式
采用改良式尾部悬吊法建立大鼠废用性肌萎缩模型[6]。32只雄性6周龄SD大鼠购自上海斯莱克实验动物中心,许可证号SCXK沪2009-0002。单笼饲养,尾部悬吊,前肢着地,后肢悬空,身体长轴与水平面成30°角。动物在笼内自由活动和进食饮水。饲养室温度20~25℃。人工控制室内照明,每天保证12小时光照,昼夜循环交替[7]。本实验在南京医科大学完成。
大鼠分正常组、废用性肌萎缩组、隔日电刺激组、每日电刺激组4组,每组8只。废用性肌萎缩模型建立成功后,两电刺激组每日1次或隔日1次电刺激大鼠腓肠肌和比目鱼肌,刺激频率30 Hz,波宽200 μs,可见被刺激部位肌肉明显收缩,每次刺激30分钟,持续30天。
1.2 mATPase组织化学染色方法
电刺激结束后,32只大鼠立即经戊巴比妥钠(45 mg/kg)腹腔麻醉后解剖,迅速取出右侧后肢腓肠肌和比目鱼肌,然后取中段约10 mm,投入4%多聚甲醛固定,常规方法制作石蜡组织切片。进行mATPase组织化学染色法染色[8],测量骨骼肌各型肌纤维(红肌、中间肌及白肌)横截面积。
1.3 荧光实时定量PCR检测肌球蛋白重链I、IIa、IIx、IIb 基因表达
大鼠腓肠肌和比目鱼肌匀浆后,采用Trizol方法提取总RNA,经反转录合成cDNA,经real time-PCR,测定 I、IIa、IIx、IIb 的相对表达量,其引物(上海生工)序列如下:I:引物序列,上游:5’-GGAGC TCACCTACCAGACAGA-3’;下游:5’-CTCAGGGCT TCACAGGCATCC-3’,扩增片段长度308,基因银行序列NM_017240.1。IIa:引物序列,上游:5’-CCT CTTACTTCCCAGCTGCACCTTCT-3’; 下游:5’-CTC AGGGCTTCACAGGCATCC-3’,扩增片段长度239,基因银行序列NM_001135157.1。IIx:引物序列,上游 :5’-ACGGTCGAAGTTGCATCCCTAAAG-3’;下游:5’-CACCTTCGGTCTTGGCTGTCAC-3’,扩增片段长度263,基因银行序列NM_001135158.1。IIb:引物序列,上游:5’-AGCCTGCCTCCTTCTTCATCTGG-3’; 下游:5’-CACGGTTGCTTTCACATAGGACTC-3’,扩增片段长度229,基因银行序列NM_019325.1。β-actin: 引物序列, 上游:5’-CACCCGCGAGTAC AACCTTC-3’; 下游:5’-CCCATACCCACCATCACACC-3’,扩增片段长度207,基因银行序列 NM_031144.2。
反应体系为 20 μl,包含 2 μl cDNA 模板(1 μg/μl),0.4 μl引物(10 nM),10 μl SYBR green I,7.2 μl超纯水。扩增条件:94℃预变性10秒,93℃变性30秒,55℃退火30秒,72℃延伸30秒,共40个循环。反应在ABI实时荧光定量PCR仪(ABI Co,USA)上进行,72℃~95℃缓慢升温,产生相应指标的溶解曲线,重复检测2次。以β-actin为内参。
1.4 Western blot检测MAPK相关激酶蛋白表达
肌肉组织匀浆后,提取蛋白,BCA法定量,分装并保存于-80℃,备用。蛋白98℃变性5分钟,进行10%SDS-聚丙烯酰胺凝胶电泳,60V浓缩胶,120V分离胶,2.5~3小时。电泳后取下胶,按尺寸剪取合适大小的Whatmann滤纸及硝酸纤维素膜,采用半干式转膜,恒压20 V,时间为膜面积乘以系数1.6,转移蛋白到硝酸纤维素膜。1%BSA,37℃封闭1小时。加入PBST稀释至工作液浓度的 p38、p-p38、JNK、p-JNK、ERK1/2、p-ERK1/2、β-actin 一抗 (南京凯基生物),37℃孵育1~2小时。再加入用PBST稀释二抗至工作液浓度,37℃避光孵育1 h。反应结束后弃二抗,用PBST清洗,采用Odyssey近红外荧光扫描成像系统(美国LI-COR公司产品)扫膜。
采用Motic Images plus 2.0彩色图像分析系统对肌纤维组织化学和免疫组化学结果进行计数。每例动物随机抽取3张接近肌腹中部的肌肉组织切片,每张切片在200倍光镜下随机观测5个视野,根据mATPase染色强度确认呈阴性的为Ⅰ型肌纤维,呈阳性的则为Ⅱ型肌纤维,分别计数每个视野内的不同类型肌纤维。计算每组动物不同类型肌纤维数量,再求其在所有肌纤维中的比例。
1.5 统计学分析
采用SPSS16.0软件统计分析实验数据,所有百分比数据进行反正弦变换,所有实验数据均以 (均数±标准差)表示,方差齐时,组间比较采用方差分析,方差不齐时用秩和检验,以0.05作为显著性差异界值。
2 结果
2.1 肌纤维比例
表1显示,废用性萎缩组大鼠腓肠肌I型肌纤维比例较正常组降低了29.94%,II型肌纤维比例增加了7.33%,均有统计学意义(P<0.05)。在比目鱼肌观察到同样的结果,废用性萎缩组I型肌纤维比例较正常组降低了18.73%,同时II型肌纤维比例增加了52.02%,均有统计学意义(P<0.05)。
只比较I型肌纤维,两电刺激组大鼠腓肠肌和比目鱼肌I型肌纤维比例较废用性萎缩组升高明显。隔日电刺激组腓肠肌I型肌纤维比例较废用性肌萎缩组升高了13.35%,每日电刺激组升高了34.68%,均有统计学意义(P<0.05)。隔日电刺激组比目鱼肌I型肌纤维比例较废用性肌萎缩组升高了8.97%,每日电刺激组升高了19.00%,均有统计学意义(P<0.05)。
只比较II型肌纤维,隔日电刺激组和每日电刺激组大鼠腓肠肌和比目鱼肌II型肌纤维比例较废用萎缩组减少明显。隔日电刺激组腓肠肌II型肌纤维比例较废用性肌萎缩组减少了0.97%,每日电刺激组较废用性肌萎缩组减少了4.38%,均有统计学意义 (P<0.05)。隔日电刺激组比目鱼肌II型肌纤维比例较废用性肌萎缩组减少了13.32%,每日电刺激组较废用性肌萎缩组减少了28.23%,均有统计学意义(P<0.05)。
每日电刺激组肌纤维比例改变效果大于隔日刺激组,I型和II型肌纤维比例与废用性萎缩组比较均有显著性差异(P<0.05)。

表1 各组大鼠腓肠肌和比目鱼肌肌纤维数量比较
2.2 肌球蛋白重链 I、IIa、IIx、IIb基因表达
表2可见,废用性肌萎缩组的腓肠肌I型MHC mRNA表达比正常组下降16%,与正常组相比差异具有统计学意义(P<0.05),废用性肌萎缩组的腓肠肌 IIa、IIx、IIb型 MHC mRNA表达比正常组升高2%、6%和23%,其中IIb升高明显,与正常组相比差异具有统计学意义(P<0.05)。
废用性肌萎缩组比目鱼肌I型MHC mRNA表达较正常组下降32%,差异有统计学意义 (P<0.05),废用性肌萎缩组比目鱼肌IIa和IIx型MHC mRNA表达较正常组分别升高5%和33%,其中IIx型升高有统计学意义(P<0.05)。
每日电刺激组和隔日电刺激组大鼠腓肠肌和比目鱼肌I型MHC mRNA表达较废用性萎缩组明显升高,有显著性差异(P<0.05),且每日刺激组恢复较隔日刺激组明显。每日电刺激组和隔日电刺激组大 鼠 腓 肠 肌 和 比 目 鱼 肌 II 型 (IIa、IIx、IIb)MHC mRNA表达较废用性萎缩组有升有降,变化不统一。

表2 各组大鼠腓肠肌和比目鱼肌MHC mRNA表达比较
2.3 JNK/MAPK通路相关蛋白表达
采用灰度扫描仪 (CE Pathspeed CR MP310)对腓肠肌和比目鱼肌肌纤维蛋白表达(图1)进行灰度扫描。结果显示,电刺激组腓肠肌和比目鱼肌肌纤维MAPK相关激酶蛋白表达与废用性肌萎缩组相比均有明显变化。正常组腓肠肌p-JNK表达是废用性肌萎缩组的 3.4倍,p-ERK1/2是 2.48倍,p-p38是2.75倍;隔日电刺激组腓肠肌肌纤维p-JNK表达是废用性肌萎缩组的2.66倍,p-ERK1/2是1.91倍,pp38是2.37倍;每日电刺激组p-JNK表达是废用性肌萎缩组的2.93倍,p-ERK1/2是3.57倍,p-p38是3.31倍。
正常组比目鱼肌肌纤维p-JNK表达是废用性肌萎缩组的3.17倍,p-ERK1/2是1.44倍,p-p38是1.7倍;隔日电刺激组比目鱼肌肌纤维p-JNK表达是废用性肌萎缩组的4.25倍,p-ERK1/2是2.34倍,p-p38是1.77倍;每日电刺激组比目鱼肌肌纤维p-JNK表达是废用性肌萎缩组的4.66倍,p-ERK1/2是3.07倍,p-p38是1.95倍。
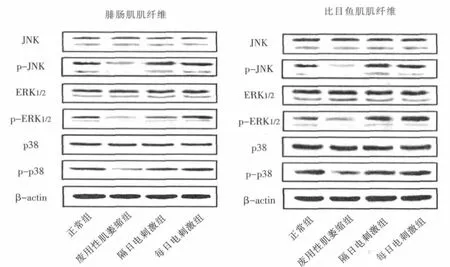
图1 各组大鼠腓肠肌和比目鱼肌肌纤维MAPK相关激酶蛋白表达(n=8)
3 讨论
在废用性肌萎缩中,骨骼肌纤维由Ⅰ型肌纤维向Ⅱ型肌纤维转化[9]。大鼠骨骼肌肌球蛋白重链(MHC)基因表达的路线为:Ⅰ→Ⅱa→Ⅱx→Ⅱ[10,11]。 本实验再次验证了此过程。腓肠肌外侧主要以快肌纤维为主,纤维构成比例约为I型20%,IIa型20%,IIx型10%,IIb型最多,约50%。而与此对比,比目鱼肌以慢肌纤维为主,未发现IIb型肌纤维[12],I型约占70%,IIa型20%,IIx型10%。骨骼肌萎缩后,无论以白肌为主的腓肠肌还是以红肌为主的比目鱼肌,I型肌纤维基因表达减少,IIa、IIx、IIb型肌纤维基因表达增多,I型肌纤维向II型肌纤维转变。本实验中,无论每日刺激组还是隔日刺激组,30天电刺激均能减少肌纤维类型的转变幅度,I、IIx、IIb型的转变幅度均减少,但IIa型表达较萎缩组增加。两组电刺激比较,每日刺激组较隔日刺激组效果更明显。以红肌为主的比目鱼肌I型肌纤维基因表达下降更明显,可能是比目鱼肌红肌比重大,萎缩对红肌基因表达影响更大的结果。
文献报道,激烈运动激活MAPK相关激酶通路[13-15]。 丝裂原活化蛋白激酶 (mitogen-activatedprotein kinases,MAPKs)是一类主要的信号分子,是哺乳动物细胞内广泛存在的一类丝/苏氨酸蛋白激酶。目前,至少鉴定出了4种MAPK家族成员,分别为细胞外信号调节激酶 (ERK1/2),c-Jun N端激酶(JNK)/应激活化蛋白激酶(SAPK),p38 及 ERK[16,17]。每种 MAPK被特异的 MAPK激酶(MAPKK,MEK)激活,后者又被 MAPKK 激酶(MAPKKK,MEKK)激活,MAPK信号通路正是通过这种保守的三级酶促级联反应激活其下游转录因子,MAPK是该信号通路的枢纽[18]。在骨骼肌纤维中,激活的MAPK通过磷酸化核转录因子、细胞骨架蛋白及酶类等,参与骨骼肌细胞增殖、生长、发育、分裂以及各种肌细胞类型转化等多种生理和生化反应[19]。本实验发现,废用性肌萎缩的肌纤维细胞中磷酸化JNK、ERK1/2、p38蛋白表达明显低于正常组。当隔日电刺激两种肌纤维后,磷酸化JNK、ERK1/2、p38蛋白上调,每日电刺激组磷酸化JNK、ERK1/2、p38蛋白上调更明显。这与肌球蛋白重链(MHC)基因表达趋势一致,比目鱼肌纤维细胞蛋白表达较腓肠肌纤维表达更明显。这提示,电刺激骨骼肌纤维产生类似于激烈运动的生物学效应,分子调控机制也有相同之处,在Ⅱ型肌纤维向Ⅰ型肌纤维转化的过程中,MAPK通路可能起重要作用。
4 总结
采用改良式大鼠尾部悬吊法成功建立废用性肌萎缩模型,模拟了临床肌肉萎缩状态,Ⅰ型肌纤维向Ⅱ型转化趋势明显。长期低频电刺激改善废用性肌萎缩,II型肌纤维向I型转化,这对肌萎缩康复有积极意义。
[1]Coghlan S,Crowe L,McCarthypersson U,et al.Neuromuscular electrical stimulation training results in enhanced ac-tivation of spinal stabilizing muscles during spinal loading and improvements in pain ratings.Conf Proc IEEE Eng Med Biol Soc,2011,7622-7625.
[2]Schuhfried O,Crevenna R,Fialka-Moser V,et al.Non-invasive neuromuscular electrical stimulation in patients with central nervous system lesions:An educational review.J Rehabil Med,2012,44(2):99-105.
[3]Johnston TE,Modlesky CM,Betz RR,etal.Muscle changes following cycling and/or electrical stimulation in pediatric spinal cord injury.Arch Phys Med Rehabil,2011,92(12):1937-1943.
[4]Lee MJ,Reid SL,Elliott BC,et al.Running biomechanics and lower limb strength associated with prior hamstring in-jury.Med Sci Sports Exerc,2009,41(10):1942-1951.
[5]Sole G,Milosavljevic S,Nicholson HD,et al.Selective strength loss and decreased muscle activity in hamstring injury.J Orthop Sports Phys Ther,2011,1(5):354-363.
[6]Pette D,Staron RS.Transitions of muscle fiber phenotypic profiles.Histochem Cell Biol,2001,115:359-372.
[7]李长宏,吴倩.被动运动和电刺激对尾吊大白鼠比目鱼肌肌纤维的影响.中华物理医学与康复杂志,2004,26:133-135.
[8]高云芳,何志仙,樊小力,等.pH值对应用mATP酶法进行梭外肌纤维分型的影响.西北大学学报 (自然科学版),2005,35:76-79.
[9]江钟立,张勤,励建安,等.运动对大鼠肌细胞丝裂素活化蛋白酶信号传导系统的调节作用.中华物理医学与康复杂志,2002,24:353-355.
[10]Goodyear LJ,Chang PY,Sherwood DJ,et al.Effects of exercise and insulin on mitogen-activated protein kinase signaling pathways in rat skeletal muscle.Am J Physiol,1996,271:E403-E408.
[11]Ryder JW,Fahlman R,Wallberg-Henriksson H,et al.Effect of contraction on mitogen-activated protein kinase signal transduction in skeletal muscle.Involvement Of the mitogen-and stress-activated protein kinase 1.J Biol Chem,2000,275:1457-1462.
[12]Tang H,Macpherson P,Marvin M,etal.A histone deacetylase 4/myogenin positive feedback loop coordinates denervation-dependent gene induction and suppression.Mol Biol Cell,2009,20:1120-1131.
[13]Thompson HS,Maynard EB,Morales ER,et al.Exerciseinduced HSP27,HSP70 and MAPK responses in human skeletalmuscle.Acta Physiologica Scandinavica,2003,178:61-72.
[14]Carlson CJ,Fan Z,Gordon SE,et al.Time course of the MAPK and PI3-kinase response within 24 h of skeletal muscle overload.J Appl Physiol,2001,91:2079-2087.
[15]BoppartMD,Hirshman MF,SakamotoK,etal.Static stretch increases c-Jun NH2-terminal kinase activity and p38 phosphorylation in rat skeletal muscle.Am J Physiol Cell Physiol,2001,280:C352-C358.
[16]McGee SL,Hargreaves M.Exercise and skeletal muscle glucose transporter 4 expression:molecular mechanisms.Clin Exp Pharmacol Physiol,2006,33:395-399.
[17]Jose-Cunilleras E,Hayes KA,Toribio RE,et al.Expression of equine glucose transporter type 4 in skeletal mus-cle after glycogen-depleting exercise.Am J Vet Res,2005,66:379-385.
[18]Widegren U,Ryder JW,Zierath JR.Mitogen-activated protein kinase signal transduction in skeletal muscle:effects of exercise and muscle contraction.Acta Physiologica Scandinavica,2001,172:227-238.
[19]Roth RJ,Le AM,Zhang L,et al.MAPK phosphatase-1 facilitates the loss of oxidative myofibers associated with obesity in mice.J Clin Invest,2009,119:3817-3829.
