微波场对1,4-丁二醇/水体系的选择性加热研究
2014-05-10邢建宇白波宋秀玲杨莉
邢建宇,白波,宋秀玲,杨莉
(长安大学环境科学与工程学院,陕西西安 710054)
微波作为一种快速加热方式,已广泛应用于无机材料化学、有机化学、食品加工业等领域[1-3]。相对于传统的热传导加热方式,微波加热具有加热时间短、体积加热、选择性加热、无环境污染等优点,其中选择性加热是根据介电常数的不同,可在同一体系中对不同的物质造成不同的瞬时温升,已用于某些物质及复合材料的干燥过程[4-5],并在提高蒸馏过程的效率方面展现出一定的潜力[6]。另外,微波场加热还可以与热空气、红外线、真空系统等结合使用,具有较强的兼容性[7]。
微波的热效应机理虽然了解较为清楚,但是其应用主要集中在加热速率快这一特点上,对于微波的选择性加热研究较少,该种选择性在蒸馏过程尤其是分子蒸馏过程中可能具有非常高的应用潜力。本文选择1,4-丁二醇/水体系在真空及常压下对微波场的选择性加热进行了研究。
1 实验部分
1.1 试剂与仪器
1,4-丁二醇,分析纯。
G7020ⅡCTL-2 Galanz微波炉;2XZ-0.5 旋片式真空泵;WZS-I790088阿贝折射仪;DT8000红外测温仪。
1.2 实验方法
采用红外测温仪进行温度测定,每组实验均做3个平行,使用阿贝折射仪进行浓度测定,最终数据取平均值,实验数据使用SPSS软件进行数据分析。
2 结果与讨论
2.1 微波辅助蒸馏过程中各参数相关性分析
由表1可知,在1,4-丁二醇/水体系中,加热时间与溶液的末组分变化,质量变化,温度变化具有显著性相关,表明加热时间越长,温度越高,物质的挥发量越大。但是水体积变化相对于1,4-丁二醇体积变化要显著得多,水体积变化的相关性在0.01水平上正相关为0.81,1,4-丁二醇的体积变化就小了许多,仅在0.05水平上正相关为0.366表明在加热过程中被蒸发的组分主要为水。蒸发完后的末组分除与初始组分密切相关外,与温度变化和1,4-丁二醇体积变化在0.01水平上相关,而与水体积变化相关性不强,说明末组分以1,4-丁二醇为主,加热过程中可以选择微波吸收能力强且体积变化较大的水组分作为考察目标,确定微波对于不同组分的选择性加热作用。

表1 Pearson相关性分析Table 1 Pearson relevance analysis
2.2 真空/常压条件下体系温度的变化分析
真空/常压条件下体系温度变化见图1。
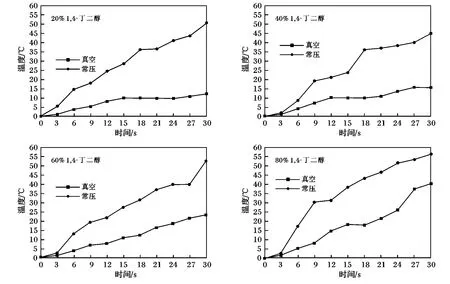
图1 真空/常压条件下不同比例1,4-丁二醇/水体系的温度变化Fig.1 Temperature changes of 1,4 butanediol/water system with different proportion under ordinary pressure and vacuum state
由图1可知,在真空状态下对溶液进行加热时,溶液的温度变化比常压状态下的温度变化要小得多,常压下温度由25~85℃内变化,温差为60℃;而在真空状态下温度由27~51℃内变化,温差为24℃。而同浓度的溶液常压下的温度变化比真空下的温度的变化也要大得多。由图1可知,两组分常压加热过程中,温度曲线会表现出一定的平台阶段,这一阶段往往以蒸发过程为主,只有蒸发掉过量的水,体系的温度才会进一步提升。在真空状态下,溶液的沸点大幅度降低,有利于溶液中的不同组分之间的热传递减少,而这种热传递的减少使得不同组分温度的升高只能依靠分子自身对微波的吸收能力。由图1可知,不同浓度不同状态下溶液的温差有很大的差距,由此可以推断出微波对不同组分的选择性加热能力有所不同。
2.3 微波加热过程中溶液两组分比例关系的变化
如图2所示,当水的初始体积百分比为80%时,在常压及真空条件下得到水体积比例变化曲线1及线2,60%时得到线3及线4,40%时得到线5及线6,20%时得到线7及线8。
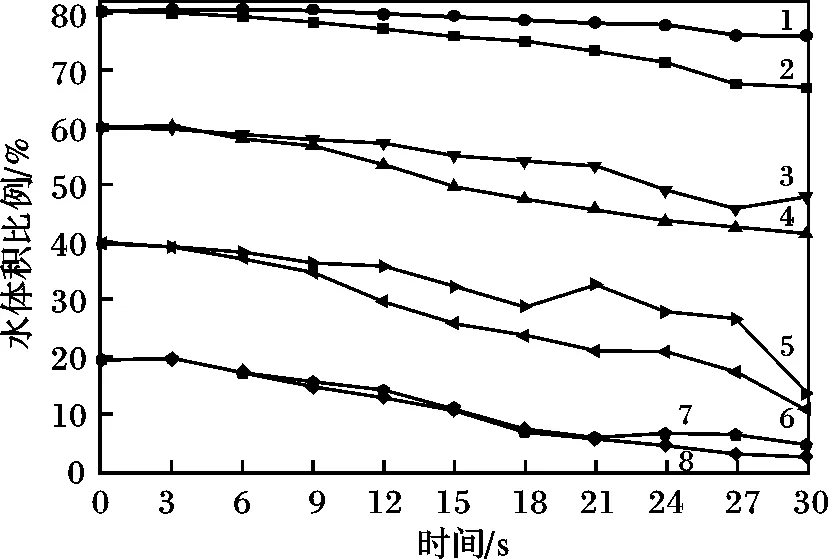
图2 真空及常压条件下不同比例1,4-丁二醇/水溶液中水体积比例变化曲线Fig.2 Water volume ratio changes of 1,4 butanediol/water system with different proportions under ordinary pressure and vacuum state
由图2可知,在加热过程中因为水的介电常数比较大,在加热过程中水的比例是不断下降的,真空条件下,各浓度1,4丁二醇/水体系中的水体积的变化都比常压条件下变化大。当水的初始体积百分比较高时(40%,60%,80%),在真空条件水体积的变化幅度相比常压条件下要大。水的初始体积百分比为20%时,真空和常压条件下,水体积的变化相差不多,这可能是由于水含量低时,水含量变化比较小,因此真空和常压条件对其影响较小。由此可以看出,在真空状态下微波的选择性加热要比在常压状态下选择性加热的敏感度要高得多。
2.4 微波加热过程中水体积变化率的分析
假设互溶体系中的两个组分均以刚体状态存在,在 1,4-丁二醇溶液中,当水含量大于 1,4-丁二醇时,可认为每个1,4-丁二醇分子四周都是水分子。此时的传热面积就是所有1,4-丁二醇分子的表面积。而当1,4-丁二醇的量多于水的量时,则认为每个水分子周围都是1,4-丁二醇分子,此时的传热面积就是所有水分子的表面积。即两个组分的传热面积则取决于所占比例小的那个组分的所有分子的表面积之和。这样来说,传热面积可以通过改变两组分之间的比例关系来实现。

图3 真空/常压条件下蒸发过程中水变化率曲线Fig.3 Changes of water in 1,4 butanediol/water system with different proportion under ordinary pressure and vacuum state
由图3可知,在任何不同浓度下,水溶液在真空条件下的体积变化率均较常压条件下高,伴随着水浓度的降低,常压及真空条件下水体积的变化率都呈逐渐升高趋势。溶液体系中水的蒸发主要与微波的能量吸收相关,但是溶液中的1,4-丁二醇组分同时也在吸收微波而提高其自身温度,当温度到达水的沸点时,水分子蒸发,温度不再提高,而1,4-丁二醇分子未达到其沸点,会继续吸收微波并升温,提升了温度的1,4-丁二醇,作为水分子蒸发的第2热源使得水分子处于过热条件下,加速其蒸发的过程。此时1,4-丁二醇的数量决定了该过程蒸发效率的高低。由图3a可知,当1,4-丁二醇浓度为20%时,相比其他浓度来说,其蒸发效率明显较低,此时作为第2热源的1,4-丁二醇数量较少,对水分子的传热也因为传热面相对较小而变得有限。当1,4-丁二醇浓度为80%时(图3d),水体积变化率在真空及常压下分别为3.16%及2.72%,说明此时1,4-丁二醇作为热源对于水分的蒸发起到主要作用,甚至在一定程度上掩盖了系统压力的影响。
2.5 微波辅助分子蒸馏的可行性分析
对于分子蒸馏过程来说,由分子热力学原理推导得到的平均自由程λ为:
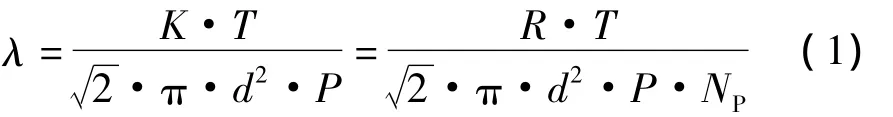
其中,K为玻尔兹曼常数1.38×10-23;T为温度;P为压强;d为分子平均直径。
如式1所示,目前对于提高分子蒸馏效率常用的方式主要集中在降低系统压力来增大分子自由程,但是可以看出分子自由程除了与压力和组分分子平均直径相关外,还与温度相关。如果使用传统的传导式加热,则在进行双组分A和B的分子蒸馏时,A和B分子的平均自由程λ的比为:
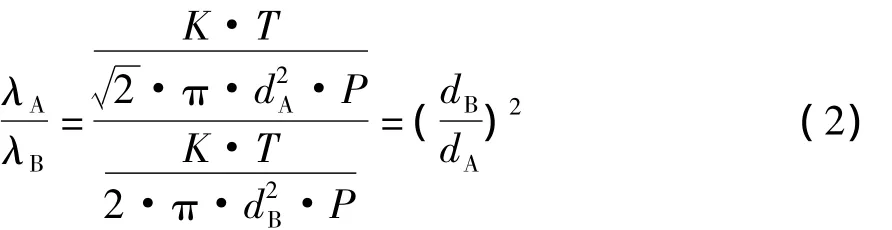
如协同利用微波场中溶液组分的瞬时温升差异进行分子蒸馏,其结果是:由于A和B组分结构不同,在微波场中,溶液表面上A组分分子由于吸收微波的能力强,B组分分子吸收较弱,甚至不吸收,从而造成A和B组分瞬时温升速率则不同。因此,会使得表面上A、B组分分子自由程比变化为:
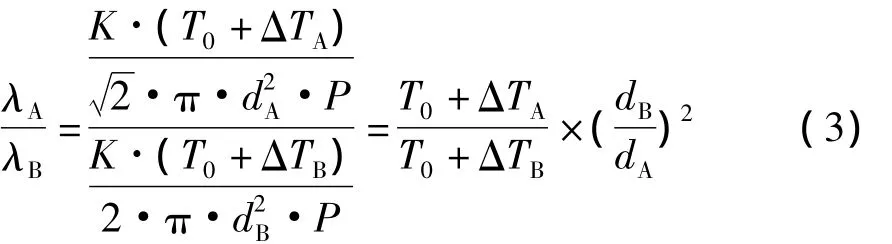
由此可见,A、B组分的温差越大,分子自由程的差异就越大。根据对互不相溶的两相体系的研究,已经证明了不同组分对于微波的选择性吸收作用[6],以此结论推广到互溶体系中,可以发现,由于传热面的急剧扩大,使得保持两组分温差的时间变得非常短。而温差以及传热面大小是传热过程的两大决定性因素。根据以上实验结果可知,真空体系可在一定程度上增大组分的蒸发速率,可以快速的降低两组分之间传热面的面积,而且真空降低了组分的沸点,使得系统整体的温度降低,有助于减小组分之间的温差。可以同时从两个方面减少传热现象,维持组分之间的温差,而组分温差的维持可以在一定程度上降低分子蒸馏对于真空度的依赖。
3 结论
通过对微波加热过程中各参数之间相关性的分析,发现加热时间与各参数相关性都较大,末组分比例除与初始组分密切相关外,与温度变化和1,4-丁二醇体积变化相关,而与水体积变化相关性小。通过对真空及常压下体系温度的分析发现,微波对不同的组分加热能力不同,该种差异在真空条件下对于蒸馏过程具有一定的应用潜力。
互溶体系中两组分之间的温差因为巨大的传热面,可在瞬时达到均一,通过改变浓度来控制两组分之间的传热面,可以在宏观上推测两者之间的热传递现象,以及该种现象与系统压力的之间的关系。
最后通过对分子蒸馏相关原理的分析发现,真空体系可在一定程度上对传热现象中的两大影响因素进行抑制,再辅助以微波场的选择性加热,可对分子蒸馏过程起到积极地促进作用。
[1]孙德坤,朱建华,时吉,等.微波法制备Al2O3/NaY新型复合多孔催化材料[J].催化学报,1998,19(1):81-84.
[2]Larhed M,Moberg C,Hallberg A.Microwave-accelerated homogeneous catalysis in organic chemistry[J].Accounts of Chemical Research,2002,35(9):717-727.
[3]Romano V R,Marra F,Tammaro U.Modelling of microwave heating of foodstuff:Study on the influence of sample dimensions with a FEM approach[J].Journal of Food Engineering,2005,71(3):233-241.
[4]Kocaku爧ak S,Koroglu H J,Tolun R.Drying of wet boric acid by microwave heating[J].Chem Eng Process,1998,37(2):197-201.
[5]Kelen A,Ress S,Nagy T,et al.Mapping of temperature distribution in pharmaceutical microwave vacuum drying[J].Powder Technol,2006,162(2):133-137.
[6]Xing J Y,Song X L,Bai B,et al.Investigation of microwave field selective heating on two-phase system[J].Applied Mechanics and Materials,2014,448-453:3005-3008.
[7]Schiffmann R F.Microwave and Dielectric Drying,in Handbook of Industrial Drying[M].New York:Marcel Dekker Inc,1987:327-355.
