多壁碳纳米管滤过型净化柱净化-超高效液相色谱/串联质谱法同时测定生姜中的涕灭威及其代谢物
2014-05-08马立利周欣燃范筱京潘灿平
马立利, 贾 丽, 周欣燃, 刘 艳*, 范筱京, 潘灿平
(1.北京市理化分析测试中心,北京市食品安全分析测试工程技术研究中心,北京100089;2.中国农业大学理学院,北京100193)
生姜不仅是人们日常饮食中离不开的调味品,而且还具有开胃健脾、促进食欲,防暑、降温、提神,杀菌解毒、消肿止痛等医用价值,在海外也深受欢迎[1]。但生姜中的农药残留问题是广大消费者关注的热点。从中国 WTO/TBT-SPS通报咨询网公布的信息可知,自2006年5月29日日本实施《肯定列表制度》至2008年12月31日,日本厚生劳动省共扣留中国农产品305批次,其中两次在生姜中检出了农药涕灭威。2007年,美国也发现进口的中国生姜中涕灭威超标。2013年5月,关于山东潍坊地区部分姜农使用神农丹(其主要成分为涕灭威)种姜的报道,引起了广大消费者的警惕,为此监管部门开展了风险监测。
涕灭威的化学名称为O-甲基氨基甲酰基-2-甲基-2-甲硫基丙醛肟,它是一种高效、剧毒、广谱、内吸性的杀虫、杀螨、杀线虫剂。自1962年美国联合碳化物公司开发出该产品以来,由于其高效、经济而被广泛应用于棉花、花生、玉米等多种作物以防治螨类、蚜虫及线虫等多种害虫。涕灭威施入土壤后可迅速被氧化为相对稳定且毒性更高的涕灭威亚砜(ASX),ASX又进一步氧化为涕灭威砜(ASN)[2]。涕灭威和两个主要代谢物都具有很高的水溶性和毒性。涕灭威及其亚砜在中性和偏酸性的水中稳定,其降解半衰期可长达0.9~4.3年。因此,涕灭威一旦进入地下水中便容易积累,造成对地下水的污染[3]。由于其较高的毒性,巴西、秘鲁、美国等国家已经全面禁止涕灭威的登记和使用。根据我国国家强制性标准《食品中农药最大残留限量》(GB2763-2012)[4],生姜属于根茎类蔬菜,其涕灭威的最大残留限量为0.03 mg/kg。目前涕灭威的检测方法主要为气相色谱法[5,6]、液相色谱法[7]、液相色谱-质谱法[2,8-15]。然而这些检测方法的样品前处理涉及多次提取、固相萃取净化、衍生化等复杂的操作,无法满足食品安全突发事件快速处置工作所需的快速、高效的要求。
QuEChERS(quick,easy,cheap,effective,rugged,safe)方法自发布以来,获得了美国分析化学家协会(Association of Official Analytical Chemists,AOAC)等多个国际分析机构的认可,已广泛应用于食品中农药残留的分析。目前,有文献[16]报道将 QuEChERS方法中分散固相萃取步骤中的吸附剂装填至固相萃取柱管内进行样品处理同样能够达到净化的目的。此类萃取柱为滤过型净化柱(multiplug filtration clean-up,m-PFC),其 原 理 也 是 提 取 溶 剂中的样品基质与吸附剂发生作用。在m-PFC中,其吸附剂主要用于吸附基质中的干扰物质而不是目标物,所以净化柱中吸附剂的含量会影响回收率和净化效果。m-PFC方法相比分散固相萃取,不需要称量吸附剂,可以大大缩短净化时间,从而提高工作效率。Zhao等[17,18]利 用 m-PFC 净 化 技 术 分 别 建 立 了 苹果、卷心菜、马铃薯中4 0种农药,以及番茄、番茄汁、番茄酱中1 8 6种农药的分析方法。该类方法快速、高效,可以充分满足食品安全突发事件中对农药多残留的检测要求。本研究的目的是利用m-PFC和超高效液相色谱/串联质谱建立一种高效、灵敏的生姜中涕灭威及其代谢物的检测方法。
1 实验部分
1.1 仪器、试剂与材料
UPLC-ESI-MS/MS系统配有 ACQUITY 超高效液相色谱仪、Xevo TQ-S串联四极杆质谱仪(美国Waters公司);涡旋仪(江苏海门其林贝尔仪器制造有限公司);Elix 10 Milli-Q超纯水系统(美国Millipore公司);CR22GⅢ高速冷冻离心机(日本Hitachi公司);恒温水浴氮吹仪,包括 N-EVAPTM112氮气蒸发仪、OA-SYSTM加热装置(美国Organomation Associates公司);ACQUITY UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7μm;Waters公司);0.22μm微孔滤膜(天津津腾科技有限公司)。
涕灭威(aldicarb)、涕灭威砜(aldicarb sulfone)、涕灭威亚砜(aldicarb sulfoxide)标准品购于 Dr.Ehrenstorfer公司;乙腈、甲醇、甲酸均为色谱纯,购自Fisher公司。
多壁碳纳米管m-PFC净化柱购于天津博纳艾杰尔科技有限公司,内有10 mg多壁碳纳米管(外径10~20 nm,内径5 nm)和150 mg无水硫酸镁。
1.2 样品处理
1.2.1 样品提取
称取5 g(精确至0.01 g)已粉碎的生姜样品于50 mL塑料离心管中,加入10 mL乙腈,涡旋1 min;加入0.5 g氯化钠和2 g无水硫酸镁后迅速剧烈摇动混匀,于冰水浴中静置5 min,在4℃、5 000 r/min下离心5 min。取1 mL上清液至2 mL塑料离心管中,待净化。
1.2.2 样品净化
滤过型净化柱的示意图见图1,其中的填料为10 mg多壁碳纳米管和150 mg无水硫酸镁。m-PFC的净化操作步骤如图2所示。将注射器与滤过型净化柱连接,向上抽,使所有液体经过净化柱,再推出至离心管中,样品提取液第二次经过吸附剂部分。重复操作一次。净化液于50℃下用氮气吹干,用乙腈-水(5∶95,v/v)溶解并定容至1 mL,过0.22 μm微孔滤膜后待测定。

图1 滤过型净化柱示意图Fig.1 Schematic diagram of an m-PFC tip

图2 m-PFC净化操作步骤(净化1次)Fig.2 Schematic diagram of the rapid m-PFC method at one time clean-up
1.3 仪器分析条件
1.3.1 色谱条件
柱温:30℃;流速:0.2 mL/min;进样量:5.0μL;流动相A为乙腈,流动相B为0.1%甲酸溶液;梯度洗脱程序:0~3 min,95%B;3~7.5 min,95%B~20%B;7.5~9 min,20%B~95%B;9~11 min,95%B。
1.3.2 质谱条件
电喷雾正离子电离(ESI+);源温度150℃;毛细管电压3.2 kV;脱溶剂温度500℃;脱溶剂气(氮气)流量800 L/h。3种目标物的质谱参数见表1。
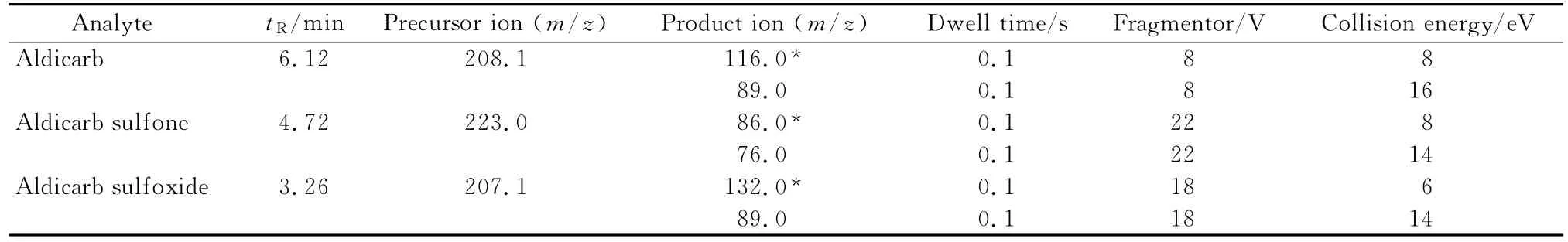
表1 涕灭威及其代谢物的质谱参数Table 1 MS parameters of aldicarb and its metabolites
2 结果与讨论
2.1 质谱与色谱条件的优化
2.1.1 定容溶剂的优化
用氮气吹干净化液,以乙腈溶解定容后进行仪器分析时发现目标物的峰形都较差。因此考察了以不同体积比(50∶50、20∶80、10∶90、5∶95)的乙腈-水和乙腈-0.1%甲酸水溶液为定容溶剂时目标物的响应值和峰形。结果表明,定容溶剂中加酸不能明显改善峰形和响应值。而随着定容溶剂中水的比例增加,目标物的峰形有显著改善,为10∶90和5∶95时没有明显的区别。而初始流动相为乙腈-水(5∶95)时,目标物的分离效果良好(见图3),因此以初始流动相为定容溶剂。
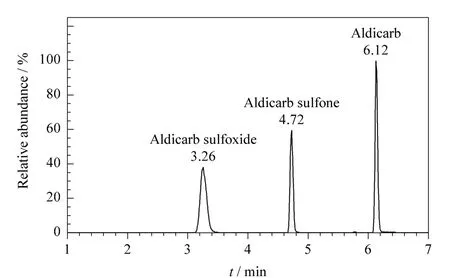
图3 涕灭威及其代谢物的色谱图Fig.3 Chromatogram of aldicarb and its metabolites
2.1.2 质谱条件的确定
首先在正离子检测方式下分别对100μg/L 3种目标物的标准溶液进行质谱分析得到分子离子峰和碎片离子峰,从而选定母离子和子离子。其中涕灭威砜和涕灭威亚砜的母离子为[M+H]+,涕灭威为[M+NH4]+。在此基础上进一步优化了监测离子、锥孔电压及碰撞能量等质谱参数(见表1)。在最优条件下,目标物得到良好分离,灵敏度高,符合农药残留检测的要求。
2.2 提取与净化条件的优化
2.2.1 提取条件的优化
为了评价不同溶剂对目标物提取效率的影响,本文分别以甲醇和乙腈为提取溶剂对生姜中添加的涕灭威、涕灭威砜、涕灭威亚砜3种目标物进行提取。结果表明,以甲醇为提取溶剂时净化柱的柱压太大,无法顺利将1.0 mL样品溶液吸进净化柱内,因此选用乙腈为提取溶剂。
2.2.2 净化次数的优化
m-PFC中净化次数对净化效果有一定的影响。分别比较了净化0、1、2、3次后基质样品的颜色。结果表明,经过1、2、3次净化的提取液的颜色明显比未净化的提取液的颜色浅,但净化1、2、3次的提取液的颜色之间无明显区别(见图4),表明m-PFC净化柱对色素具有较好的吸附去除效果。

图4 不同净化次数基质样品的颜色Fig.4 Effect of clean-up times on color of the extract
在生姜空白样品中添加200μg/kg的目标物进行不同净化次数的考察,每个净化次数重复测定6次。结果表明,净化1、2、3次,涕灭威和涕灭威亚砜的回收率没有明显区别,但净化2次的回收率的RSD最小;而净化2次时涕灭威砜的回收率最高(见图5)。综合考虑,本文选择净化2次。
2.3 分析方法的评价
采用空白基质溶液配制系列质量浓度(0.5、1、5、10、50、100、200μg/L)的混合标准工作液。以峰面积(Y)对质量浓度(X)做标准曲线,3种目标物的线性方程和相关系数见表2。结果表明,在相应的浓度范围内,3种农药的响应值和浓度均呈现良好的线性关系,且相关系数大于0.99。
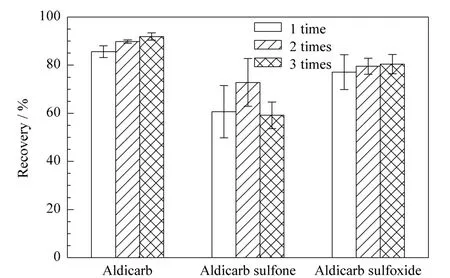
图5 不同净化次数对目标物回收率的影响Fig.5 Effect of clean-up time on the recoveries of the analytes

表2 3种目标物的线性方程和相关系数Table 2 Linear equations and correlation coefficients(r2)of the analytes
本文以每种目标物信噪比(S/N)为3时对应的样品中目标物的添加浓度为本方法的检出限(LOD),涕灭威、涕灭威砜、涕灭威亚砜分别为0.3、0.6、0.3μg/kg;以每种目标物信噪比为10时的添加浓度确定为本方法的定量限(LOQ),涕灭威、涕灭威砜、涕灭威亚砜分别为1.0、2.0、1.0μg/kg。
将生姜空白样品搅碎称量后,添加2、20、200 μg/kg目标物混合标准溶液并静置30 min,目标物被样品充分吸收后,按照前述方法进行提取、净化和测定,每个水平做6次平行试验,计算加标回收率和精密度。结果表明,生姜基质中涕灭威的回收率为80.3%~89.8%,RSD为0.7%~10.4%;涕灭威砜为71.4%~76.9%,RSD为9.9%~13.2%;涕灭威亚砜为77.3%~84.5%,RSD为3.3%~11.8%(见表3)。
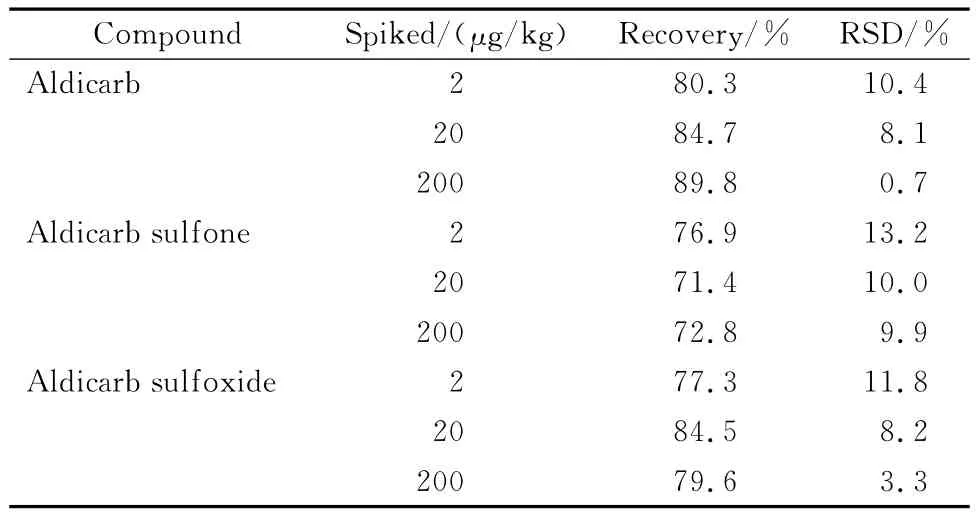
表3 生姜空白样品中目标物的加标回收率和RSD(n=6)Table 3 Recoveries and RSDs of target analytes spiked in blank ginger(n=6)
2.4 样品分析
应用本方法对市售的10个生姜样品进行测定,均未检出涕灭威、涕灭威砜和涕灭威亚砜。
3 结论
本文建立了生姜中涕灭威及其代谢物的超高效液相色谱/串联质谱测定方法。采用乙腈提取,多壁碳纳米管滤过型净化柱净化。滤过型净化柱操作简单,可以大大缩短净化时间;所用超高效液相色谱技术具有高通量样品分析的能力。本方法快速、高效,可以充分满足食品安全突发事件中对生姜中涕灭威及其代谢物残留的检测要求。
[1] Cao J,Pang G F,Wang M L,et al.Chinese Journal of Chromatography(曹静,庞国芳,王明林,等.色谱),2010,28(6):579
[2] Chen D D,Hou S C,Dai H H,et al.Journal of Instrumental Analysis(陈冬东,侯士聪,代汉慧,等.分析测试学报),2011,30(12):1367
[3] Zhu Z L,Cai D J.Rural Eco-Environment(朱忠林,蔡道基.农村生态环境),1993(2):50
[4] GB2763-2012
[5] NY/T761-2008
[6] Zuo H G,Zhan C R.Chinese Journal of Analysis Laboratory(左海根,占春瑞.分析试验室),2008,27(Suppl):311
[7] Liu Y T,Liao J L,Xie Y Q.Modern Agricultural Science and Technology(刘有添,廖杰良,谢永清.现代农业科技),2014(2):300
[8] NY/T1679-2009
[9] SN/T2441-2010
[10] Ding K Y,Lü W G,Sun J,et al.Journal of Instrumental Analysis(丁葵英,吕文刚,孙军,等.分析测试学报),2011,30(3):312
[11] Liu Y,Rao Z,Lu G H,et al.Journal of Instrumental Analysis(刘艳,饶竹,路国慧,等.分析测试学报),2012,31(6):738
[12] Wang J,Chen R C,Guo C H,et al.Journal of Food Safety and Quality(王敬,陈瑞春,郭春海,等.食品安全质量检测学报),2013,4(5):1458
[13] Wang L Z,Zhou Y,Huang X Y,et al.Chinese Journal of Chromatography(王连珠,周昱,黄小燕,等.色谱),2013,31(12):1167
[14] Yang X,Li P,Zhao Y F,et al.Chinese Journal of Chromatography(杨欣,李鹏,赵云峰,等.色谱),2012,30(3):309
[15] Liu Q,Liu L L,Zhou Y,et al.Pesticide Science and Administration(刘谦,刘丽丽,周杨,等.农药科学与管理),2013,34(12):43
[16] Guan H,Brewer W E,Garris S T,et al.J Chromatogr A,2010,1217:1867
[17] Zhao P Y,Fan S F,Yu C S,et al.J Sep Sci,2013,36(20):3379
[18] Zhao P Y,Huang B Y,Li Y J,et al.J Agric Food Chem,2014,Accepted.DOI:10.1021/jf405240j
