Turbo flow在线净化-超高效液相色谱-串联质谱法检测水果中5种咪唑类农药残留
2014-05-08孔祥虹张龙庄李建华
张 璐, 孔祥虹, 何 强, 张龙庄, 李建华
(1.陕西出入境检验检疫局,陕西 西安710068;2.西安市产品质量监督检验院,陕西 西安710068)
咪唑类农药(吡咪唑、咪唑烟酸、咪鲜胺、咪唑嗪和咪唑菌酮)是目前常用的广谱高效农药。农药的种类增多以及高效、高活性农药的广泛应用带来了相应的环保问题,主要表现为毒性问题、残留问题、生态问题和环境污染等。这些残留农药通过食物链的富集作用,可以在动物和人类机体内累积并导致急性或慢性中毒,严重威胁着人类的健康生存[1,2]。
传统的LC-MS/MS在进行化学物质的残留分析之前,需要对样品进行大量前处理。目前国内外对水果中农药残留的前处理方法主要为固相萃取法[3-9]、基 质分散法[10,11]、QuEChERS[12-14]等。上述方法对农药残留均可起到净化作用但费时费力。相比上述前处理方法,带有Turbo flow技术(Aria TLX系统)的在线样品前处理-超高效液相色谱-串联质谱系统(TF-UPLC-MS/MS)简化了样品制备过程。该技术将前处理系统与色谱分离检测系统串联,实现在线检测目标。该技术通过扩散溶解、尺寸排阻、柱层析技术将蛋白等一些大分子物质滤掉,保留小分子。每个样品只需要进行离心去除颗粒状杂质即可直接进行TF-UPLC-MS/MS分析,省去了样品预处理中大多数费时的步骤,不仅提高了样品处理的通量,还减小了由于操作过程中的错误和可变因素而带来的误差。与传统的提取方法相比,该方法进行食品中化学物质残留分析更快捷,更可靠。目前已采用该系统建立了牛奶中维生素D的检测方法[15]以及环境水中磺胺类[16]、皮质类固醇[17]、苯丙三唑类化合物[18]的检测方法。但目前还未见利用该系统建立水果等复杂样品中农药残留的检测方法。本文利用TF-UPLC-MS/MS系统建立了水果中5种咪唑类农药残留量的检测方法,并对酥梨、柑橘、苹果、猕猴桃、葡萄等水果中5种咪唑类农药的含量进行了测定。
1 实验部分
1.1 仪器、试剂与材料
Thermo Science Arial TLX-高效液相色谱-串联质谱仪,配TSQ Vantage质谱检测器(Thermo Science公司);冷冻离心机(Sigma公司);多功能振荡器(IKEA公司);超纯水净化系统(Millipore公司)。
咪唑烟酸(imazapyr)、咪唑嗪(triazoxide)、吡咪唑(rabenzazole)、咪鲜胺(prochloraz)和咪唑菌酮(fenamidone)标准品均购自德国Dr.Ehrenstorfer GmbH,纯度均大于99.0%;色谱纯乙腈、甲酸均购自Merck公司;甲酸铵、磷酸二氢钠、氯化钠、无水硫酸钠为分析纯。无水硫酸钠使用前经600℃烘烤。实验室用水为超纯水(18.2 MΩ·cm)。
酥梨、柑橘、苹果、猕猴桃、葡萄等水果样品均为市售。
1.2 标准溶液的配制
标准溶液的配制:分别准确称取咪唑烟酸、咪唑嗪、吡咪唑、咪鲜胺和咪唑菌酮各10.0 mg于10 mL棕色容量瓶中,用甲醇溶解并定容至10 mL,配成1.0 g/L 的标准储备液,于-20℃下保存。
标准工作溶液的配制:分别取上述储备液0.025 mL于棕色容量瓶中,用甲醇定容至25 mL,配制成1.0 mg/L 的混合中间标准工作溶液。使用前用乙腈-水(1∶1,v/v)溶液稀释成系列浓度的混合标准溶液,待用。
1.3 样品处理
准确称取3.0 g已打成浆的水果样品于50 mL具塞离心管中,加入10 mL饱和氯化钠(pH=7.0)溶液,再加入5.0 g无水硫酸钠后,加入10 mL乙腈振荡提取20 min,于 4 500 r/min 下离心5 min,收集乙腈层于心形瓶中。再加入10 mL乙腈重复上述提取过程一次,于4 500 r/min下离心5 min,合并乙腈层。40℃旋蒸至近干,加入2 mL乙腈-水(1∶1,v/v)溶液定容。过0.22μm有机滤膜后进行TF-UPLC-MS/MS检测。在样品中待测物的含量超出线性范围时,用乙腈-水(1∶1,v/v)溶液稀释至线性范围内再检测。
1.4 TF-UPLC-MS/MS条件
1.4.1 TF条件
TF色谱柱为TF C18(50 mm×1.0 mm),流动相A为乙腈,流动相B为5 mmol/L 甲酸铵溶液(含0.1%(v/v,下同)甲酸),洗脱梯度见表1(left pump),TF连接图如图1所示。

表1 Aria TLX Turbo flow的洗脱梯度Table 1 Elution gradient of Aria TLX Turbo flow

图1 Turbo flow泵连接图Fig.1 Valve position and instrument configuration of Turbo flowa.extraction of the analytes;b.elution.
1.4.2 液相色谱条件
色谱柱为 Hypersil GOLD aQ (100 mm×2.1 mm)。流动相A为乙腈,流动相B为5 mmol/L甲酸铵溶液(含0.1%甲酸),洗脱梯度见表1(right pump)。进样量为100μL。
1.4.3 质谱条件
扫描方式:电喷雾正离子模式(ESI+);检测方式:选择反应监测(SRM);喷雾电压:3 500 V;气化温度:330℃;鞘气压(N2):0.525 L/min(35 arb);辅助气压(N2):4.5 L/min(15 arb);离子传输管温度:300 ℃;去簇电压:2.0 V;碰撞气体 (Ar):199.9 MPa(1.5 mTorr),其他参数见表2。
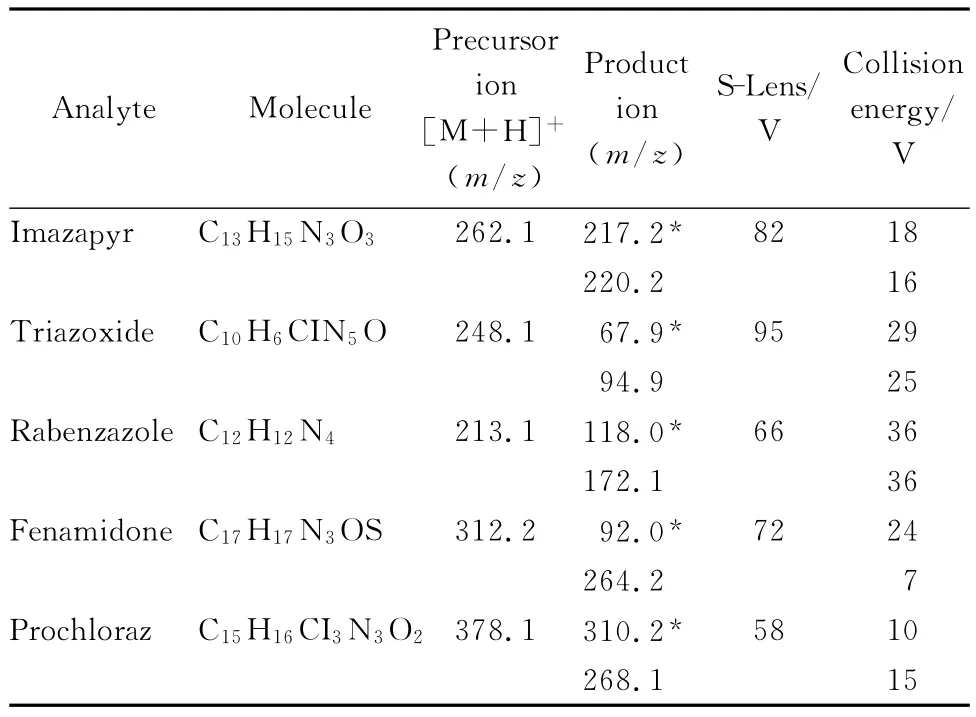
表2 5种咪唑类农药的质谱分析参数Table 2 MS parameters for the five imidazole pesticides
2 结果与讨论
2.1 TF条件优化
TF条件优化分为3个部分:选择合适的TF柱;选择合适的上样条件,包括流速、流动相等;选择合适的洗脱溶液将保留在TF柱上的目标化合物洗脱下来。
2.1.1 TF净化柱及流动相溶液的选择
实验中分析了目标化合物在TF cyclone-p柱和TF C18柱上的保留情况。结果表明,目标化合物在TF cyclone-p柱上基本无保留,而TF C18柱能达到完全保留。如图2所示,比较了5 mmol/L甲酸铵溶液、5 mmol/L 甲酸铵溶液(含有0.1%甲酸)和0.1%甲酸水溶液分别作为流动相时目标化合物在TF C18柱上的保留情况。结果表明,0.1%甲酸水溶液和5 mmol/L甲酸铵溶液作为流动相时,目标化合物在TF C18上有保留,但有50%左右的目标化合物流失。以5 mmol/L 甲酸铵溶液(含有0.1%甲酸)为流动相时,5种咪唑类农药被大部分被保留在TF柱上。当增大溶液中甲酸铵或甲酸含量时目标化合物响应下降且出现流失。因此选择TF C18柱作为净化柱,5 mmol/L 甲酸铵溶液(含有0.1%甲酸)作为流动相B。

图2 不同流动相对5种咪唑类农药在TF C18柱上保留的影响Fig.2 Effect of different mobile phases on the retentions of the five imidazole pesticides on TF C18 columna.5 mmol/L ammonium format solution(containing 0.1% (v/v)formic acid)as mobile phase;b.5 mmol/L ammonium formate solution as mobile phase;c.0.1% (v/v)formic acid as mobile phase.1.not to be retained part;2.retained part.
2.1.2 TF柱洗脱条件的优化
由于吸附在TF柱上的目标化合物需要合适的溶液洗脱进入液相色谱体系分离。因此实验中对洗脱溶液进行了相应的考察。当洗脱溶液中有机相比例高时能更有效地将5种咪唑类农药从TF柱上洗脱进入液相色谱体系,但高比例有机相在液相色谱分离时易造成严重的溶剂效应。因此尽量选择较低比例有机相的溶液作为洗脱溶液。实验中考察了不同比例有机相条件下目标化合物从TF柱上洗脱下来的情况。结果如图3所示,100%的乙腈可将95%的目标化合物洗脱下来,但是在液相色谱中会出现溶剂峰;当洗脱溶液中含有50%或60%的乙腈时有一部分目标化合物未被洗脱下来。当有机相比例为80%时既能将90%的目标化合物有效地洗脱下来,同时在液相色谱分离时不出现溶剂峰,各化合物得到良好分离。因此实验中选择乙腈-5 mmol/L甲酸铵溶液(含0.1%甲酸)(80/20,v/v)作为洗脱溶液。

图3 乙腈-5 mmol/L 甲酸铵(含0.1%甲酸)溶液中乙腈的体积分数对5种咪唑类农药洗脱效果的影响Fig.3 Elution effect of different volume percentages of acetonitrile in acetonitrile-5 mmol/L ammonium formate(containing0.1%formic acid)solution for the five imidazole pesticidesa.100%acetonitrile;b.50%acetonitrile;c.80%acetonitrile.1.not to be retained part;2.eluted part.
洗脱速率对5种咪唑类化合物在液相色谱上的分离有显著的影响。如图4所示,当洗脱速率为0.1 mL/min 时,咪唑烟酸峰有严重拖尾;改变流速为0.05 mL/min时,咪唑菌酮峰有拖尾;改变流速为0.07 mL/min 时,目标化合物完全洗脱且在液相色谱中达到良好分离,因此实验中选择0.07 mL/min为TF柱的洗脱速率。
2.2 色谱条件的优化
2.2.1 流动相的选择
分析比较了乙腈-水、乙腈-0.1%甲酸水溶液、乙腈-5 mmol/L 甲酸铵溶液、乙腈-5 mmol/L 甲酸铵溶液(含0.1%的甲酸)作为流动相时目标化合物的保留和峰形。结果表明,流动相中加入适量的甲酸铵有助于目标化合物的保留,但峰形会有拖尾;加入甲酸后,出峰时间提前且峰形更加对称;同时在正离子模式下,加入甲酸有利于目标化合物的离子化。因此实验中选择乙腈-5 mmol/L 甲酸铵溶液(含0.1%的甲酸)作为流动相。
2.2.2 色谱柱的选择

图4 不同洗脱速率下混合标准溶液的TF-UPLC-MS/MS总离子流图Fig.4 TF-UPLC-MS/MS TIC chromatograms of standard solution at different elution ratesElution rates:a.0.07 mL/min;b.0.1 mL/min;c.0.05 mL/min.Peaks:1.imazapyr;2.triazoxide;3.rabenzazole;4.fenamidone;5.prochloraz.
实验中比较了Hypersil GOLD色谱柱和Hypersil GOLD aQ色谱柱的分离效果。发现5种咪唑类农药在Hypersil GOLD aQ柱上的分离效果明显优于在Hypersil GOLD柱上的分离效果。这是因为Hypersil GOLD aQ柱拥有极性封端的C18固定相,同时该柱能耐受100%的水相且保持其性能稳定,因此该柱对中等极性化合物具有良好的保留能力和分离度。故选择Hypersil GOLD aQ色谱柱作为分析柱,典型的苹果基质加标色谱图见图5。
2.3 提取条件的选择
考察了分别采用10%(质量分数)Na2HPO4-饱和氯 化 钠 溶 液 (pH=2.0、4.0、6.0、7.8、8.5 和9.0)、饱和氯化钠溶液(pH=7.0)溶解样品,乙腈提取时,对目标化合物提取效果的影响。实验结果发现,当溶解溶液为10%Na2HPO4-饱和氯化钠溶液(且pH>7.0)时,咪唑烟酸、咪鲜胺的回收率均偏低。当10%Na2HPO4-饱和氯化钠溶液的pH=9.0时,5种咪唑农药的回收率均低于65%。说明在碱性条件下目标化合物不能被完全提取。当10%Na2HPO4-饱和氯化钠溶液的pH=4.0时,咪唑烟酸、咪唑嗪、吡咪唑、咪鲜胺的回收率偏高,尤其对咪唑烟酸影响较大。当加标水平为0.005 mg/kg时,咪唑烟酸的回收率达到145.1%,说明在弱酸性条件下,基质增强效应较强。当采用饱和氯化钠溶液(pH=7.0)为溶解溶液、乙腈提取时,有机相与水相分层明显,5种咪唑类农药的回收率均在80%~110%之间(见图6)。说明在该条件下,基质效应得到抑制,目标化合物基本上被完全提取。因此选择饱和氯化钠溶液(pH=7.0)溶解样品,乙腈提取样品。
2.4 方法的线性范围、回收率和精密度

图5 苹果基质加标样品(0.01 mg/L)的选择反应监测(SRM)色谱图Fig.5 Selected reaction monitoring(SRM)chromatograms of standards (0.01 mg/L)spiked in apple matrix

图6 不同溶解溶液下乙腈对5种咪唑类农药提取效果的比较Fig.6 Comparison of extraction efficiencies of the five imidazole pesticides by acetonitrile under different dissolved solutions
按1.2节方法制备1.0 mg/L 的5种咪唑类农药标准溶液,用乙腈-水(1∶1,v/v)溶液稀释,依次得到质量浓度为 0.007 5、0.01、0.03、0.05、0.75 mg/L的标准溶液。按优化条件进行测定,外标法定量。5种咪唑类农药的相关系数(r2)均大于0.99。在样品中加入低浓度的5种咪唑类农药混合标准溶液(加入量15 ng),重复测定6份样品,以信噪比(S/N)大于10确定定量限(LOQ)为0.005 mg/kg,低 于 日 本 肯 定 列 表 的 一 律 标 准 (0.01 mg/kg)。分别对酥梨、柑橘、苹果、猕猴桃、葡萄等5种水果样品进行4个水平的加标回收率测定,回收率为71.2%~122.4%,RSD 为0.5%~8.9%(见表3)。
2.5 实际样品分析
按本文建立的方法对市售的20批酥梨、14批柑橘、29批猕猴桃、15批苹果、10批葡萄样品中的5种咪唑类农药进行测定。每批样品从称样到检测完毕只需40 min,与传统固相萃取-LC-MS/MS检测相比样品分析时间缩短约3 h。
实际检测结果显示,在大部分猕猴桃、苹果、酥梨、葡萄样品中没有检出这5种咪唑类农药,在10批柑橘样品中检出咪鲜胺,含量为0.096~0.5 mg/kg,推测在柑橘生长过程中使用了咪鲜胺进行炭疽病的防治。
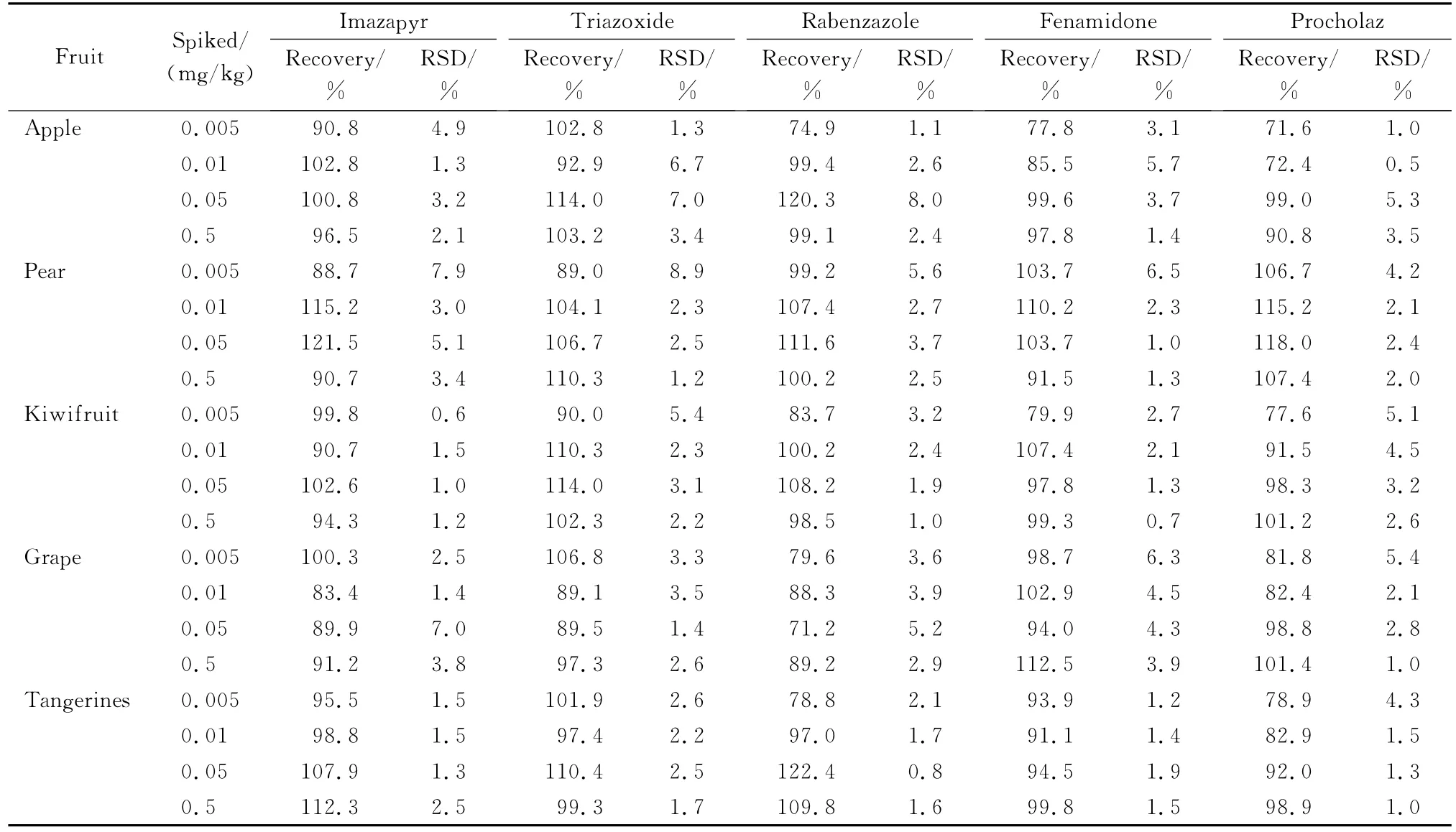
表3 5种水果中5种咪唑类农药的回收率及相对标准偏差(n=5)Table 3 Recoveries and relative standard deviations(RSDs)of the five imidazole pesticidesspiked in five kinds of fruit samples(n=5)
3 结论
建立了Turbo flow-超高效液相色谱-串联质谱同时测定水果中吡咪唑、咪唑烟酸、咪鲜胺、咪唑嗪和咪唑菌酮等5种咪唑类农药的检测方法。在优化条件下,5种咪唑类农药在40 min内完成样品前处理和样品测定,且在色谱分离中达到良好分离,其定量限均可达到0.005 mg/kg。该方法快速、简单,灵敏度高,稳定性好,能很好的应用于实际水果样品中咪唑类农药的日常检测。
[1] Li F,Hu J M,Li F G,et al.Chinese Journal of Health Laboratory Technology(李芳,胡建民,李锋格,等.中国卫生检验杂志),2011,2(10):2416
[2] Liu X C,Chen P,Shen J,et al.Journal of Analytical Science(柳训才,陈平,沈菁,等.分析科学学报),2007,23(5):523
[3] Li C,Suo R,Wang F C,et al.Chinese Journal of Chromatography(李成,锁然,王凤池,等.色谱),2008,26(6):726
[4] Zhao Z Y,Shi Z H,Kang J,et al.Chinese Journal of Chromatography(赵志远,石志红,康健,等.色谱),2013,31(4):372
[5] Chen X L,Li Z X,Cao Z Y,et al.Chinese Journal of Chromatography(陈小龙,李正翔,曹赵云,等.色谱),2013,31(10):945
[6] Huang J R,Kong X H,Yao B H,et al.Chinese Journal of Chromatography(黄江锐,孔祥虹,姚秉华,等.色谱),2011,29(10):974
[7] Mou Y L,Guo D H,Ding Z P.Chinese Journal of Chromatography(牟艳莉,郭德华,丁卓平.色谱),2013,31(10):1016
[8] Xu X L,Zhao H X,Li L,et al.Chinese Journal of Chromatography(许秀丽,赵海香,李礼,等.色谱),2012,30(3):267
[9] Ouyang Y F,Tang H B,Wu Y,et al.Chinese Journal of Chromatography(欧阳运富,唐宏兵,吴英,等.色谱),2012,30(7):654
[10] Ma Z L,Zhao W,Li L Y,et al.Chinese Journal of Chromatography(马智玲,赵文,李凌云,等.色谱),2013,31(3):228
[11] Lin H D,Zou Z F,Qin Y,et al.Chinese Journal of Chromatography(林海丹,邹志飞,秦燕,等.色谱),2013,31(2):170
[12] Song Y.[MS Dissertation].Beijing:Chinese Academy of Agriculture Sciences(宋莹.[硕士学位论文].北京:中国农业科学院),2011
[13] Lehotay S J,de Kok A,Hiemstra M,et al.J AOAC Int,2005,88(2):595
[14] Paya P,Anastassiades M,Mack D,et al.Anal Bioanal Chem,2007,389(6):1697
[15] Shi Y,Lafontaine C,Berube M,et al.Thermo Scientific Application Note 568.[2014-02-17].http:/www.cohesivetech.Com/publications/search-publications/articles_detail.cfm?file_id=239&mode=list&author=&keywords=
[16] Garcia-Galan M J,Diaz-Cruz M S ,Barcelo D. Talanta,2010,81:355
[17] Fayad P B,Prévost M,SauvéS.Talanta,2013,115:349
[18] Liu R Z,Ruan T,Wang T,et al.Talanta,2014,120:158
