高效液相色谱法同时测定食品接触材料中抗氧化剂和紫外吸收剂的迁移量
2014-05-08李成发陈枝楠陈旭辉吴绍精李泳涛孙小颖
李成发, 李 英, 陈枝楠, 梁 烽, 陈旭辉,吴绍精, 李泳涛, 孙小颖
(1.深圳出入境检验检疫局,广东 深圳518067;2.深圳市检验检疫科学研究院,广东 深圳518067)
近年来,塑料制品广泛应用于食品接触材料中。塑料制品在生产和使用过程中易发生氧化和分解,抗氧化剂和紫外吸收剂因能有效地延迟塑料制品的氧化和分解而被广泛地加入到塑料制品中[1]。如果塑料制品用于包装食品,这些抗氧化剂和紫外吸收剂及其分解产物就会从塑料制品中迁移到食品中。我国国标 GB9685-2008[2]和欧盟指令(EU)No 10/2011[3]均列出了塑料制品中可能迁移的化合物和其向食品或食品模拟物中的特定迁移量。
在以往的文献报道中,虽然液相色谱法为主要的分析抗氧化剂和紫外吸收剂的方法[4-7],但气相色谱法(GC)[8]、气相色谱-质谱法(GC-MS)[9,10]和液相色谱-质谱法(LC-MS)[11,12]也常用于分析抗氧化剂和紫外吸收剂。文献[13-18]采用不同的实验条件和分析步骤研究了抗氧化剂和紫外吸收剂的迁移水平。在上述方法中,一些方法考察了抗氧化剂和/或紫外吸收剂向一种食品模拟物的迁移情况,少量的方法依据指令85/572/EEC[19]考察了向4种食品模拟物的迁移情况,这些方法均不能满足欧盟指令(EU)No 10/2011的要求。塑料制品中含有大量的抗氧化剂和紫外吸收剂,但在上述方法中有的仅测定了少量的抗氧化剂和/或紫外吸收剂,有的检测时间较长。建立一种简单、快速、准确测定塑料制品中多种抗氧化剂和紫外吸收剂的检测方法已成为亟待解决的问题。
在本文中,主要研究了13种抗氧化剂和10种紫外吸收剂,所用食品模拟物包括30 g/L 乙酸、10%(v/v)乙醇、20%(v/v)乙醇、50%(v/v)乙醇和异辛烷。本工作采用液液萃取进行样品前处理,然后用配有二极管阵列检测器的高效液相色谱(HPLC-DAD)作为检测手段测定了商业塑料制品中抗氧化剂和紫外吸收剂的迁移水平。
1 实验部分
1.1 仪器与试剂
正己烷(色谱纯,荷兰J.T.Baker公司);乙腈、四氢呋喃、异辛烷(均为色谱纯,美国Fisher公司);乙醇、氯化钠和冰醋酸(均为分析纯,国药集团化学试剂有限公司);实验用水为经Milli-Q系统净化的超纯水。
抗氧化剂和紫外吸收剂的化学名称、化学文摘社登记号(CAS No.)、特定迁移量及来源见表1。准确称取BP-8、BHA、BP、BP-3、Antioxidant 300、Irganox MD 1024、 BHT、 Antioxidant BHEB、Antioxidant 2246、Antioxidant CA、Irganox 3052、Antioxidant ZKF、Chimassorb 81、Antioxidant 1035、Tinuvin 329、Irganox 129、Irganox 3114、Tinuvin 328各12.5 mg,置于25 mL棕色容量瓶中,用乙腈溶解稀释至刻度,混匀;准确称取Tinuvin P、Irganox 697、Tinuvin 326、Tinuvin 327、Tinuvin 1577各12.5 mg于25 mL棕色容量瓶中,用体积比为25∶75的乙腈和四氢呋喃混合溶液溶解稀释至刻度,混匀。该2种储备溶液的浓度均为500 mg/L。冷藏避光密闭保存。

表1 23种抗氧化剂和紫外吸收剂的来源Table 1 Sources of the 23 antioxidants and UV absorbents

表1 (续)Table 1 (Continued)
LC-20A液相色谱仪(日本岛津公司),包括LC-20AD四元泵、SPD-M20A二极管阵列检测器、SIL-20AC自动进样器、CMB-20A控制系统;旋转蒸发仪(Hei-VAP,德国 Heidolph公司);旋涡混合器(MS3,德国IKA公司);分析天平(CPA324S,德国Sartorius公司)。
1.2 特定迁移测试
根据待测样品的预期用途和使用条件,按BS EN13130-1:2004[20]的迁移试验方法及试验条件,分别用10%乙醇(模拟物A)、和30 g/L 乙酸(模拟物B)、20%乙醇(模拟物C)、50%乙醇(模拟物 D1)和异辛烷(模拟物D2)浸泡样品。
1.3 液液萃取
液液萃取在50 mL的具塞试管中进行。准确移取25 mL经迁移测试的模拟液(A、B、C)于预装有适量NaCl的50 mL具塞试管中,正己烷作为萃取溶剂,涡旋萃取。考察萃取时间、涡旋速度、NaCl的质量等条件对抗氧化剂和紫外吸收剂回收率的影响。溶液分别萃取两次,静置5 min后,将正己烷收集到蒸馏瓶中,在20 kPa和30℃的条件下蒸至近干;对50%乙醇模拟物:量取10 mL经迁移测试的50%乙醇模拟液于预装有适量NaCl的50 mL具塞试管中,再加入15 mL水后重复上述的萃取过程;对异辛烷模拟物:直接量取25 g经迁移测试的异辛烷于蒸馏瓶中,在15 kPa和48℃的条件下蒸至最后一滴。然后用1 mL的乙腈溶解,供液相色谱检测。
1.4 色谱条件
采 用 Zorbax Eclipse XDB-C18 色 谱 柱 (250 mm×4.6 mm,5μm)于35℃条件下分离。流动相A:乙腈;流动相B:水。梯度洗脱程序:0~10 min,73%A;10~15 min,73%A~87%A;15~20 min,87%A~95%A;20~42 min,95%A~100%A;42~43 min,100%A~73%A。检测波长为276 nm,进样体积为20μL。
2 结果与讨论
2.1 线性关系、检出限和定量限
按照1.4节色谱条件得到的液相色谱图见图1。通过与标准样品中每个峰的保留时间进行比较对分析物定性;以标准样品的峰面积为纵坐标,质量浓度为横坐标绘制标准工作曲线(包含至少5点)对分析物进行定量,所有化合物均具有较好的线性关系(相关系数(r2)≥0.999 8)。本实验选取不含有23种目标物的塑料作为空白样品,用10%乙醇模拟液按1.2节进行浸泡和按1.3节进行前处理得到的乙腈溶液稀释标准溶液至信噪比(S/N)=10为定量限(LOQ),S/N=3为检出限(LOD)。LOD和LOQ的最大值分别为Irganox MD1024的0.22 mg/L 和0.85 mg/L,最小值为:BP-8和 Tinuvin 1577的0.01 mg/L 和0.03 mg/L。详细的线性方程、线性范围、LOD和LOQ见表2。
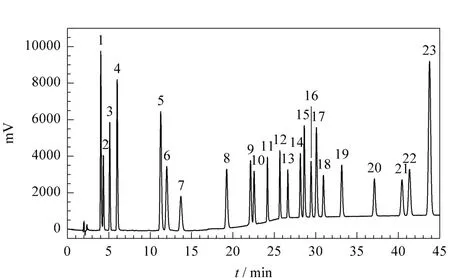
图1 抗氧化剂和紫外吸收剂的色谱图Fig.1 Chromatogram of standard antioxidants and UV absorbentsFor peak identifications,see Table 1.
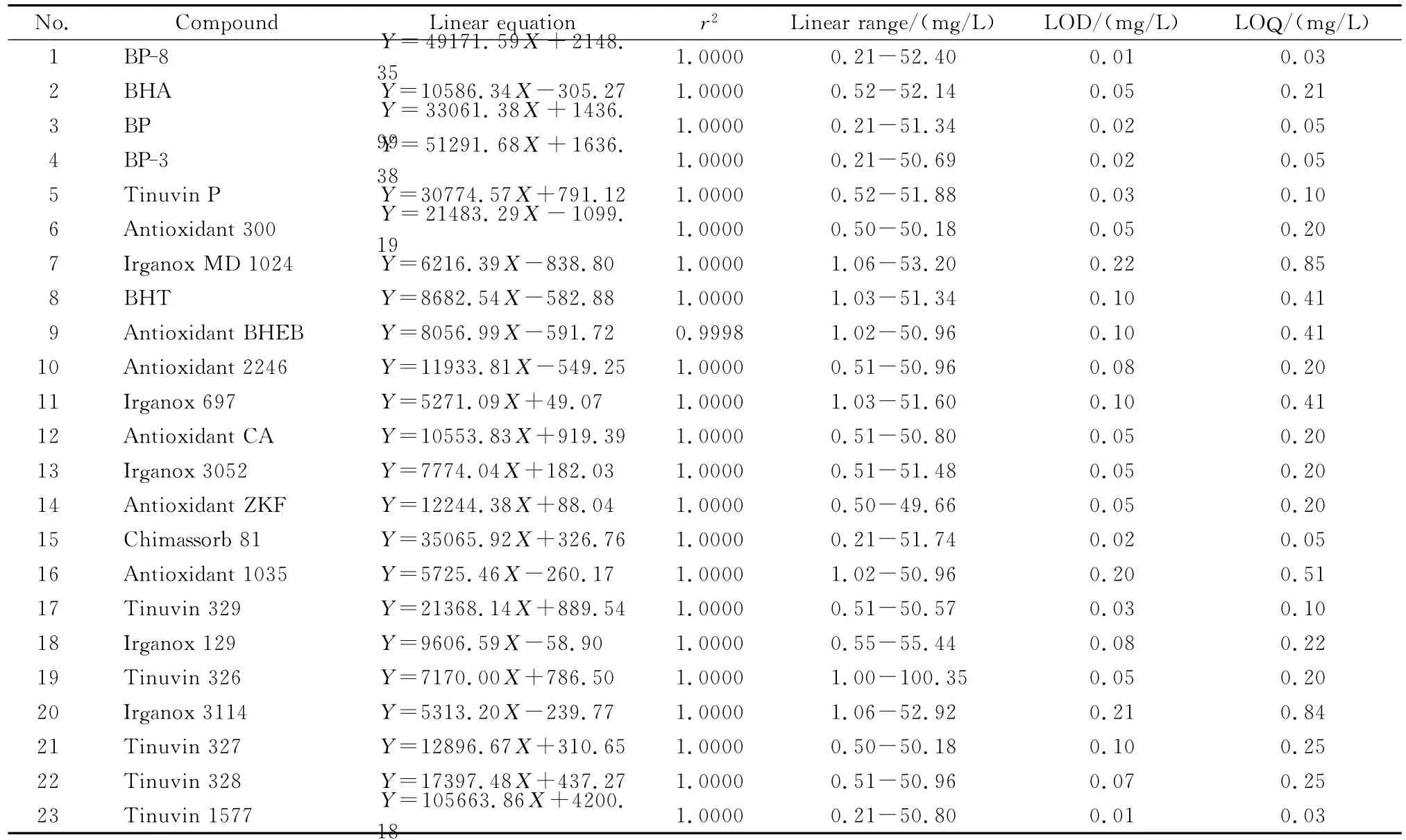
表2 23种分析物的线性方程、相关系数(r2)、线性范围、检出限和定量限Table 2 Linear equations,correlation coefficients(r2),linear ranges,limits of detection(LODs,S/N=3),and limits of quantification(LOQs,S/N=10)for the 23 compounds
2.2 萃取条件的优化
选取25 mL添加一定量的抗氧化剂和紫外吸收剂的10%(v/v)乙醇溶液进行分析。考察了3个萃取条件对加标回收的影响:萃取时间、涡旋速度和NaCl的质量。
2.2.1 涡旋速度对回收率的影响
BP、BP-3、BP-8、Chimassorb 81、Tinuvin 1577的添加质量浓度为0.01 mg/L,BHA、Tinuvin P、Antioxidant 300、Antioxidant 2246、Antioxidant CA、Irganox 3052、Antioxidant ZKF、Tinuvin 329、Irganox 129、Tinuvin 327、Tinuvin 328的添加质量浓度为0.02 mg/L,Irganox MD1024、BHT、Antioxidant BHEB、Irganox 697、Antioxidant 1035、Tinuvin 326、Irganox 3114的添加质量浓度为0.04 mg/L,萃取时间为2 min,5 mL正己烷(加1 g NaCl)萃取一次。以涡旋速度为横坐标,加标回收率为纵坐标作折线图。图2为BP-8、Tinuvin 1577、BHT、Antioxidant BHEB和Antioxidant 300的折线图。从图2中可以看出,BP-8和BHT在涡旋速度小于 1 500r/min时,回收率随着涡旋速度的增大而逐渐增大;当涡旋速度大于1 500 r/min时,变化较小,BP-8和BHT的回收趋于平衡。Tinuvin 1 577、Antioxidant BHEB和Antioxidant 300在涡旋速度小于 2 500 r/min时,回收率随着涡旋速度的增大而逐渐增大;当涡旋速度大于 2 500 r/min时,变化较小,Tinuvin 1577、Antioxidant BHEB和Antioxidant 300的回收趋于平衡。因此,为获得较好的回收率,涡旋速度应不小于2 500 r/min。
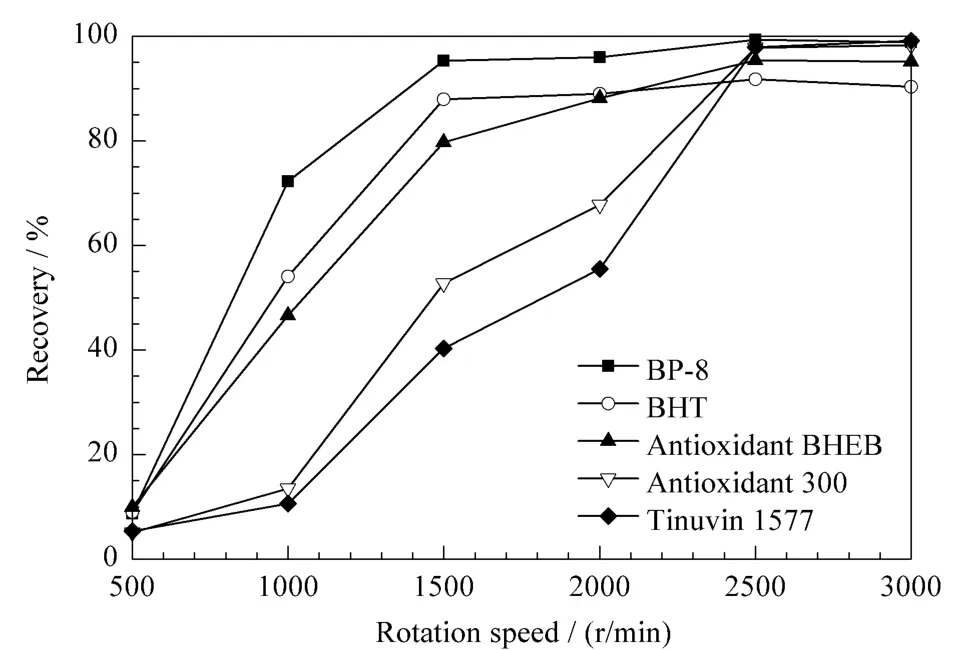
图2 涡旋速度对回收率的影响Fig.2 Effects of rotation speed on the recovery
2.2.2 萃取时间对回收率的影响
23种目标物的添加浓度同2.2.1节,涡旋速度为 2 500 r/min,5 mL正己烷(加1 g NaCl)萃取一次。以萃取时间为横坐标,加标回收率为纵坐标作折线图。图3是 BP-8、Tinuvin P、Irganox 3052和Tinuvin 328的折线图。可以看出,BP-8和Tinuvin P的回收率随着萃取时间的延长变化不大;而Irganox 3052和Tinuvin 328在萃取时间小于3 min时,回收率随着萃取时间的延长而增大,当萃取时间大于3 min,回收率变化不大,趋于平衡。为了获得较好的回收率,萃取时间应不小于3 min。
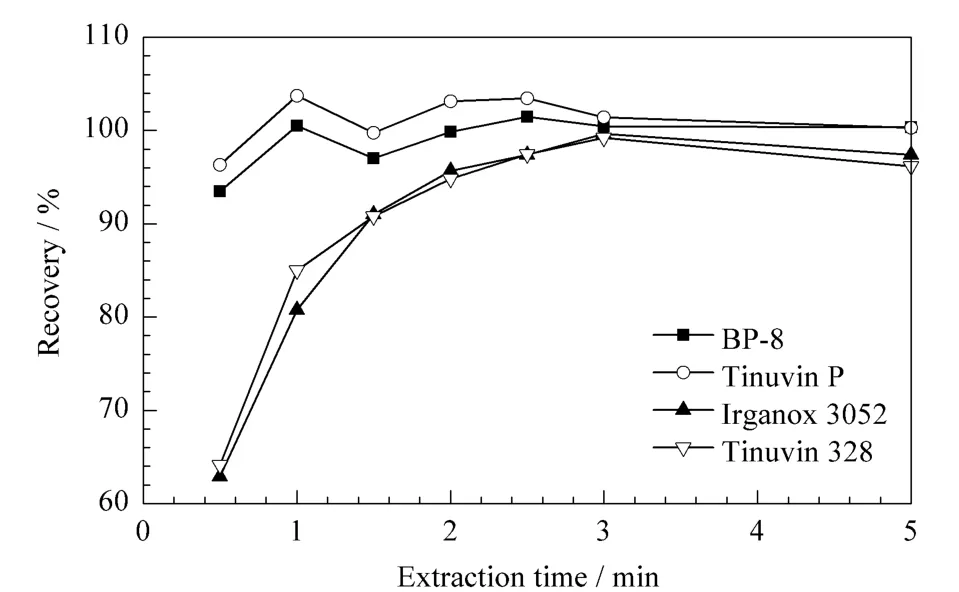
图3 萃取时间对回收率的影响Fig.3 Effects of extraction time on the recovery
2.2.3 NaCl质量对回收率的影响
在实验中发现,在不添加NaCl的情况下,水相和正己烷相的分离不好,因此本实验向水模拟液中加入NaCl以改进分离效果。本实验中23种目标物的添加浓度同2.2.1节,涡旋速度为 2 500 r/min,5 mL正己烷,萃取时间3 min,结果表明NaCl的质量对23种化合物的回收率影响较小。选取了BP-8、Irganox 3052和 Tinuvin 327的实验数据,以NaCl的质量为横坐标,回收率为纵坐标作折线图。从图4中可以看出,当NaCl的质量为1.0 g时,上述3种化合物均能得到较好的回收率,因此本实验选取NaCl的质量为1.0 g。
2.2.4 乙醇含量对回收率的影响
为了得到较好的回收率,整个萃取过程进行两次。按照上述最优化的萃取条件,对30 g/L乙酸、20%乙醇和50%乙醇模拟液进行了考察。实验发现30 g/L乙酸、20%乙醇模拟液中23种目标化合物均能得到较好的回收率,而50%模拟液中部分化合物的回收率较差。因此,又考察了乙醇含量对回收率的影响。结果表明,乙醇的含量对BP-8、BHA、BP、BP-3、Antioxidant 300、Irganox MD1024、Irganox 697、Antioxidant CA的回收率有较大影响(见图5),对其余化合物的回收率均没有较大的影响。当乙醇的含量小于等于20%时,上述8种化合物的回收率变化不大;当乙醇的含量增大到30%时,BHA的回收率降低至90%左右;当乙醇的含量继续增大到50%时,上述8种化合物的回收率逐渐减小。为了得到较好的回收率,50%的乙醇模拟液应稀释至20%后再进行萃取。
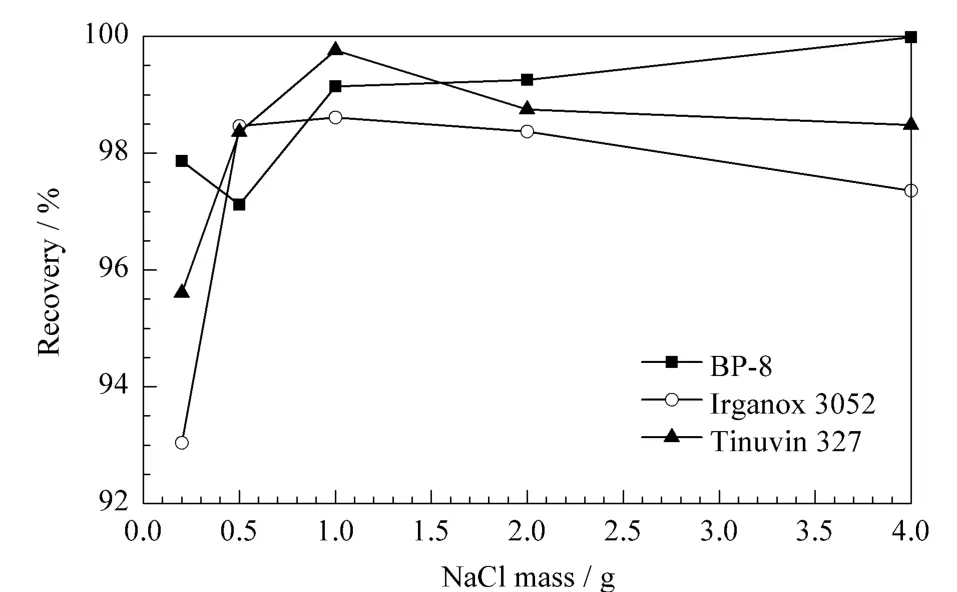
图4 NaCl的质量对回收率的影响Fig.4 Effects of NaCl mass on the recovery
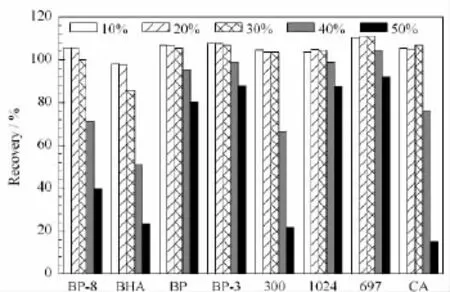
图5 乙醇含量对回收率的影响Fig.5 Effects of ethanol content on the recovery
2.3 回收率和精密度
精密度常随着分析物的浓度和基质类型的不同而不同,本工作采用样品加标的方式进行抗氧化剂和紫外吸收剂的回收率试验。按照严苛的迁移试验原则[20],分别取适量食品模拟物添加3个不同浓度的23种抗氧化剂和紫外吸收剂进行加标回收试验,每个水平平行测定7次,实验数据见表3。从表3可以看出,23种分析物的回收率在92.8%(BHT,添加量为1.03μg,10%乙醇模拟液)和117.7%(Tinuvin 328,添加量为0.51μg,异辛烷模拟液)之间;相对标准偏差在0.95%(BP-8,添加量为2.62 μg,10%乙醇模拟液)和9.72%(Tinuvin 328,添加量为0.51μg,异辛烷模拟液)之间。说明本方法测定23种分析物具有较好的回收率和精密度。
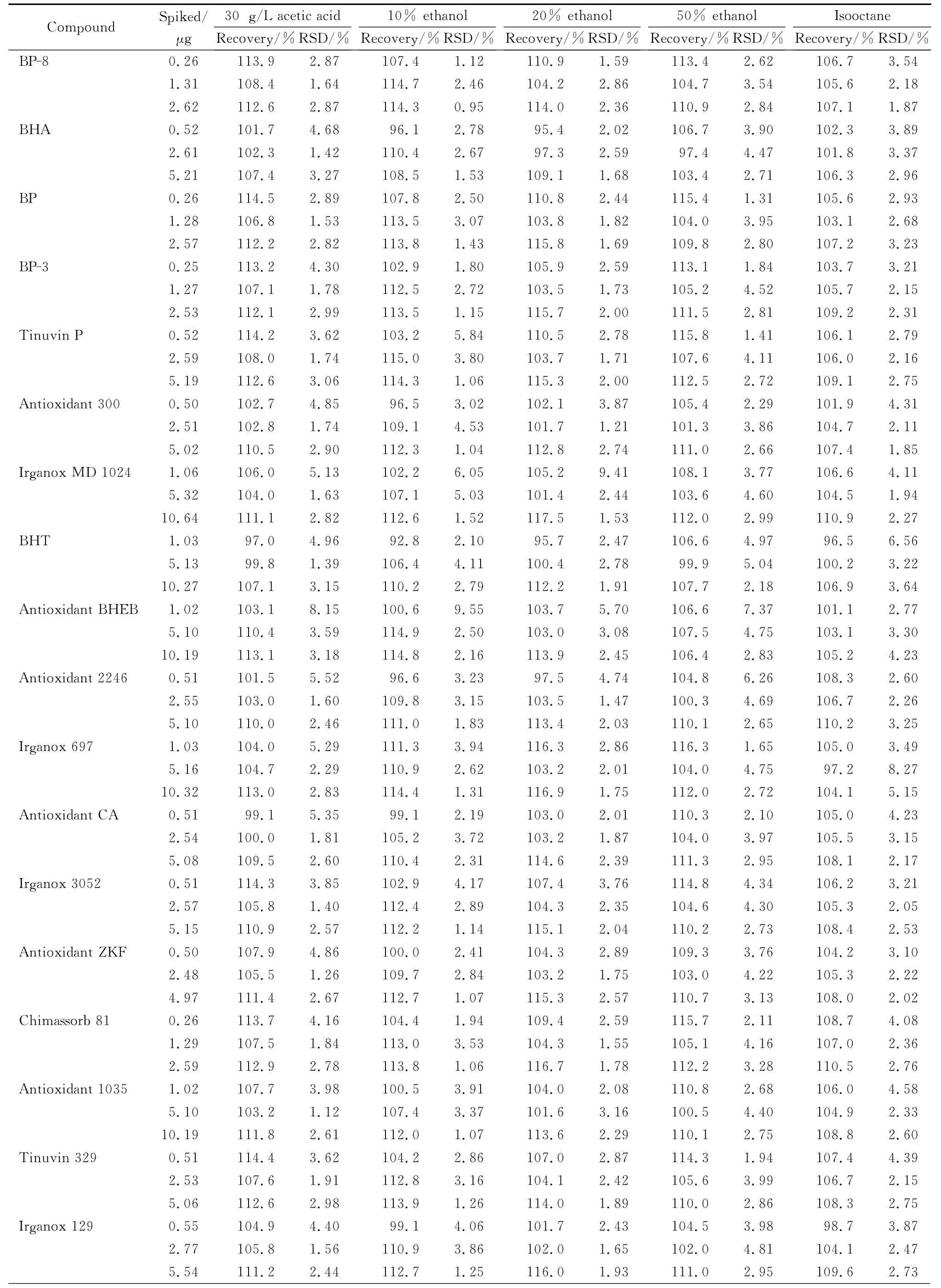
表3 23种抗氧化剂和紫外吸收剂在不同模拟液中的回收率与精密度Table 3 Recoveries and precisions of the 23 antioxidants and UV absorbents in different food simulants
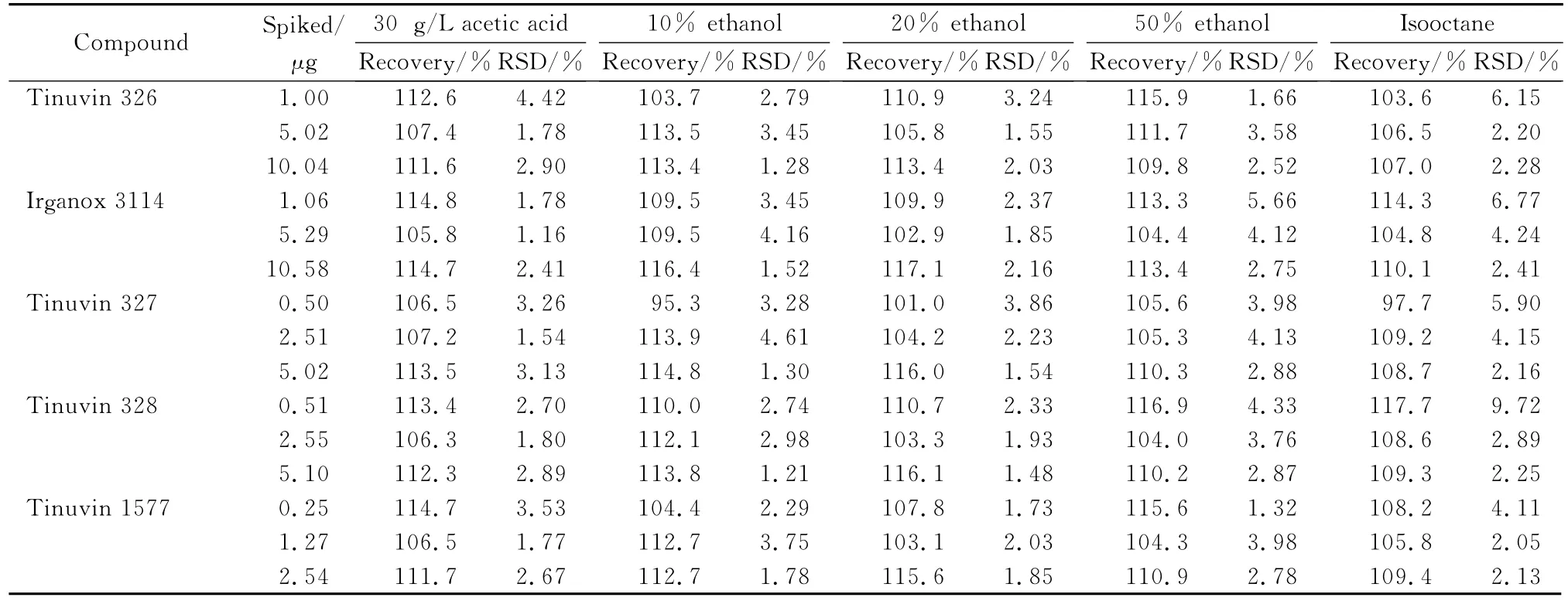
表3 (续)Table 3 (Continued)
2.4 迁移水平的测定
用该方法分别检测了包括聚丙烯蛋糕托盘、尼龙铲、聚苯乙烯叉子、聚乙烯包装袋、安抚奶嘴等具代表性的食品接触材料样品中抗氧化剂和紫外吸收剂的迁移量,共30批次。在聚乙烯包装袋的异辛烷模拟物中检出BHT,在安抚奶嘴的异辛烷模拟物中检出Antioxidant 2246,上述两种物质的含量较低,均低于限量要求。而在其他模拟物中均未检出,说明上述化合物较容易在异辛烷模拟物中检出,因此塑料包装材料不适合装油或油类食品。
3 结论
本文采用HPLC技术建立了一种简单、快速测定塑料制品中多种抗氧化剂和紫外吸收剂迁移量的方法。该方法具有较好的线性关系、精密度和回收率,该方法的检出限和定量限分别在0.01至0.22 mg/L和0.03至0.85 mg/L 之间。依据欧盟指令(EU)No 10/2011,考察了5种食品模拟物包括30 g/L乙酸、10%(v/v)乙醇、20%(v/v)乙醇、50%(v/v)乙醇和异辛烷中的迁移水平。考察了30个批次不同材质的样品的迁移水平,仅在异辛烷模拟物中检出BHT和Antioxidant 2246。虽然上述23种目标物在本文选取的塑料制品中测定值较低,但在其他市售的塑料制品中仍有较大的风险[14,15]。因此,在今后的工作中,本实验室将测定更多的样品,考察不同的实验条件如时间、温度等多种因素对抗氧化剂和紫外吸收剂迁移的影响,找出抗氧化剂和紫外吸收剂在不同材质中的迁移规律,为将来测定抗氧化剂和紫外吸收剂提供理论基础和数据支持。
[1] Lau O W,Wong S K.J Chromatogr A,2000,882(1/2):255
[2] GB9685-2008
[3] Commission Regulation(EU)No 10/2011
[4] Lin Q B,Li B,Song H,et al.J Liq Chromatogr R T,2011,34(9):730
[5] Dopico-Garcia M S,Lopez-Vilarino J M,Gonzalez-Rodriguez M V.Talanta,2005,66(5):1103
[6] Zenker A,Schmutz H,Fent K.J Chromatogr A,2008,1202(1):64
[7] Zhang J Z,Li J,Shao D L,et al.Chinese Journal of Chromatography(张居舟,李静,邵栋梁,等.色谱),2012,30(2):190
[8] Xiong Z Q,Wang L B,Li N T,et al.Chinese Journal of Chromatography(熊中强,王利兵,李宁涛,等.色谱),2011,29(3):273
[9] Camacho W,Karlsson S.Polym Degrad Stabil,2001,71(1):123
[10] Liu P Y,Huang E J,Chen Y J.Chinese Journal of Chromatography(刘芃岩,黄恩洁,陈艳杰.色谱),2012,30(12):1235
[11] Himmelsbach M,Buchberger W,Reingruber E.Polym Degrad Stabil,2009,94(8):1213
[12] Negreira N,Rodriguez I,Ramil M,et al.Anal Chim Acta,2009,654(2):162
[13] Dopico-Garcia M S,Lopez-Vilarino J M,Gonzalez-Rodriguez M V.J Chromatogr A,2003,1018(1):53
[14] Gao Y L,Gu Y X,Wei Y.J Agric Food Chem,2011,59(24):12982
[15] Dopico-Garcia M S,Lopez-Vilarino J M,Gonzalez-Rodriguez M V.J Agric Food Chem,2007,55(8):3225
[16] Alin J,Hakkarainen M.J Agric Food Chem,2011,59(10):5418
[17] Nerin C,Fernandez C,Domeno C,et al.J Agric Food Chem,2003,51(19):5647
[18] Jeon D H,Park G Y,Kwak I S,et al.LWT-Food Sci Technol,2007,40(1):151
[19] Council Directive 85/572/EEC
[20] British Standard EN13130-1:2004
