重组人促红细胞生成素后处理对肢体缺血再灌注诱发大鼠肾损伤的影响
2014-05-08陆佳伟缪惠东顾红星薛亚岗
陆佳伟,缪惠东,顾红星,薛亚岗
(苏州大学附属张家港市第一人民医院,江苏苏州215600)
肢体缺血再灌注损伤(IRI)是较常见的病理变化,其不仅加重局部组织损伤,而且可致心、脑、肝脏等远隔器官功能障碍[1]。近年来,缺血后处理在IRI保护机制中的作用逐渐受到人们重视,但其对再灌注导致的远隔器官损伤有无保护作用,目前少见这方面的研究。2012~2013年,我们观察了重组人促红细胞生成素(rHu-EPO)后处理对肢体缺血再灌注(RI)诱发大鼠肾损伤的影响,并探讨核转录因子-κB 亚基 p65 亲和肽(NF-κB p65)、TNF-α 在其中的作用。现报告如下。
1 材料与方法
1.1 材料 健康成年雄性SD大鼠30只,体质量240~250 g(江苏大学实验动物中心提供)。血尿素氮(BUN)、肌酐(Cr)、超氧化物歧化酶(SOD)、丙二醛(MDA)、TNF-α的ELISA试剂盒(南京建成生物研究所提供)。兔NF-κB p65多克隆抗体、DAB显色试剂盒、即用型SABC染色试剂盒(武汉博士德生物公司提供)。rHu-EPO购自成都地奥公司。
1.2 方法
1.2.1 模型制备 将30只大鼠随机分为假手术组、肢体IR组、rHu-EPO后处理组(rHu-EPO组)各10只。大鼠禁食 12 h,自由进水。参照文献[2,3]方法制作大鼠肢体缺血模型,先行戊巴比妥钠腹腔麻醉,然后在其双后肢中、上1/3处用止血带结扎10 min,结扎远端皮肤呈绛紫色为后肢缺血成功;松开止血带后远端皮肤恢复红润为后肢再灌注成功。肢体IR组在双后肢结扎缺血4 h后松开止血带,恢复血流再灌注2 h取标本;假手术组松开止血带不阻断血流,其余步骤同肢体IR组;rHu-EPO组在双后肢结扎4 h后、再灌注前腹腔注射rHu-EPO 3 000 U/kg,恢复血流再灌注2 h后取标本。
1.2.2 标本留取 再灌注2 h后,迅速打开3组大鼠腹腔,于腹主动脉处取血4 mL后处死动物。将血液置于抗凝管内静置4 h,以4 500 r/min离心15 min,分离血清置于-20℃保存。分离3组右肾周围结缔组织,以4℃冰生理盐水冲洗表面血液,将右肾纵剖成两份,一份制备成10%的组织匀浆,一份用4%多聚甲醛固定后行石蜡切片,用于病理分析及肾组织NF-κB p65检测。
1.2.3 各指标检测 ①肾功能:采用化学比色法检测血清BUN及Cr。②肾组织氧化损伤和抗氧化指标:采用黄嘌呤氧化酶法检测SOD活性,硫代巴比妥酸法检测MDA,酶联免疫吸附法检测TNF-α。③组织学变化:将石蜡切片常规切片4 μm厚,行HE染色后,在光镜下观察组织学改变。④NF-κB p65蛋白表达:采用免疫组化法。将标本切片先后行脱蜡至水化、小牛血清封闭、滴加一抗、孵育、加二抗、加SABC工作液、DAB显色,行复染、透明、封固后在光镜下进行观察,细胞质或细胞核内有棕色颗粒沉积为NF-κB p65表达阳性。以已知阳性片作为阳性对照,用PBS代替一抗作为阴性对照。染色标记强度用光密度值(OD)表示。以上检测步骤均严格按照其试剂盒说明书要求进行。
1.2.4 统计学方法 采用 SPSS11.0统计软件,数据以±s表示,多组比较用单因素方差分析,组间两两比较用q检验。P≤0.05为差异有统计学意义。
2 结果
2.1 3组血清BUN、Cr比较 见表1。
表1 3组血清 BUN、Cr比较(±s)

表1 3组血清 BUN、Cr比较(±s)
注:与假手术组比较,▲P <0.05;与肢体 IR组比较,△P <0.05
组别 n BUN(mmol/L) Cr(μmol/L)10 7.05 ±1.03 62.53 ±3.49肢体 IR 组 10 15.13±0.95▲ 85.28±5.50▲rHu-EPO 组 10 10.38±0.97▲△ 78.44±3.18假手术组▲△
2.2 3组肾组织中的 SOD、MDA、TNF-α比较 见表2。
表2 3组肾组织中的 SOD、MDA、TNF-α比较(±s)
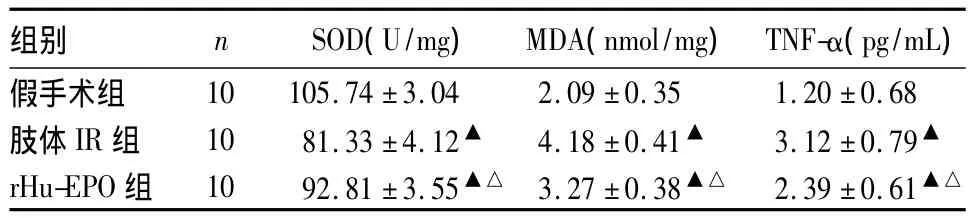
表2 3组肾组织中的 SOD、MDA、TNF-α比较(±s)
注:与假手术组比较,▲P <0.05;与肢体 IR组比较,△P <0.05
组别 n SOD(U/mg) MDA(nmol/mg) TNF-α(pg/mL)10 105.74 ±3.04 2.09 ±0.35 1.20 ±0.68肢体 IR 组 10 81.33±4.12▲ 4.18±0.41▲ 3.12±0.79▲rHu-EPO 组 10 92.81±3.55▲△ 3.27±0.38▲△ 2.39±0.61假手术组▲△
2.3 3组肾组织病理变化 假手术组肾小管及间质组织结构基本正常;肢体IR组肾小管上皮细胞肿胀,细胞管型形成,大量炎性细胞浸润,部分细胞变性坏死,细胞崩解;rHu-EPO组肾小管上皮细胞轻度水肿、空泡变性,少见管型,少量炎细胞浸润,个别管腔轻度坏死。
2.4 3组肾组织中的NF-κB p65表达比较 在高倍镜下,假手术组肾小球中无NF-κB p65表达,肾小管上皮细胞中有少量NF-κB p65表达。肢体IR组肾小管上皮细胞中NF-κB p65有明显表达,肾小球中无明显表达。rHu-EPO组肾小管上皮细胞中的NF-κB p65表达较假手术组增多、肢体IR组减少。假手术组、肢体IR组、rHu-EPO组肾组织中NF-κB p65 表达的 OD 值分别为 0.048、0.472、0.306;肢体IR组的NF-κB p65表达明显,rHu-EPO组高于假手术组、但低于肢体IR组(P均<0.05)。
3 讨论
肾脏血液灌流丰富,对缺血缺氧极为敏感。本研究通过制备大鼠双下肢IR模型,发现肢体IR组肾小管上皮细胞肿胀、细胞管型形成、大量炎性细胞浸润,部分细胞变性、坏死、崩解;同时血清BUN、Cr明显升高。提示肢体RI可致大鼠一定程度的肾损伤。
研究发现,大鼠肢体发生RI致肾损伤时,其机体的神经体液等调节失衡,导致不正常信号转导和细胞功能异常,引发一系列凋亡事件和细胞坏死[4,5]。近年研究发现,NF-κB 过度活化是 IRI的重要原因[6]。NF-κB是具有多向性转录激活功能的调节因子,广泛存在于真核细胞中,在基因表达的启动和关闭过程中起重要作用[7]。静息状态下,NF-κB多以p50、p65二聚体及其抑制蛋白ⅠκB相结合的形式存在于细胞质中[8]。内源性或外源性刺激ⅠκB发生磷酸化和降解使NF-κB移位,可能是启动急性炎症发生、发展的关键环节。TNF-α是一种具有多种生物学效应的重要炎症介质,它通过直接细胞毒作用及收缩血管而降低血流,聚集炎性细胞致细胞凋亡,造成组织损伤[9];同时作为细胞外刺激信号激活NF-κB,形成瀑布效应及恶性循环,进一步扩大炎症反应,最终加重再灌注组织及远隔器官损伤。Omoya等[10]研究表明,氧自由基可使ⅠκB减少,核内NF-κB活性增强。组织发生RI时,首先使氧自由基生成、释放增加,激活 NF-κB,然后促进TNF-α等炎性因子转录。IRI后可产生大量氧自由基,引发脂质和蛋白质过氧化生成MDA,其水平高低既直接反映组织内的脂质过氧化程度,又间接反映组织细胞受自由基攻击的损伤程度[11]。SOD作为重要的抗氧化酶,其活性高低反映组织清除氧自由基的能力[12]。
本研究显示,假手术组肾组织及间质组织结构基本正常;肢体IR组肾小管上皮细胞肿胀,大量炎性细胞浸润,部分细胞变性、坏死,肾组织中的MDA升高、SOD活性下降、TNF-α及NF-κB p65表达明显增加,提示NF-κB p65表达、TNF-α水平与大鼠肢体RI诱发肾损伤有密切关系。肢体RI致大量氧自由基产生,引起大鼠自身组织损伤,同时通过血液循环转移至远隔的肾组织激活NF-κB p65,促进TNF-α等炎症因子表达,可能是组织再灌注后引起远隔器官损伤的机制之一。rHu-EPO是由缺氧诱导因子家族诱导产生的多功能细胞因子超家族成员,近年研究发现,其生物学作用包括促进红系祖细胞增殖、分化和成熟,并有抗氧化应激、抗炎症反应、抗凋亡和促进血管新生等作用[13~15]。本研究采用 rHu-EPO对肢体RI进行后处理,发现rHu-EPO组较肢体IR组的血清MDA降低,肾组织中的SOD活性增强,TNF-α及NF-κB p65表达降低,肾功能及肾小管上皮细胞水肿、变性、坏死好转,表明rHu-EPO对大鼠肢体RI诱发的肾损伤有保护作用。在肢体RI导致肾损伤的过程中,rHu-EPO减少氧自由基生成及其引发的脂质过氧化,抑制NF-κB p65表达,使炎症因子TNF-α产生相应减少,可能是其保护肾组织IRI的重要机制之一。本研究为临床治疗和预防组织RI引发的多脏器损伤提供了新的思路。
[1]Yassin MM,Harkin DW,Barros D,et al.Lower limb ischcmlareperfusion injury triggers a systemic inflammatory response and multiple organ dysfunction[J].World J Surg,2002,26(1):115-121.
[2]Selimoglu O,Ugurlucan M,Basaran M,et al.Eficacy of remote ischaemic preconditioning for spinal cord protection against ischaemic injury:association with heat shock protein expression[J].Folia Neuro-pathd,2008,46(3):204-212.
[3]Zhao JL,Fang YJ,Pei WD,et al.Remote periconditioning reduces myoc ardial no-refiow by the activation of KATP channd via inhibition of Rho,kinase[J].Int J Cardiol,2009,133(2):179-184.
[4]王国忠.高压氧在大鼠肢体缺血再灌注致远隔多器官损伤的作用[J].中华实验外科,2006,23(12):1568.
[5]Morsey H,Aslam M,Standfield N.Patients with critical ischenia of the lower limb are at risk of developing kidney dysfunction[J].Am J Surg,2003,185(4):360-363.
[6]Pompermayer K,Souza DG,Lara GG,et al.The ATP-sensitive potassium channel blocker glibenclamide prevents renal ischemia/reperfusion injury in rats[J].Kidney Int,2005,67(5):1785-1796.
[7]Guijarro C,Egido J.Transcription factor kappa B(NF kappa B)and renal disease[J].Kidney Int,2001,59(2):415-424.
[8]Ishikawa H,Claudio E,Dambach D,et al.Chronic inflammation andsusceptibility to bacterial infections in mice lacking the polypeptide(p)105 precursor(NF-κB)but expressing p50[J].J Exp Med,1998,187(8):985-996.
[9]Meldrum KK,Metcalfe P,Leslie JA,et al.TNF-alpha neutralization decreases nuclear factor-kappaB activation and apoptosis during renal obstruction[J].Surg Res,2006,131(2):182-188.
[10]Omoya T,Shimizu I,Zhou Y,et al.Efects of idoxifene and estradiol on NF-κB activation in cultured rat hepatocytes undergoing oxida2 tive stress[J].Liver,2001,21(3):183-191.
[11]Ozkan OV,Yuzbasioglu MF,Ciralik H,et al.Resveratrol,a natural antioxidant,attenuates intestinal ischemia/reperfusion injury in rats[J].Tohoku J Exp Med,2009,218(3):251-258.
[12]张长元,马建群,韩兆乐,等.蝙蝠葛碱对兔心肌缺血再灌注时血清MDA浓度和SOD活性的影响[J].山东医药,2008,48(46):25-27.
[13]雷定和,尹友生.促红细胞生成素潜在细胞保护作用的研究进展[J].右江医学,2009,37(2):340-342.
[14]Funakoshi-Tago M,Pelletier S,Moritake H,et al.Jak2 FERM domain interaction with the erythropoietin receptor regulates Jak2 kinase activity[J].Mol Cell Biol,2008,28(5):1792-1801.
[15]Kamishimoto J,Tago K,Kasahara T,et al.Akt activation through the phosphorylation of erythropoietin receptor at tyrosine 479 is required for myeloproliferative disorder-associated JAK2V617F mutant-induced cellular transformation[J].Cell Signal,2011,23(5):849-856.
