IP方案化疗对小细胞肺癌患者血清VEGF及内皮抑素的影响
2014-05-08魏萍
魏 萍
(临沂市肿瘤医院,山东临沂276001)
小细胞肺癌(SCLC)是肺癌的一种特殊类型,具有转移早、复发快、病死率极高的特点。研究发现,肺癌血管新生和生长是肿瘤扩散、转移的重要前提。血管内皮生长因子(VEGF)是重要的促肿瘤血管生成因子,内皮抑素是重要的血管生成抑制因子,二者相互拮抗、相互依存,共同调节血管生成。为探讨IP化疗方案对SCLC患者血清VEGF、内皮抑素的影响,我们进行了相关研究。现报告如下。
1 资料与方法
1.1 临床资料 选择2011年11月~2013年1月在我院内科住院的初治SCLC患者45例(观察组),均经病理或细胞学检查确诊。其中男30例、女15例,年龄42~70岁、中位年龄54岁,吸烟37例、不吸烟8例。临床分期为局限期17例,广泛期28例;身体状况评分0~l分;有可测量的病灶,预计生存期3个月以上,排除脑转移者。另选同期健康查体者20例作为对照组,其性别、年龄与观察组有可比性。
1.2 方法
1.2.1 治疗方法 观察组用IP方案化疗,即伊立替康(CPT-11)60 mg/m2静滴,第 1、8、15天;顺铂(DDP)60 mg/m2分3 d静滴,第1~3天;28 d为一周期,2个周期后评价疗效。
1.2.2 检测方法 抽取观察组化疗前后(对照组查体时)清晨空腹静脉血5 mL,室温放置30 min后,3 000 r/min离心10 min,分离血清1 mL,在 -80℃低温下冷冻备用。采用ELISA法检测血清VEGF、内皮抑素水平。
1.2.3 疗效评价 参照RECIST标准评价疗效:完全缓解(CR)为目标病灶消失;部分缓解(PR)为基线病灶长径总和缩小≥30%;稳定(NC)为基线病灶长径总和缩小但未达PR,或增加但未达进展(PD);PD为基线病灶长径总和增加≥20%或出现新病灶。CR+PR+NC为临床受益。
1.2.4 统计学方法 采用SPSS13.0统计软件,计量数据以±s表示,组间比较用t检验或方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 观察组化疗前与对照组血清VEGF、内皮抑素比较 观察组化疗前血清VEGF、内皮抑素分别为(568.93 ± 132.32)pg/mL、(121.95 ± 35.64)ng/mL,对照组分别为(115.54 ±23.27)pg/mL、(62.82±8.71)ng/mL,两组 VEGF、内皮抑素比较 P均 <0.01。
2.2 SCLC患者血清VEGF、内皮抑素水平与临床病理参数的关系 见表1。
表1 SCLC患者VEGF、内皮抑素水平与临床参数的关系(±s)
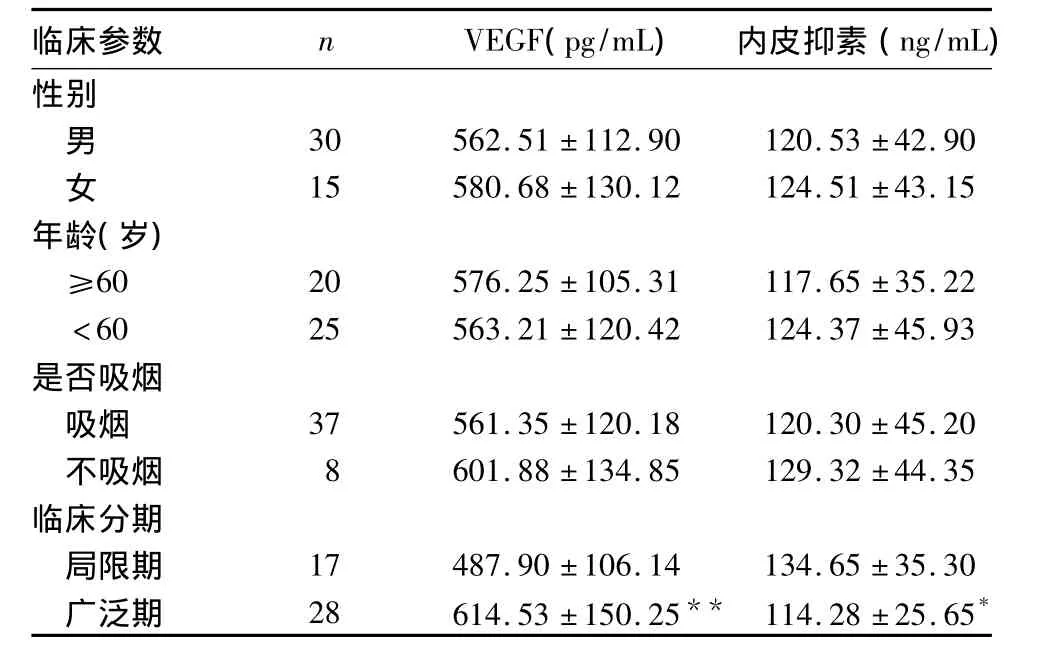
表1 SCLC患者VEGF、内皮抑素水平与临床参数的关系(±s)
注:与同类参数比较,*P <0.05,**P <0.01
性别男)30 562.51 ±112.90 120.53 ±42.90女15 580.68 ±130.12 124.51 ±43.15年龄(岁)≥60 20 576.25 ±105.31 117.65 ±35.22<60 25 563.21 ±120.42 124.37 ±45.93是否吸烟吸烟 37 561.35 ±120.18 120.30 ±45.20不吸烟 8 601.88 ±134.85 129.32 ±44.35临床分期局限期 17 487.90 ±106.14 134.65 ±35.30广泛期 28 614.53 ±150.25** 114.28 ±25.65*
2.3 不同疗效SCLC患者化疗前后的血清VEGF、内皮抑素比较 见表2。
表2 不同疗效SCLC患者化疗前后的血清VEGF、内皮抑素比较(±s)

表2 不同疗效SCLC患者化疗前后的血清VEGF、内皮抑素比较(±s)
注:与同组化疗前比较,*P<0.01
临床受益36化疗前 566.77 ±142.25 120.95 ±30.12化疗后 471.23 ±132.52* 145.23 ±46.61*PD 9化疗前 576.87 ±152.63 125.15 ±34.66化疗后)590.51 ±134.48 127.91 ±35.12
2.4 SCLC患者血清VEGF、内皮抑素水平与预后的关系 生存期以确诊开始至死亡或末次随访时间,对SCLC患者平均随访19个月,其中死亡29例、存活16例,中位生存期为13.3个月。VEGF高于平均值(568.93 pg/mL)26例、中位生存期为12.0个月,低于平均值19例、中位生存期为14.8个月,两者比较P<0.01;内皮抑素高于平均值(121.95 ng/mL)20例、中位生存期为14.3个月,低于平均值25例、中位生存期12.2个月,两者比较P<0.05。
3 讨论
目前,国内外发现了数十种内源性调节肿瘤血管生成的因子[1],VEGF、内皮抑素是近年研究的热点。VEGF在众多血管生成因子中作用最强、专属性最高,与肿瘤新生血管有关,在肿瘤生长、转移中占重要地位。VEGF主要作用于血管内皮细胞使其增殖,在新生血管形成过程中起激活剂的作用[2];还能增加血管通透性,尤其是对肿瘤血管较特异。其作用机制包括受体膜内片段的磷酸化、多个信号通路激活、肿瘤微血管分化及成型等[3]。肺癌中、高水平的VEGF主要由肿瘤细胞本身以及肿瘤浸润的巨噬细胞和肥大细胞分泌,在外周血清中可检测到。有研究发现,肿瘤患者血清VEGF来源与血小板相关[4]。Carmeliet等[5]报道,血清 VEGF 也可由炎细胞等物质所释放。
内皮抑素由肿瘤组织产生,具有抑制血管生成的作用,其能下调许多与血管生成活性相关的信号通路,上调多种与抑制血管生成有关的基因。各种血管生成激活剂和抑制剂互相协助和整合,构成了复杂的信号网络系统[6]。在实体肿瘤患者血清检测到内皮抑素,反映其肿瘤的生长状况[7]。
SCLC治疗一直处于研究阶段,近年研究发现CPT-11对其有很好的临床疗效。CPT-11是一种S期特异性喜树碱类衍生物,高浓度时可破坏DNA转录。JCOG的研究显示,CPT-11+DDP治疗广泛期SCLC 的疗效优于 EP 方案[8];但 Hanna等[9]进行的类似研究则认为,两者在疗效方面无统计学差异。总体来说,IP方案的疗效不逊色于EP方案,目前IP方案是NCCN指南推荐的SCLC治疗方案之一。
本研究观察组VEGF及内皮抑素较对照组升高,但其水平与年龄、性别、吸烟与否无关,而与临床分期有关。提示VEGF在SCLC浸润、转移中起重要作用,局限期内皮抑素高于广泛期,与国内外文献报道结果一致。本研究临床受益者化疗后VEGF下降,说明患者对化疗敏感,其肿瘤负荷减少,肿瘤组织生成的VEGF减少,进入血循环的也减少,与理论相符。提示VEGF变化对化疗疗效评价有参考意义。另外,临床受益者化疗后内皮抑素升高,其升高原因可能与化疗药物的细胞毒作用有关,即在杀灭大量肿瘤细胞时释放更多的蛋白水解酶,产生大量内皮抑素。
本研究显示,SCLC患者血清VEGF、内皮抑素水平与预后密切相关,VEGF高表达者预后差,内皮抑素高表达者预后好,与文献报道基本一致[10]。其原因可能为当VEGF分泌增多时肿瘤细胞增殖,患者生存期短;内皮抑素分泌增多时肿瘤血管生长变慢、浸润转移较少发生,患者生存期长。因本研究单因素分析VEGF、内皮抑素水平与SCLC患者预后的关系存在局限性,故有待进一步研究证实。
[1]Kishi K,Milas L,Hunter N,et al.Recent studies on anti-angiogenesis in cancer therapy[J].Nippon Rinsho,2000,58(8):1747-1762.
[2]孙迪文,项锋钢.肺癌VEGF和MMP2的表达与临床病理特征的关系[J].青岛大学医学院学报,2004,40(1):44-49.
[3]Baillie CT,Winslet MC,Bradley N.Tumor vasculatur-apotential therapeutic target[J].Br J Cancer,1995,27:257-267.
[4]George ML,Eccles SA,Tutton MG,et al.Correlation of plasma and serum vascular endothelial growth factor levels with platelet count in colorectal cancer:clinical evidence of platelet scavenging[J].Clin Cancer Res,2000,6(8):3147-3152.
[5]Carmeliet P,Ferreira V,Breier G,et al.Abnormal blood vessel development and lethality in embryos lacking a single VEGF allele[J].Nature,1996,380(6573):435-439.
[6]Abdollahi A,Hahnfeldt P,Maercker C,et al.Endostatin's antiangiogenic signaling network[J].Mol Cell,2004,13(5):649-663.
[7]Nguyen JT,Wu P,Clouse ME,et al.Adeno-associated virus-mediated delivery of anti-angiogenic factous as an antitumor strategy[J].Cancer Res,1998,58(24):5673.
[8]Noda K,Nishiwaki Y,Kawahara M,et al.Irinotecan plus cisplatin compared with etoposide plus cisplatin for extensive small-cell lung cancer[J].N Engl J Med,2002,346(2):85-91.
[9]Hanna N,Bunn PA Jr,Langer C,et al.Randomized phaseⅢ trial comparing irinotecan/cisplatin in patients with previously untreated extensive-stage disease small-cell lung cancer[J].Clin Oncol,2006,24(32):5175.
[10]Iizasa T,Chang H,Suzuki M,et al.Overexpression of collagen XⅧis associated with poor outcome and elevated levels of circulating serum endostatin in non-small cell lung cancer[J].Clin Cancer Res,2004,10(16):5361-5366.
