侧脑室内连续注射神经肽S对神经病理性疼痛大鼠疼痛及焦虑行为的影响①
2014-05-08金旭曾敏熊蔚罗芳
金旭,曾敏,熊蔚,罗芳
侧脑室内连续注射神经肽S对神经病理性疼痛大鼠疼痛及焦虑行为的影响①
金旭,曾敏,熊蔚,罗芳
目的研究侧脑室内连续注射神经肽S对神经病理性疼痛大鼠疼痛行为及焦虑行为的影响,探讨神经肽S对疼痛和焦虑影响的作用机制。方法40只雄性Sprague-Dawley大鼠被随机分为假手术对照组(Sham-Veh组)、假手术神经肽S组(Sham-NPS组)、慢性压迫性神经损伤组(CCI组)、神经肽S低剂量组(NPSl组,0.1 nmol/L)和神经肽S高剂量组(NPSh组,1 nmol/L),每组8只。制备CCI动物模型,造模成功后第7天左侧侧脑室置入微透析用导针,自术后第8天起每日侧脑室注射相应药物,在术后第14天检测机械痛缩足阈值和热辐射缩足潜伏期,并通过高架十字迷宫检测焦虑行为的变化。采用免疫组织荧光技术检测左侧杏仁核区神经肽S受体(NPSR)的表达。结果与Sham-Veh组比较,CCI组大鼠术后14 d出现明显疼痛和焦虑行为(P<0.01),NPSh组明显缓解(P<0.01),NPSl组与CCI组比较无显著性差异(P>0.05)。免疫组织荧光结果显示,与CCI组相比,NPSh组杏仁核区NPSR表达明显增加。结论神经肽S可以剂量依赖性地逆转CCI大鼠的疼痛和焦虑行为,其机制可能与杏仁核NPSR上调有关。
神经病理性疼痛;神经肽S;焦虑;侧脑室注射;杏仁核;大鼠
[本文著录格式] 金旭,曾敏,熊蔚,等.侧脑室内连续注射神经肽S对神经病理性疼痛大鼠疼痛及焦虑行为的影响[J].中国康复理论与实践,2014,20(7):621-625.
疼痛是一种多维度概念,不仅包括感觉分辨,尤其是慢性疼痛,一定或多或少存在情感体验成分,另外还可能包含认知评价的维度;而且在慢性痛患者中,其相关的情感体验一定是负面的占主导因素。目前尚不明了,是负面情感因素加重了慢性疼痛,还是慢性疼痛恶化了负面精神疾病。因其复杂的混杂,临床常表现为共病[1-2],在实验动物的机制研究上一定会表现为交叉影响。因此,寻找二者之间的桥梁成为弄清楚共病的关键所在。临床研究表明,焦虑和慢性疼痛有较高相关性,而且影响较抑郁深远。焦虑与疼痛都与精神觉醒状态有关,是机体保护性机制之一,可能存在着共同的神经生物学基础[3-4],至少二者的神经传导通路存在着诸多的相互影响。
长期以来,抗精神病药物,尤其是抗抑郁药和抗癫痫药在神经病理性疼痛治疗中占有重要地位,但没有证据表明,抗焦虑药对慢性疼痛有效。
神经肽S(neuropeptide S,NPS)是近年来发现的神经肽。NPS及其受体(NPSR)的广泛分布,表明其功能绝不单一。目前研究表明,NPS在调节觉醒与睡眠、抗焦虑、调节摄食和能量代谢、免疫调节以及学习和记忆等诸多方面都有作用。其抗焦虑作用明确[5],而且有研究表明可能有镇痛作用[6],这就可能构成抗焦虑和镇痛的双重特性。本研究拟通过脑室内连续给药研究NPS对神经病理性疼痛大鼠痛行为和焦虑行为的影响,并探讨其作用机制。
1 材料与方法
1.1 动物分组
清洁级雄性Sprague-Dawley大鼠,体质量200~250 g,由维通利华实验动物中心提供,动物实验经北京天坛医院伦理委员会批准。采用随机数字表法将40只大鼠分为假手术对照组(Sham-Veh组)、假手术神经肽S组(Sham-NPS组)、慢性压迫性神经损伤(chronic constriction injury,CCI)组、神经肽S低剂量组(NPSl组,0.1 nmol/L)、神经肽S高剂量组(NPSh组,1 nmol/L),每组8只。
1.2 药物、试剂和仪器
神经肽S:SIGMA-ALDRICH公司,美国。兔抗大鼠NPSR抗体一抗、小鼠抗大鼠NeuN一抗、罗丹明-山羊抗小鼠IgG、异硫氰酸荧光素(FITC)-羊抗兔IgG:ABCAM公司,美国。含DAPI的封片剂:SIGMA-ALDRICH公司,美国。其他试剂均为国产分析纯。von Frey纤毛机械刺激仪:NORTH COAST MEDICAL公司,美国。辐射热痛仪:UGO BASILE公司,意大利。倒置荧光显微镜:LEICA公司,德国。Image Pro Plus 6.0图像分析系统:MEDIA CYBERNETICS公司,美国。
1.3 造模及侧脑室置管
室温维持在20~23℃,湿度49%~51%,光照明∶暗=12 h∶12 h。自由饮水摄食,隔天更换垫料。按Bennett等[7]方法制作CCI模型,各组大鼠均选择右下肢为手术侧。暴露坐骨神经,在坐骨神经分成三支前的主干部位,游离神经约7 mm,用4-0号羊肠线将坐骨神经结扎4道,相隔1 mm,影响神经4~5 mm。止血、抗炎、缝合皮肤。
CCI造模成功后第7天进行侧脑室置管。大鼠称重后腹腔注射水合氯醛400 mg/kg麻醉,将大鼠固定于脑立体定位仪上,头顶局部常规备皮、消毒,头顶正中矢状切开约1.5 cm,3%H2O2棉球擦拭使前囟暴露清晰。确定前后囟在同一水平线上后,于前囟后0.8 mm矢线左侧1.5 mm处用手钻钻一孔,置入微透析用导针,并用牙托粉及胶水妥善固定,待动物清醒后无任何不适(出血、偏瘫等)1 d后(即CCI后8天起)连续注射相应药物7 d。
1.4 给药方法
Sham-Veh组大鼠除未进行坐骨神经压榨外,其他操作均与CCI组一致。Sham-Veh组和CCI组大鼠分别在术后第8~14天每天侧脑室注射1次人工脑脊液(artificial cerebral spinal fluid,ACSF)20 μl;而NPSl组在相同时间点分别侧脑室注射1次NPS 0.1 nmol/L(10 μl),NPSh组和Sham-NPS组则在相同时间点注射NPS 1 nmol/L(10 μl),每次注药后经导管注射ACSF 10 μl冲洗导管。
1.5 疼痛行为学测定
用von Frey纤维细丝法测定大鼠的机械痛缩足阈值,记录von Frey纤维丝刺激大鼠足底10次中能引起5次以上缩足的最小von Frey纤维丝质量为其机械痛阈值,最高阈值设为26 g,如果高于26 g仍然无反应,则记录为26 g。术后5 d选择痛阈明显降低者为造模成功者,进行分组实验。用热辐射照射大鼠后肢足底外侧,记录热辐射缩足反射潜伏期。
1.6 焦虑行为学测定
采用高架十字迷宫实验(elevated plus maze,EPM)进行测定。高架十字迷宫开放臂50×10 cm、闭合臂50×10×20 cm、中央区10×10 cm,相同类型的臂通过中央区相对连接。整个仪器置于距离地面50 cm的位置。每只动物实验时面对闭合臂置于中央区位置,并使动物自由探索5 min。记录:①动物运动总距离;②进入开放臂的次数;③在开放臂停留时间占比(动物的四肢全部进入一个臂内方可认为有效)。每只动物实验结束后采用10%乙醇进行清洗实验仪器以消除动物气味的干扰。
1.7 免疫荧光法测定对侧脑杏仁核区NPSR的表达
行为学测试后动物在水合氯醛400 mg/kg腹腔注射麻醉下,心脏插管灌流固定,取鼠脑组织置于40 g/ L多聚甲醛液中固定1.5 h,再用300 g/L蔗糖脱水,OCT胶包埋,20 μm连续冰冻切片,显微镜下选取含左侧杏仁核区。切片用含有0.3%Triton×100的5%牛血清蛋白(bull serum albumin,BSA)室温封闭1 h,加入兔抗大鼠NPSR一抗(1∶200)和小鼠抗大鼠NeuN一抗(1∶500)在4℃孵育过夜。用不加一抗的孵育液做对照。然后用带荧光罗丹明和FITC的二抗孵育。脱水,封片,倒置荧光显微镜下观察。
1.8 统计学分析
采用SPSS 16.0版软件进行统计学处理。所有数据均用(±s)表示。进行方差齐性检验后,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,显著性水平α=0.05。
2 结果
2.1 疼痛行为
与Sham-Veh组相比,CCI组大鼠的机械痛阈和热痛阈在造模14 d时明显下降(P<0.01)。与CCI组相比,NPSh组大鼠14 d时机械痛阈和热痛阈明显上升(P<0.01);NPSl组大鼠机械痛阈和热痛阈改变均不明显(P>0.05)。见表1。
Sham-Veh组和Sham-NPS组的机械痛缩足阈值和热辐射缩足潜伏期均无显著性差异(P>0.05)。见图1。
2.2 焦虑行为
侧脑室置管8 d时和CCI术后14 d时,大鼠在高架十字迷宫实验的总运动距离没有明显影响。与Sham-Veh组相比,CCI组进入开放臂的时间和次数明显减少(P<0.01)。与CCI组比较,NPSh组进入开放臂的时间和次数增加(P<0.01),NPSl组则无显著性差异。见表2。
2.3 对侧杏仁核NPSR表达的变化
免疫荧光结果显示,CCI组左侧脑杏仁核区NPSR较少表达,NPSh组NPSR表达明显增加。见图2。
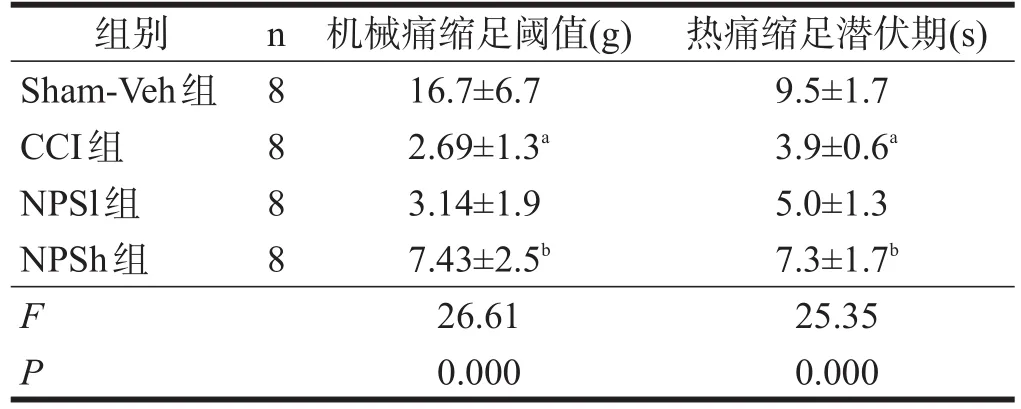
表1 各组大鼠痛行为学测试
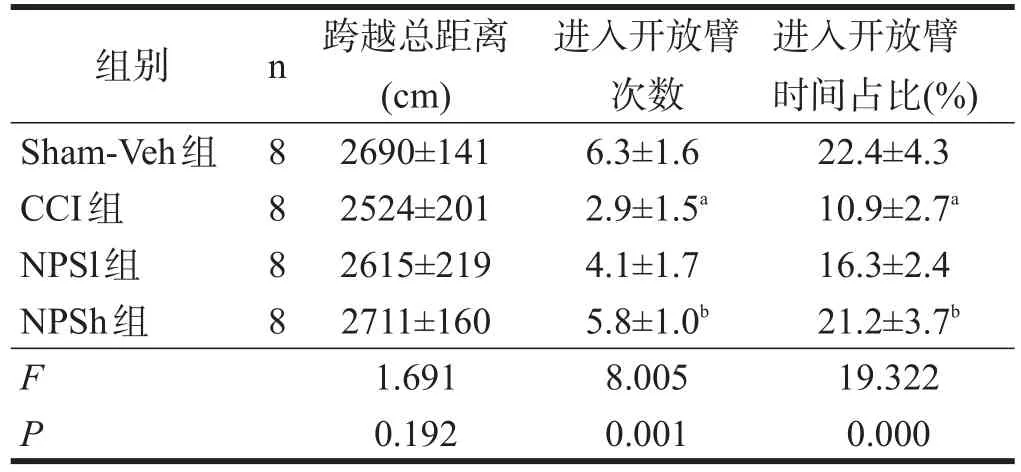
表2 各组大鼠焦虑行为学测试
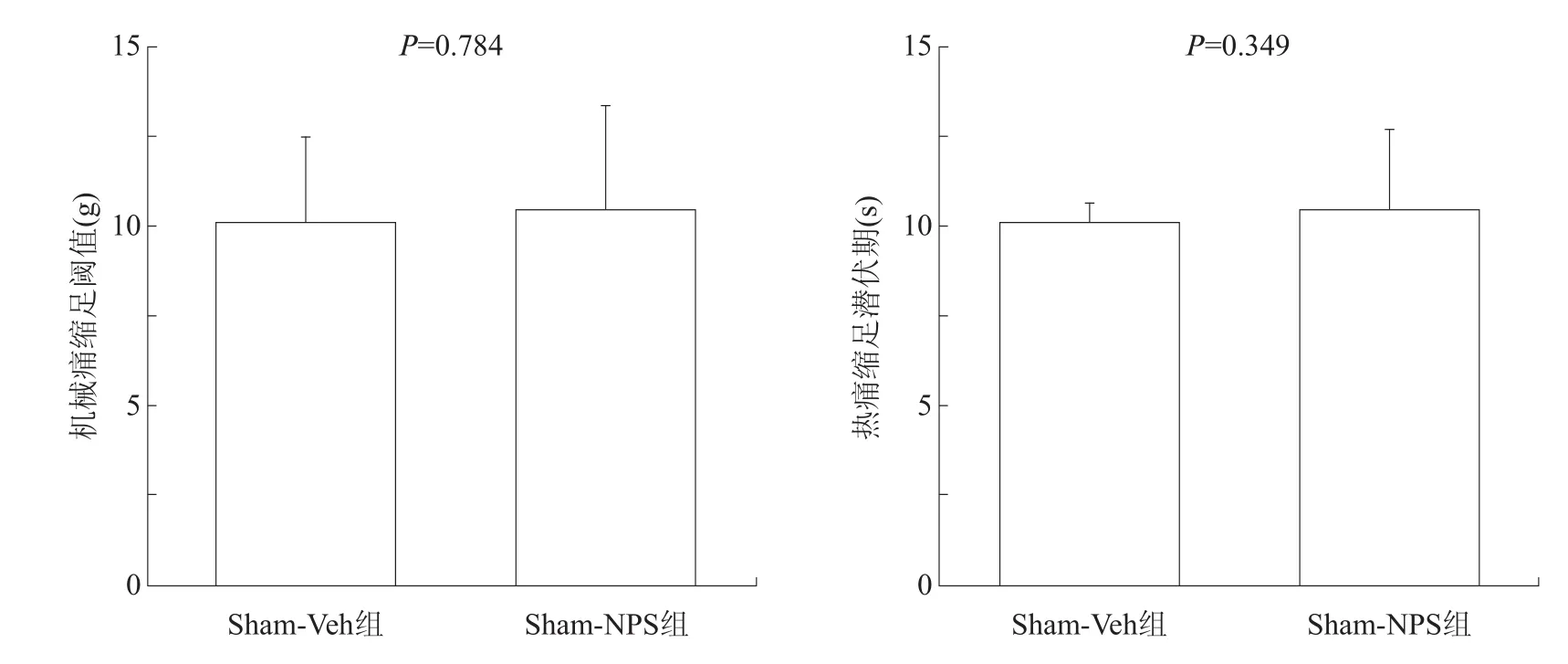
图1 侧脑室给予高剂量NPS对Sham-Veh组痛行为的影响
3 讨论
有临床证据表明,慢性疼痛尤其是神经病理性疼痛与焦虑有较高的相关性,而且越来越多的研究注意到慢性疼痛患者的焦虑症状不但多于抑郁症状,而且其影响也更深远[2,8-9]。fMRI研究也发现,慢性疼痛和焦虑有着相同的脑活动增强。动物实验也发现,慢性神经病理性疼痛大鼠在第14天出现明显焦虑行为。一般认为,疼痛引发焦虑,焦虑加重疼痛,形成恶性循环[10]。理论上,如能从内部打破这一恶性循环,对神经病理性疼痛一定有益。
杏仁核是位于大脑海马末端的一个皮层下核团,当外界刺激经过皮层和海马等一系列核团后,到达杏仁核,在杏仁核里经过信息的整合,再由杏仁基底外侧核区或杏仁外侧核区传递到中央核区,中央核区再投射到脑干皮层等区域,通常认为杏仁核与其他核团之间的这种联系与焦虑形成有关[11-12]。
研究发现,NPS前体mRNA和NPSR在多种组织表达,其中中枢神经系统多部位高表达,其他组织分布相对较少,而且与应激和焦虑相关的脑区,如杏仁核、下丘脑、中缝核群和腹侧被盖区和疼痛调节的下行控制系统的脑区[13-14],如中脑导水管周围灰质、中缝核和侧臂旁核等二者都有较高水平的表达[15]。
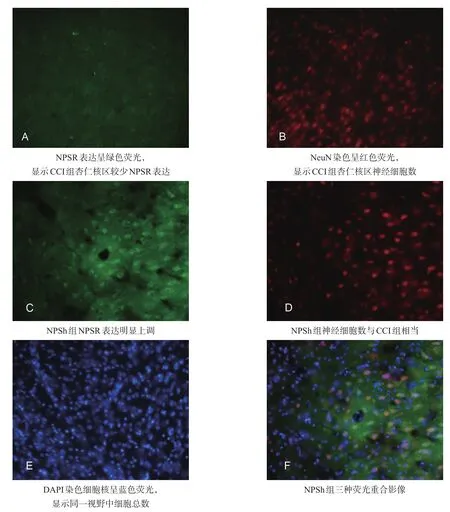
图2 对侧杏仁核NPSR表达的变化(荧光显微镜,200×)
NPS抗焦虑作用明确[16],且有一定的镇痛作用[17]。本研究旨在探讨NPS侧脑室给药对神经病理性疼痛的影响,旨在揭示慢性疼痛与焦虑的关系。慢性疼痛-焦虑共病是一个恶性循环,此恶性循环可能有不同神经通路和不同脑区作用,也可能有共同的神经通路和作用脑区,或存在交互作用。NPS和NPSR通路在疼痛和焦虑二者之间都有作用,可能是慢性疼痛和焦虑的枢纽。杏仁核可能是NPS-NPSR作用的最关键脑区/核团。在CCI大鼠慢性疼痛和焦虑共病的发生发展过程中,伴随着NPSR的明显下调;补充NPS焦虑和疼痛均有改善,NPSR表达明显增加。
当然,NPS-NPSR系统并不是单独作用,而是作为共神经递质起到调节作用[18]。进一步研究发现,NPSR和谷氨酸脱羧酶(GAD67)在杏仁核神经细胞共表达;有电生理证据表明,NPS直接激活杏仁内侧核区氨基丁酸(GABA)能中间神经元,而起到抗焦虑与镇痛作用。
本研究也存在缺陷。①疼痛和焦虑是较为复杂的精神情绪问题,影响因素极多,在动物身上测量一直饱受争议。本研究仅选用较少的经典行为学指标来测量疼痛和焦虑,可能在说服力上会有影响。但是一般来说,机械痛和热痛的测量基本可以涵盖疼痛,而EPM实验是焦虑测量敏感而准确的指标之一。这几个指标是研究疼痛和焦虑行为必备和最重要的指标,代表性好。②免疫荧光化学提出的证据稍显粗糙,也没有更多的统计学数据支持,是今后进一步研究的方向。
综上所述,侧脑室连续注射高剂量NPS可以有效抑制CCI大鼠焦虑和疼痛行为,其机制可能与对侧杏仁核区NPSR上调有关。
[1]Roy-Byrne PP,Davidson KW,Kessler RC,et al.Anxiety disorders and comorbid medical illness[J].Gen Hosp Psychiatry, 2008,30(3):208-225.
[2]Beesdo K,Jacobi F,Hoyer J,et al.Pain associated with specific anxiety and depressive disorders in a nationally representative population sample[J].Soc Psychiatry Psychiatr Epidemiol,2010,45(1):89-104.
[3]Blackburn-Munro G,Blackburn-Munro RE.Chronic pain, chronic stress and depression: coincidence or consequence?[J].J Neuroendocrinol,2001,13(12):1009-1023.
[4]Smith BH,Macfarlane GJ,Torrance N.Epidemiology of chronic pain,from the laboratory to the bus stop:time to add understanding of biological mechanisms to the study of risk factors in population-based research?[J].Pain,2007,127(1-2):5-10.
[5]RizziA,Vergura R,Marzola G,et al.Neuropeptide S is a stimulatory anxiolytic agent:a behavioural study in mice[J].Br J Pharmacol,2008,154(2):471-479.
[6]Li W,Chang M,Peng YL,et al.Neuropeptide S produces antinociceptive effects at the supraspinal level in mice[J].Regul Pept,2009,156(1-3):90-95.
[7]Bennett GJ,Xie YK.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J]. Pain,1988,33(1):87-107.
[8]McWilliams LA,Cox BJ,Enns MW.Mood and anxiety disorders associated with chronic pain:an examination in a nationally representative sample[J].Pain,2003,106(1-2):127-133.
[9]McWilliams LA,Goodwin RD,Cox BJ.Depression and anxiety associated with three pain conditions:results from a nationally representative sample[J].Pain,2004,111(1-2):77-83.
[10]do Nascimento GC,Leite-Panissi CR.Time-dependent analysis of nociception and anxiety-like behavior in rats submitted to persistent inflammation of the temporomandibular joint[J]. Physiol Behav,2014,125:1-7.
[11]LeDoux JE,Iwata J,Cicchetti P,et al.Different projections of the central amygdaloid nucleus mediate autonomic and behavioral correlates of conditioned fear[J].J Neurosci,1988,8(7): 2517-2529.
[12]Tran L,Greenwood-Van Meerveld B.Lateralized amygdala activation:importance in the regulation of anxiety and pain behavior[J].Physiol Behav,2012,105(2):371-375.
[13]Lukas M,Neumann ID.Nasal application of neuropeptide S reduces anxiety and prolongs memory in rats:social versus non-social effects[J].Neuropharmacology,2012,62(1): 398-405.
[14]Fendt M,Buchi M,Burki H,et al.Neuropeptide S receptor deficiency modulates spontaneous locomotor activity and the acoustic startle response[J].Behav Brain Res,2011,217(1): 1-9.
[15]Xu YL,Reinscheid RK,Huitron-Resendiz S,et al.Neuropeptide S:a neuropeptide promoting arousal and anxiolytic-like effects[J].Neuron,2004,43(4):487-497.
[16]Ebner K,Rjabokon A,Pape HC,et al.Increased in vivo release of neuropeptide S in the amygdala of freely moving rats after local depolarisation and emotional stress[J].Amino Acids 2011,41(4):991-996.
[17]Ren W,Kiritoshi T,Gregoire S,et al.Neuropeptide S:a novel regulator of pain-related amygdala plasticity and behaviors[J]. J Neurophysiol,2013,110(8):1765-1781.
[18]Ruzza C,PulgaA,RizziA,et al.Behavioural phenotypic characterization of CD-1 mice lacking the neuropeptide S receptor[J].Neuropharmacology,2012,62(5-6):1999-2009.
Effect of Intracerebroventricular Injection of Neuropeptide S on Pain and Anxiety Behaviors in Rats with Neuropathic Pain
JIN Xu,ZENG Min,XIONG Wei,et al.Department of Anesthesia and Pain Therapy,Beijing Tiantan Hospital,Capital Medical University,Beijing 100050,China
ObjectiveTo investigate the effects of intracerebroventricular injection of neuropeptide S(NPS)on pain and anxiety behaviors in rats with neuropathic pain,and explore the possible mechanism.Methods40 male Sprague-Dawley rats were randomly divided into Sham-Vehicle group,Sham-NPS group,chronic constriction injury(CCI)group,Neuropeptide S low-dose group(NPSl group,0.1 nmol/L) and Neuropeptide S high-dose group(NPSh group,1 nmol/L),with 8 rats in each group.Pain-related behaviors,anxiety-related behaviours, and expression of NPS receptor(NPSR)in the left amygdaloid nucleus were measured on the 14th day via intracerebroventricular injection.ResultsCompared with the Sham-Vehicle group,the CCI group demonstrated significant pain and anxiety behaviors 14 days after operation (P<0.01),the NPSh group significantly relieved(P<0.01).And there was no significant difference between the NPSl group and the CCI group(P>0.05).Compared with the CCI group,NPSR expression in amygdaloid nucleus increased in the NPSh group.ConclusionNPS can dose-dependently relieve the pain and anxiety behaviors in CCI rats,which may be related with the increase of NPSR in amygdaloid nucleus.
neuropathic pain;neuropeptide S;anxiety;intracerebroventricular injection;amygdaloid nucleus;rats
10.3969/j.issn.1006-9771.2014.07.004
R741
A
1006-9771(2014)07-0621-05
2014-03-14
2014-04-11)
1.北京市卫生系统高层次卫生技术人才(学科骨干)项目(No.2013-3-047);2.天津市生物医学材料重点实验室开放课题项目(No.2013-1-008)。
首都医科大学附属北京天坛医院麻醉科,北京市100050。作者简介:金旭(1974-),男,辽宁大连市人,博士后,副主任医师,副教授,主要研究方向:慢性疼痛的基础与临床研究。
