白藜芦醇对同型半胱氨酸损伤的人脐静脉内皮细胞NO、eNOS和小凹蛋白表达影响
2014-05-08李爱歆
张 丽,李 林,李爱歆,高 山*
白藜芦醇对同型半胱氨酸损伤的人脐静脉内皮细胞NO、eNOS和小凹蛋白表达影响
张 丽1,李 林2,李爱歆1,高 山1*
(1.佳木斯大学附属第一医院,黑龙江佳木斯154002;2.吉林大学中日联谊医院)
血管内皮细胞氧化应激损伤和功能的异常是动脉粥样硬化(AS)发生的核心环节。内皮细胞产生的NO具有扩张血管的作用,同时,通过抑制血小板的聚集、白细胞的粘附、减少氧自由基的产生等起到抗AS作用。内皮型一氧化氮合酶(eNOS)是NO产生的关键酶。当细胞受到外界信号刺激时,eNOS与小凹蛋白(CAV1)分离,eNOS被激活,从而产生NO。流行病学调查发现白藜芦醇(Res)具有潜在的抗AS作用,但其作用机制尚不明确。CAV1是PI3k/Akt上游靶点[1],是调节eNOS的负性因子,因此,我们推测Res可通过抑制CAV1的表达,从而上调eNOS的表达。
本研究通过同型半胱氨酸(Hcy)诱导内皮细胞损伤的人脐静脉内皮细胞(HUVEC)模型,观察不同浓度下的Res对CAV1和NO系统的变化。
1 材料与方法
1.1主要试剂脐带、DMEM培养基、MTT、兔抗人CAV1多克隆抗体、兔抗人eNOS多克隆抗体、Trizol、TaKaRa RNA PCR试剂盒、硝酸还原酶法试剂盒、western blotting试剂盒等。
1.2主要仪器96孔培养板、PCR仪、紫外分光光度计、酶联免疫检测仪、紫外光谱分析仪、荧光分光光度计等。
1.3HUVEC的培养取佳木斯大学附属第一医院健康孕妇,正常分娩胎儿的新鲜脐带,采用胶原酶消化分离内皮细胞,接种细胞于含20%小牛血清的DMEM培养基中,在37℃、5%CO2的培养箱内静置培养,细胞传2-3代用于实验。
1.4Hcy损伤模型的构造及细胞活力的检测将处于对数生长期的内皮细胞消化计数接种于96孔板。待细胞长到次融合状态(80%)时,用M-199无血清培养液替换原培养液,继续培养24、48h。用0、0.1、0.25、0.5、1mmol/L浓度的Hcy处理细胞,每个浓度设6个复孔,继续培养24、48h后,每孔加入20μl的MTT,37℃继续培养4h后,弃上清液,每孔加入二甲基亚砜150μl,震荡15分钟,在490 nm波长下,用酶联免疫检测仪每孔的吸光度值。
1.5实验分组及细胞液的收集重复上述步骤至用M-199无血清培养液替换原培养液后,加入0、0.1、0.5、1、10μmol/L浓度的Res,除空白对照组外,其余各组均加入1mmol/L浓度的Hcy,培养24 h。
1.6NO浓度的检测将不同组别的细胞培养液按照硝酸还原酶法试剂盒说明书进行测定,测定NO浓度。
1.7eNOS和CAV1蛋白的测定根据western blotting试剂盒的说明书进行eNOS和CAV1蛋白的测定,蛋白条带采用Image Lab软件自动分析。
1.8eNOS和CAV1mRNA的测定不同组别的细胞培按照TaKaRa RNA PCR试剂盒说明书进行细胞总RNA的提取与逆转录cDNA。取2μl的cDNA进行Real-time PCR,反应体系为25μl。eNOS上游引物为5′-ACCCTAGAATGGAGAGCAT-3′,下游引物5′-GCCTGCACTGTCTGTGCCA-3′。CAV1上游引物为5′-CCTCTACAAGCTCAACAACATG-3′,下游引物为5′-CACATCTTCAGAGTCAATCTGG-3′,内参β-actin上游引物为5′-AGCGACACAGTGCTGGAC-3′,下游引物为5′-ACAAGCAATGATCTTGATGAC-3′。
1.9统计方法实验数据采用均数加减标准差(x—±s)表示,利用SPSS 19.0统计软件处理。多组间计量资料比较采用单因素方差分析,组间比较采用方差分析,两两比较采用LSD-t检验,探讨NO系统和CAV1的相关性,采用Pearson线性相关。P<0.05表示差异具有统计学意义。
2 结果
2.1Hcy损伤HUVEC适宜浓度的确定96孔板内加入0、0.1、0.25、0.5、1mmol/L的Hcy,培养24、48h后,通过MTT法测定HUVEC增殖活性。培养24和48h,随着Hcy浓度的增加,HUVEC增殖活性可剂量依赖性地降低(P<0.01)。同时48h的Hcy损伤组的细胞增殖活性低于24h各组(P<0.01)。故本次实验采用1mmol/L的Hcy作为损伤HUVEC模型的浓度,同时培养时间定为24h(表1)。
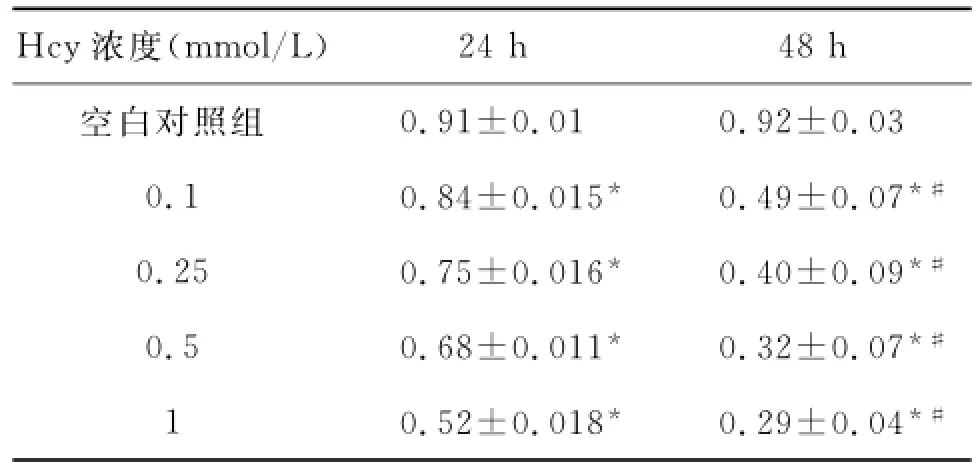
表1 不同浓度的Hcy对HUVEC增殖活性(OD490nm)的影响(x—±s)
2.2 不同组别NO浓度比较 Hcy损伤组的NO含量低于空白对照组;加入Res后,NO含量逐渐上升,0.1和1μmol/L的Res组的NO含量升高幅度最大。加入不同浓度的Res各组的NO含量均高于Hcy损伤组(P<0.01),见表2。
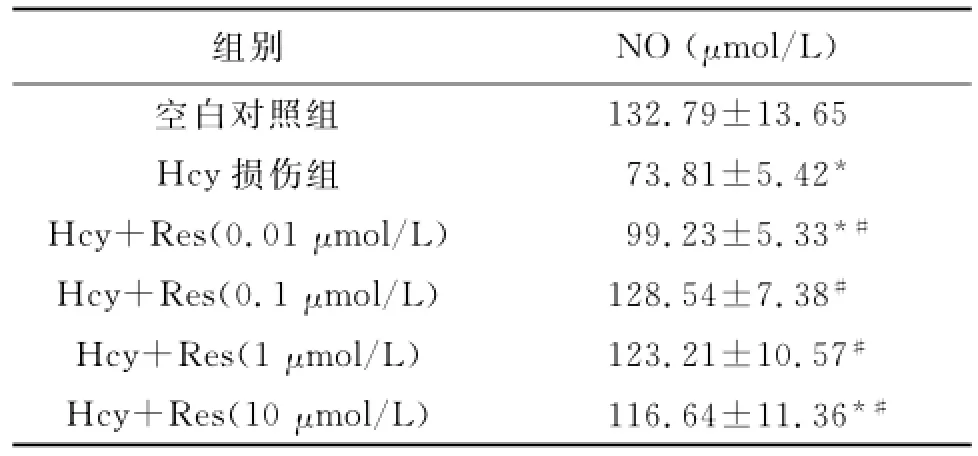
表2 Res对Hcy致HUVEC损伤的NO浓度的影响(x—±s)
2.3不同组别eNOS和CAV1蛋白的比较Hcy损伤组的eNOS蛋白含量低于空白对照组;加入不同浓度的Res后,eNOS蛋白含量升高,0.1μmol/L组升高幅度最大。Res各组的eNOS蛋白含量均高于Hcy损伤组(P<0.01)。
Hcy损伤组的CAV1蛋白含量高于空白对照组;Res浓度为1μmol/L时,CAV1蛋白含量降低的幅度最大。加入Res各组的CAV1蛋白含量均低于Hcy损伤组(P<0.01)。(见表3,图1)。
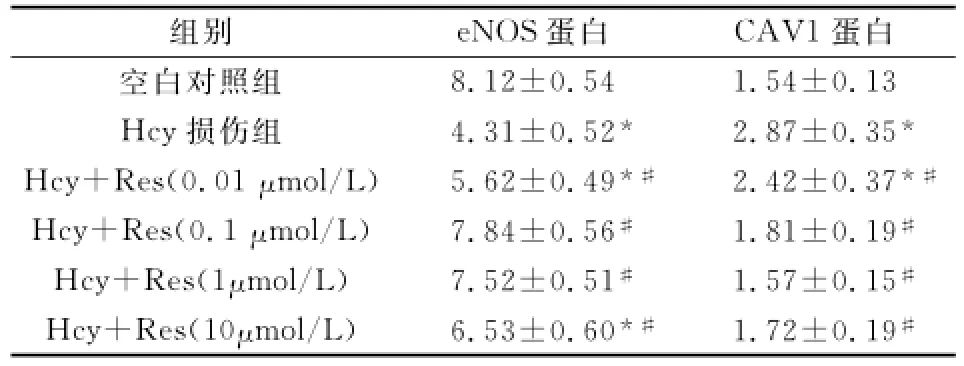
表3 Res对Hcy致HUVEC损伤的eNOS蛋白和CAV1蛋白的影响(x—±s)
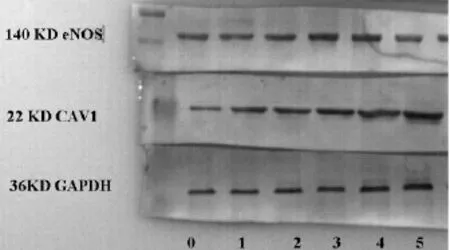
图1 Res对Hcy致HUVEC损伤的eNOS蛋白和CAV1蛋白的影响
2.4不同组别eNOS和CAV1 mRNA的比较Hcy损伤组的eNOS mRNA含量显著下降;加入0.1μmol/L Res后,eNOS的mRNA含量升高幅度最大。加入Res各组的eNOS的mRNA含量均高于Hcy损伤组(P<0.01)。
Hcy损伤组的CAV 1的mRNA含量高于空白对照组;Res浓度为1μmol/L时,CAV 1的mRNA降低的幅度最大。加入Res各组的CAV 1mRNA含量均低于Hcy损伤组(P<0.01)。(见表4,图2)
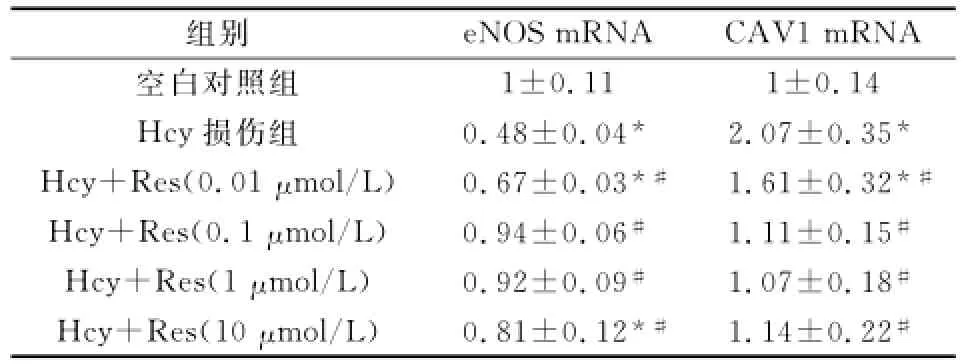
表4 Res对Hcy致HUVEC损伤的eNOS和CAV1 mRNA的影响(x—±s)
2.5NO系统与CAV1的相关性NO与CAV1蛋白及CAV1的mRNA呈负相关(P<0.05);eNOS蛋白与CAV1蛋白具呈负相关(P<0.001);eNOS的mRNA表达量与CAV1的mRNA表达量呈负相关(P<0.001)。(见表5)
图2 Res对Hcy致HUVEC损伤的eNOS和CAV1 mRNA的影响

表5 Res组内NO、eNOS和CAV1蛋白及mRNA的相关性分析
3 讨论
抑制内皮细胞功能紊乱已成为防治AS的关键环节之一。内皮细胞合成的NO产生的异常可导致血管内皮细胞功能紊乱,同时NO浓度的下降不仅使血管舒张异常,而且其抗血小板聚集、抗平滑肌增殖作用减弱,可加速AS的进程。Drab M等[2]通过敲除小鼠CAV1基因后,证明CAV1可抑制eNOS的活性。CAV1与eNOS结合后,通过Rac1/Akt信号通道抑制eNOS的活性,减少NO的产生,从而导致AS。Res具有潜在的抗AS作用。可通过增加超氧化物歧化酶、过氧化氢酶、过氧化物酶、谷胱甘肽及其还原酶等细胞保护因子,增强机体抗氧自由基防御系统,通过对高胆固醇血症家兔模型的研究,RSV通过抑制ox-LDL的形成,抑制血小板的聚集和平滑肌增殖。Res可以通过减少脂质堆积、抗氧化和抗炎症因子等作用抑制血管内皮细胞的功能紊乱,从而减缓AS的进程。
Hcy随着剂量和时间的增加,HUVEC增殖活性逐渐降低。郝宝顺等[3]研究证实Hcy对HUVEC增殖活性的影响具有剂量依赖性。故本研究选择1mmol/L的Hcy,培养24h建立HUVEC氧化应激损伤模型进行实验探讨。国内张海洋[4]等研究表明,Hcy损伤模型组的NO浓度、eNOS的mRNA含量及蛋白表达均显著低于空白对照组,这与我们的研究结果一致。我们的研究发现,加入不同浓度的Res后,能逆转Hcy对HUVEC的损伤。不同浓度下的Res组,NO浓度、eNOS的mRNA及蛋白表达含量具有剂量依赖关系。当Res浓度为0.1μmol/L时,NO浓度、eNOS的mRNA及蛋白表达含量升高的幅度最大。当Res的浓度达到10 μmol/L时,NO含量、eNOS的mRNA及蛋白表达量升高幅度减少。Res浓度在0.01-1μmol/L范围时,CAV1的mRNA和蛋白含量随着表达逐渐下降,当Res浓度为1μmol/L时,CAV1的mRNA和蛋白表达含量下降幅度最大,但当Res浓度为10 μmol/L时,CAV1的mRNA和蛋白表达含量却出现上升趋势。在Res组中进行NO系统与CAV1的相关性发现,NO、eNOS与CAV1具有负相关。
Thomas WP等[5]研究表明,Res能上调HUVEC中eNOS的mRNA的水平,且随着时间的延长和浓度增加,eNOS的mRNA水平也增加。Takizawa Y等[6]采用1μmol/L浓度的Res连续6天作用于HUVEC中,证实eNOS的表达水平上调。
我们的研究结果表明,Res抗AS的作用,其机制与抑制CAV1的mRNA和蛋白表达,上调eNOS表达,促进NO的释放有关。
[1]van den Heuvel AP,Schulze A,Burgering BM.Direct control of caveolin-1expression by FOXO transcription factors[J].Biochem J,2005,385(Pt 3):795.
[2]Drab M,Verkade P,Elger M,et al.Loss of caveolae,vascular dysfunction,and pulmonary defects in caveolin-1gene-disrupted mice[J].Science,2001,293(5539):2449.
[3]郝宝顺,余舒杰,刘 勇,等.瑞舒伐他汀对同型半胱氨酸损伤的人脐静脉内皮细胞超\氧化物歧化酶活性和丙二醛含量的影响[J].中国动脉硬化杂志,2013,21(9):802.
[4]张海洋,张会敏.Hcy对脐静脉内皮细胞eNOS和caveolin-1表达影响[J].中国公共卫生,2012,28(5):642.
[5]Wallerath T,Deckert G,Ternes T,et al.Resveratrol,apolyphenolic phytoalexin present in red wine,enhances expression and activity of endothelial nitric oxide synthase[J].Circulation,2002,106(13):1652.
[6]Takizawa Y,Kosuge Y,Awaji H,et al.Up-regulation of endothelial nitric oxide synthase(eNOS),silent mating type information regulation 2homologue 1(SIRT1)and autophagy-related genes by repeated treatments with resveratrol in human umbilical vein endothelial cells[J].Br J Nutr,2013,110(12):2150.
2014-05-17)
1007-4287(2014)12-1923-03
黑龙江省自然科学基金面上项目(D201210)
*通讯作者
