南瓜汁发酵优良乳酸菌的筛选与鉴定
2014-05-07李慧赵婧陈超李全宏
李慧,赵婧,陈超,李全宏
(中国农业大学食品科学与营养工程学院,北京100083)
乳酸菌是一类能利用可发酵糖产生大量乳酸的细菌统称,是益生菌的主要来源,广泛分布在自然界中[1]。乳酸菌具有调节肠道菌群平衡、提高食物消化率和生物价、降低血清胆固醇、减缓乳糖不耐症等多种生理功能[2]。南瓜是一种广泛种植的蔬菜,含有多种生理活性物质,具有降血脂、降血糖、抗肿瘤、清除自由基、抗过敏等功能[3-6]。目前,南瓜的加工处于初级阶段,以提高南瓜附加值的精深加工显得尤为重要。将乳酸菌与南瓜相结合开发乳酸菌发酵南瓜汁具有口感与风味独特、营养价值高的特点,具有广阔的前景。但是,研究表明,只有摄入106CFU/mL或以上的活性乳酸菌才能充分发挥其益生作用[7]。大部分乳酸菌在进入肠道之前,多因不能耐受高酸性胃液和高浓度胆盐而死亡,从而影响了保健功能的发挥。因此,获得耐受性高的菌株,使之顺利通过胃进入肠道,对开发功能性乳酸菌发酵饮品具有重要意义。本实验以不同市售酸奶及泡菜浓浆为原料,通过MRS培养基进行菌种分离纯化,并对分离的菌株进行耐受性研究及发酵试验,最终确定适合南瓜汁发酵的优良菌株,为开发营养价值较高的发酵南瓜汁奠定基础。
1 材料与方法
1.1 实验材料
市售酸奶、泡菜:购于北京美廉美超市;新鲜南瓜:购于中国农业大学家属区。
1.2 培养基
MRS液体培养基:蛋白胨10 g,牛肉膏5 g,葡萄糖 20 g,吐温 80 1 mL,磷酸氢二钾 2 g,乙酸钠 5 g,柠檬酸二铵2 g,硫酸镁0.2 g,硫酸锰0.05 g,酵母粉4 g,溶解后用蒸馏水定容至1 000 mL,调pH至6.2~6.4,115℃灭菌25 min;含碳酸钙的MRS琼脂培养基:添加1%碳酸钙,1.8%琼脂的MRS培养基;斜面保存培养基:添加1.8%琼脂的MRS培养基;其他生化试验所用培养基配制参考文献[8]。
1.3 仪器与设备
LX-B35L型立式自动电热压力蒸汽灭菌锅:合肥华泰医疗设备有限公司;DHP-9082型电热恒温培养箱:上海益恒实验仪器有限公司;FA1104电子天平:上海越平科学仪器有限公司;UV-2802紫外可见分光光度计:尤尼科(上海)仪器有限公司;九阳料理机:九阳股份有限公司。
1.4 方法
1.4.1 乳酸菌的分离纯化
各取不同品牌酸奶及泡菜浓浆1 mL,用0.75%的生理盐水进行 10 倍梯度稀释,取 10-4、10-5、10-6三个梯度的菌悬液100 μL涂布于含碳酸钙的MRS琼脂培养基上37℃恒温培养24 h~48 h,每个梯度作三个平行。挑选革兰氏染色阳性、过氧化氢酶试验阴性的菌株,初步鉴定为乳酸菌。将其接种到斜面保存培养基,置4℃冰箱中保存备用。
1.4.2 乳酸定性鉴定
通过纸层析乳酸定性试验确定产乳酸细菌[9]。以1.5%乳酸为标准溶液,展开剂为正丁醇∶甲酸∶水=75∶15∶10,显色剂为0.04%溴甲酚蓝乙醇溶液,用0.1 mol/L NaOH标准溶液调pH至6.7,各菌株发酵液以毛细管点样,进行层析。待层析液挥发之后,向层析滤纸喷洒显色剂并计算Rf值。
1.4.3 高产酸菌株筛选
将活化的菌株以3%(体积分数)的接种量接到MRS液体培养基中37℃恒温培养24 h,测定发酵酸度。取1 mL发酵液于150 mL三角瓶中,加入50 mL水,以酚酞为指示剂,用0.1 mol/L的NaOH标准溶液滴定至溶液微红色,且30 s不褪色。记录NaOH溶液的用量,同时做空白试验。酸度(°T)以100 mL发酵液中的产酸量计[10]。
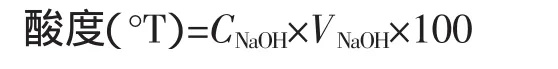
式中:CNaOH指 NaOH标准溶液的摩尔浓度0.1 mol/L;V指滴定所用的NaOH标准溶液的体积,L。
1.4.4 耐酸菌株筛选[11]
用1 mol/L盐酸溶液将MRS液体培养基pH分别调至为1.5、3.0,将筛选的菌株按照3%(体积分数)的接种量加到不同pH的培养基中,于37℃恒温培养3 h,通过稀释涂布平板法进行菌落计数,计算存活率。

1.4.5 耐胆盐菌株筛选[12]
将筛选的菌株以3%(体积分数)的接种量分别接种于不同胆盐浓度的液体MRS培养基中,37℃恒温培养3 h,通过稀释涂布平板法进行菌落计数,计算存活率。
1.4.6 菌株发酵南瓜汁性能试验
南瓜汁的制备:南瓜→清洗、去皮、切块→热烫→榨汁、过滤→灭菌南瓜汁
将前期筛选得到的菌株接种于灭菌南瓜汁中,于37℃进行发酵。通过比较pH变化、菌株生长情况确定最终发酵菌株。
1.4.7 发酵菌株形态学及生理生化鉴定
参照文献[8]中乳酸菌的鉴定方法,对各菌株进行革兰氏染色、过氧化氢酶试验、硝酸盐还原试验、明胶液化试验、H2S试验、吲哚试验以及各种糖利用试验,初步确定菌株种类。
1.4.8 菌株的16SrDNA分子鉴定
将菌株送至北京三博远志生物技术有限责任公司进行16SrDNA基因测序。
2 结果与分析
2.1 乳酸菌的分离纯化
根据培养基中钙溶圈的大小,分离出13株菌,其中杆菌11株,球菌2株。又根据革兰氏染色阳性、过氧化氢酶试验阴性的结果初步筛选出杆菌7株,球菌2株。
2.2 乳酸纸层析结果
对菌株进行纸层析法检测发酵液中是否含有乳酸,结果见表1。

表1 标准乳酸与各菌株发酵液纸层析的Rf值比较Table 1 Comparison of paper chromatography Rf values of standard lactic acid and fermentation liquid
由表1可知,各菌株发酵液与1.5%的标准乳酸溶液的Rf值相近,因此,可确定各菌株发酵液中含有乳酸。
2.3 产酸能力测定
通过对9株菌进行产酸能力测定,选择产酸能力强的菌株,结果如图1。
从图1可以看出,九株菌均具有一定的产酸能力,其中 St1、St3、St5、St7、St8 五株菌在培养 12 h 时发酵酸度达 1×10-2°T 以上,24 h 时接近 2×10-2°T,产酸能力强,因此选择这五株菌进行后续试验。

图1 各菌株的产酸量Fig.1 Acid production of different stains
2.4 耐酸能力试验
益生菌必须进入人体肠道并保持一定的数量才能发挥其正常功能。在进入肠道的过程中,要通过胃,正常情况下,胃液的pH为3.0左右,在空腹或者食用酸性食品时可低至1.5,食物从摄入到通过胃大约3 h[13]。因此,配制pH1.5和pH3.0两个梯度的MRS培养基,37℃培养3 h后通过梯度稀释进行菌落计数。由表2可见,在pH3.0条件下,各菌株存活率均在95%以上,当pH降至1.5,菌株的存活率明显降低,St7存活率降至37.5%,其余菌株存活率在50%以上,通过比较确定St1,St3,St5,St8对低pH具有较强的抵抗力。

表2 不同pH条件下菌株存活能力Table 2 Survival rate(%)of stains under acidic conditions
2.5 耐胆盐能力试验
正常人体小肠中胆盐的浓度在0.03%~0.3%,益生菌要在肠道内定植并发挥作用,必须耐受一定浓度的胆盐[14]。因此,实验选择牛胆盐浓度为0.1%和0.3%的MRS液体培养基,37℃培养3 h,观察各菌株的耐受力。由表3可见,在胆盐浓度0.1%的培养基中,五株菌的存活率都在90%以上,其中St5具有较强的存活能力,存活率为97.8%;在胆盐浓度0.3%的培养基中,各菌株的存活率下降较大,除St7外,其余菌株存活率在 50%以上。因此,St1、St3、St5、St8四株菌具有较强的耐胆盐能力。
2.6 南瓜汁发酵试验
通过对菌株的产酸能力及耐酸、耐胆盐能力进行比较,选择St1、St3、St5、St8 4株菌进行南瓜汁发酵试验,测定发酵过程中pH和菌株生长情况。

表3 不同胆盐浓度条件下菌株存活能力Table 3 Survival rate(%)of stains under different concentrations of bile salt
2.6.1 各菌株发酵过程中pH变化
pH的变化是影响南瓜汁发酵品质的重要因素,也反映了菌株的发酵能力。各菌株的发酵能力见图2。
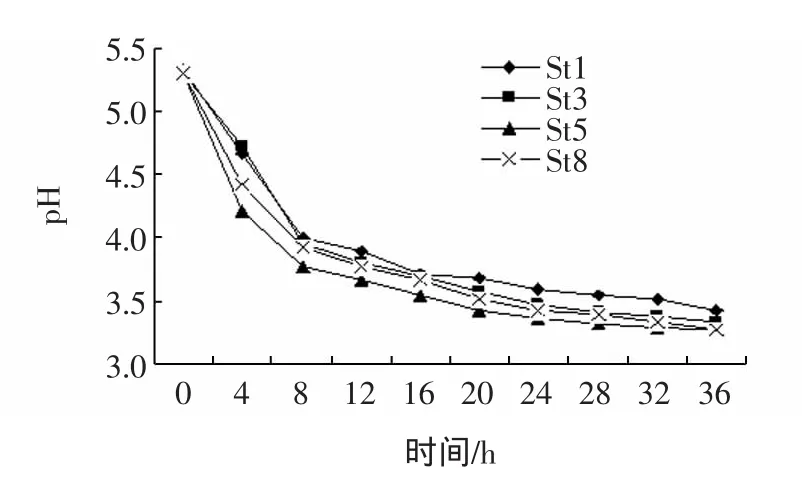
图2 各菌株发酵南瓜汁pH的变化Fig.2 pH changes in pumpkin juice during fermentation with the four stains
由图2可见,四株菌的发酵液中pH下降明显,8 h时 pH已降到4以下,24 h时 St1、St3、St5、St8的 pH 分别为 3.59、3.47、3.37、3.43,可见四株菌均具有良好的发酵产酸能力。
2.6.2 各菌株在南瓜汁中的生长情况
各菌株在南瓜汁中的生长情况见图3。

图3 各菌株在南瓜汁中的生长情况Fig.3 The OD value of pumpkin juice during fermentation with the four stains
由图3可见,四株乳酸菌都能很好的适应南瓜汁的环境,经过4 h进入对数期,生长态势良好,24 h时左右进入稳定期,此时,各菌株的OD600值分别为1.24、1.178、1.054、0.815。
通过以上的发酵试验,St1、St3、St5、St8 这四株菌都显示出良好的发酵性能,均可用于南瓜汁发酵。
2.7 菌株生理生化试验结果
通过对菌株进行生理生化鉴定试验,初步确定菌株种类,结果见表4。

表4 菌株生理生化实验结果Table 4 Physiological and biochemical characteristics of strains
对照《常见细菌系统鉴定手册》[8]中乳酸菌的生理生化试验及各种糖发酵试验结果,初步判定菌株St1为干酪乳杆菌、St3、St5均为植物乳杆菌、St8有待进一步鉴定。
2.8 16SrDNA序列测定结果
通过北京三博远志生物技术有限公司对筛选的菌株进行16SrDNA全序列测定,并将测定的序列从GenBank数据库中进行Blast分析,结果为St1为干酪乳杆菌、St3为植物乳杆菌、St5为植物乳杆菌植物亚种、St8为鼠李糖乳杆菌。
3 结果与讨论
本实验从不同品牌酸奶及泡菜浓浆中分离得到13株乳酸菌,通过对菌株产酸能力、耐酸、耐胆盐能力进行比较,筛选出4株高产酸、耐受性良好的乳酸菌发酵南瓜汁,发酵后可以显著地改善南瓜汁的口感,具有南瓜的香味和发酵特有的香气,同时由于含有一定数量的乳酸菌,具有多重保健功能。因此,可以将这四株菌作为南瓜乳酸发酵专用菌株,进行发酵产品的开发。根据菌株的生长特性和相互之间的影响,可以将菌株经过比例复合进行混合菌株发酵,更好地提高发酵品质。
[1] 凌代文,东秀珠.乳酸菌细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1998:1-3
[2] Robinson R.K.Survival of Lactobacillus acidophilus in fermented products[J].Suid Afrikaanse Tydskrif Vir Suiwelkunde,1987,19(1):25-27
[3] 任永新.浅谈南瓜的保健功能及药理作用[J].食品工程,2007(2):10-13
[4] 黄黎慧,黄群,于美娟.南瓜的营养保健价值及产品开发[J].现代食品科技,2005,21(3):176-179
[5] 王燕,车振明.南瓜的功能特性及其深加工[J].食品研究与开发,2005,26(3):7-9
[6] 卢颖,王永勤,任智捷.南瓜功能成分研究的进展及在医药领域中的应用[J].食品与药品,2005,7(7):29-32
[7] 张刚.乳酸细菌—基础、技术和应用[M].北京:化学工业出版社,2007:330-333
[8] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:370-380
[9] 吴蕊,田洪涛,孙记录,等.泡菜中乳酸菌优良菌株的分离鉴定及发酵性能的研究[J].食品研究与开发,2009,30(2):51-53
[10]李凤梅,王晓.自然发酵酸菜汁中乳酸菌分离鉴定[J].中国酿造,2008,182(5):33-35
[11]Singh T P,Kaur G,Malik R K.et al.Characterization of Intestinal Lactobacillus reuteri Strains as Potential Probiotics[J].Probiotics&Antimicro.Prot,2012,4(1):47-58
[12]王春光,张雪,李达,等.酸菜来源植物乳杆菌的分离鉴定与耐受性研究[J].食品科技,2010,35(10):36-38
[13]Berrada N,Lemeland J F,Laroch G,et al.Bifidobacterium from fermented milks:survival during gastric transit[J].Journal of Diary Science,1991,74(2):409-413
[14]王玉华,高晶,冯印,等.鼠李糖乳杆菌耐酸及胆盐能力研究[J].食品科学,2008,29(12):449-451
