利用几种植物提取物对NDMA阻断效果的研究
2014-05-07王瑞马俪珍田瑞方长发
王瑞,马俪珍,田瑞,方长发
(1.天津农学院农业分析测试中心,天津300384;2.天津农学院食品科学与生物工程学院,天津300384)
N-亚硝胺是N-亚硝基化合物的一种,其合成的前体物包括蛋白质的分解产物——胺类物质和亚硝基化剂(如硝酸盐、亚硝酸盐及气态氮氧化物等)。N-亚硝胺是目前国际上公认的一种强致癌物[1]。大量的实验证明某些食品中存在一定量的N-亚硝胺,如腌腊制品、烟熏制品及发酵食品等。其中有的是食品中天然存在N-亚硝基化合物的前体物,在食品加工过程中转化成N-亚硝胺和其它N-亚硝基化合物;有的是生产过程需要添加的添加剂,人体可经消化道、呼吸道等途径接触这些致癌物,亚硝胺类是引起人类癌症的主要物质[2-4]。因此,阻断或减少N-亚硝胺的生成是预防肿瘤发生的一个重要措施。
目前VC作为一种公认的有效的阻断剂,常用作N-亚硝胺阻断实验的阳性对照,以此比较某种待研究物质或某种天然食品的阻断效果。近年来,国内外学者利用含有黄酮化合物、VC等抗氧化成份等天然植物来抑制亚硝胺的合成,阻断效果明显[5-10]。
酚类化合物是一族结构中含有酚的化合物,广泛存在于植物食品中,由于其羟基取代的高反应性和吞噬自由基的能力而有很好的抗氧化活性[11]。植物多糖是天然大分子物质,是由许多相同或不同的单糖以α-或β-糖苷键所组成的化合物,大量药理及临床研究证实,多糖有调节免疫、抗癌、抗肥胖、控制血糖、降胆固醇、降血脂、清除自由基、抗衰老功能等生理功能[12]。目前国内外针对亚硝胺在体外模拟胃液的酸性条件下,利用多糖多酚等植物提取物对亚硝胺抑制作用的研究报道较少。
由于挥发性N-亚硝胺在食品中以10 μg/kg水平存在,要求分析方法具有足够的灵敏度和特异性。近年来,由于NPD(氮磷检测器)的技术发展,其对含磷、氮化合物均有极高的灵敏度及选择性,使用寿命更长,稳定性、重复性更好,且背景基流由以前的10-9A降到10-13A,最小检测限大大降低,操作方便易控制,检测时间大为缩短。人们开始采用气相色谱仪(GC)配备氮磷检测器(NPD)来测定烟草中特有亚硝胺[13],并取得了一些进展,但该技术应用于食品中亚硝胺的测定尚未见报道。由于该仪器技术普适性强,食品行业内的许多实验室都已配备,无需价格昂贵的专用检测设备,准确度高,重复性好,所以应用前景十分广阔。
本试验在确定亚硝胺GC-NPD检测条件的基础上,利用不同浓度枸杞多糖、原花青素(葡多酚)、八角提取物等天然植物提取物在体外模拟胃液环境,进行阻断NDMA合成的研究,通过测定添加这些提取物前后的NDMA生成量的变化,来探讨所选物质对NDMA的阻断作用。
1 材料与方法
1.1 试剂
浓盐酸、氯化钠、氨基磺酸铵、二氯甲烷、浓硫酸,以上试剂均为分析纯:购自天津傲然精细化工研究所。二甲胺盐酸盐为化学纯:购自上海天莲精细化工有限公司;亚硝酸钠为分析纯:购自天津市北方天医化学试剂厂;N-亚硝基二甲胺标准品色谱纯:迈瑞尔公司提供。
1.2 材料
枸杞多糖(提取溶剂:乙醇、水;含量:50.66%)、原花青素(提取溶剂:乙醇、水;含量:99.90%):购自天津市尖峰天然产物研究开发有限公司;八角精油:天津顶兴食品有限公司;抗坏血酸(分析纯):天津市化学试剂三厂。
1.3 仪器与设备
日本岛津GC-17A气相色谱仪,配有NPD(氮磷检测器)检测器及Clarity色谱数据工作站;色谱柱DBWAX:内径0.25 mm,长为30 m;WE-2水浴恒温振荡器:天津欧诺仪器仪表有限公司;BS224S电子天平:塞多利斯科学仪器北京有限公司。
1.4 方法
1.4.1 亚硝胺检测方法
本试验采用配备NPD检测器的气相色谱仪,对亚硝胺进行测定。
色谱条件:采用毛细管气相色谱法[14-15],条件如下:进样口温度:180℃;检测器温度:220℃;NPD检测器电流为40PA。色谱柱温度:程序升温,初温50℃保持4 min,8℃/min升至120℃保持1 min,再以8℃/min升至180℃保持1 min。色谱柱DB-WAX:内径0.25 mm,长30 m的毛细管柱;载气:氮气;进样量0.6 μL。
1.4.2 定性与定量的方法
利用保留时间定性,峰面积定量。
1.4.3 标准曲线的配制
将N-亚硝基二甲胺标准品定容至配制成浓度约为100 μg/mL的标准品。用此作为母液分别吸取1、2、4、6、8 稀释成浓度为 10、20、40、60、80 μg/mL 的标准工作液。
1.4.4 单因素试验添加量的选择
VC等的添加剂在食品中的添加量一般在0.01%~0.05%。因此,本试验中分别取多糖、多酚提取物溶剂的 0.4、0.6、0.8、1.0、2.0 mL 即添加量在 0.02%、0.03%、0.04%、0.05%、0.1%进行抑制效果的实验。
1.4.5 阻断试验
参照Narmada等的方法[16],取10 mL的模拟胃液(2 g氯化钠,7 mL浓盐酸,定容至1 000 mL)加入反应试管,再加入一定量的植物提取物溶液,加入1mol/L的亚硝酸钠溶液1 mL,0.5 mol/L的二甲胺溶液2 mL,充分混合后用模拟胃液定容至20 mL。在将反应试管放入37℃水浴中加热一小时,其中每隔15 min振摇一次,取出后加入3 mL 100 mmol/L氨基磺酸铵溶液和1 mL硫酸溶液(1∶3)终止其反应,加入10 mL二氯甲烷,用分液漏斗萃取N-亚硝基二甲胺(振摇1 min,静置30 min),收集二氯甲烷定容至10 mL。然后用气相色谱测定其中NDMA的含量,并根据以下公式计算阻断率。
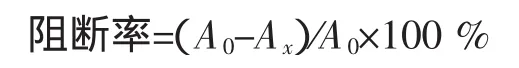
式中:A0为空白反应中NDMA的峰面积;Ax为加入抑制剂后NDMA的峰面积。
2 结果与分析
2.1 标准曲线
试验中分别配制浓度为 10、20、40、60、80、100 μg/mL的标准工作液,依次进样得出标准曲线,如图1,N-亚硝基二甲胺标准曲线。
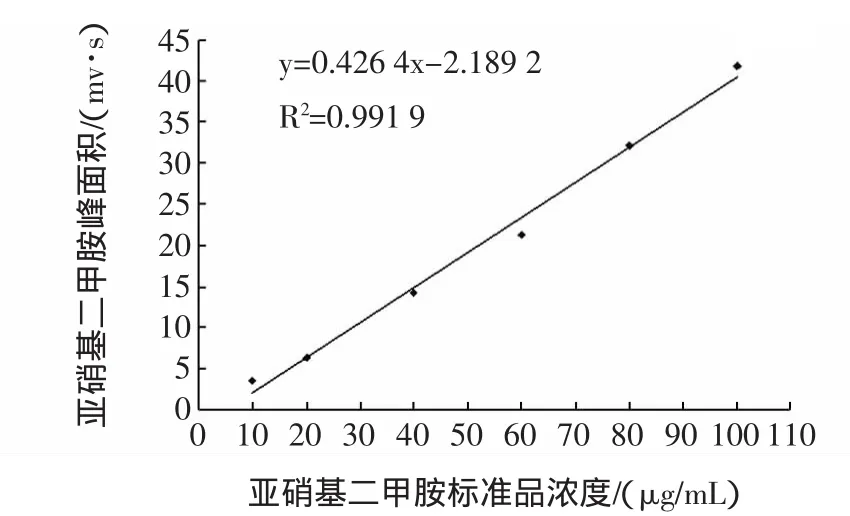
图1 N-亚硝基二甲胺标准曲线Fig.1 N-nitroso-dimethylamine standard curve
20 μg/mL标准工作液的色谱图如图2,标准工作液色谱图。
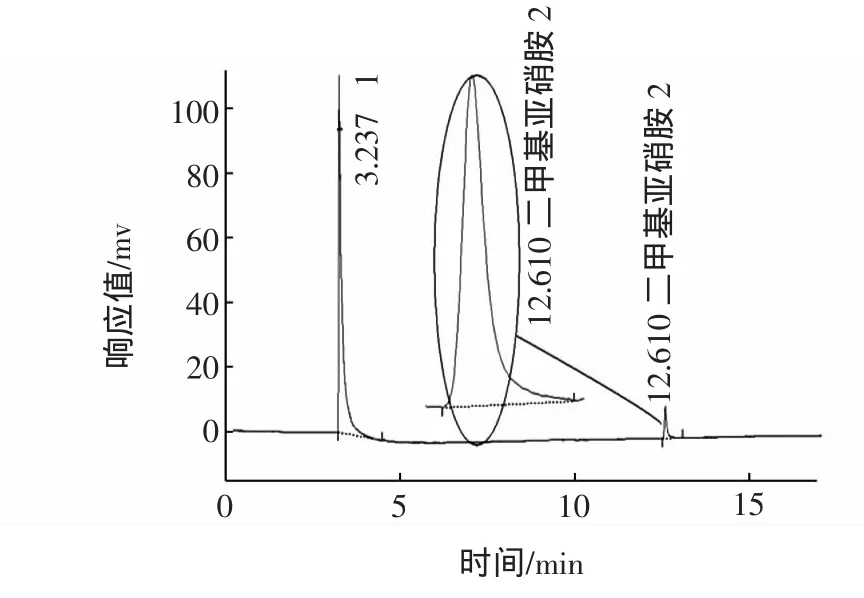
图2 20 μg/mL标准工作液色谱图Fig.2 20 μg/mL standard working solution chromatogram
从标准曲线看出,对N-亚硝基二甲胺(NDEA)含量进行测定,在浓度 10 μg/mL~100 μg/mL 范围内有良好线性(R2=0.991 9)。
2.2 回收率试验
取100 μg/mL的NDMA标准溶液1 mL添加到模拟胃液中,按照样品处理的过程进行恒温水浴、萃取等步骤后,同样定容到10 mL,并用GC检测,峰面积记为A1;同时做两次平行峰面积分别记为A2、A3。10 μg/mL标准溶液的峰面积记为A0(3次平均值)。
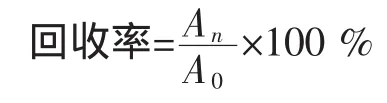

表1 回收率试验Table 1 Recovery test
2.3 精密度试验及检出限
对空白样品进行5次平行测定,其结果如表2,相对标准偏差RSD=0.036 7。
根据3倍信噪比得出该方法检出限为0.1 μg/mL。

表2 精密度试验峰值表Table 2 Precision test peak table
通过以上试验,GC-NPD法检测亚硝胺可得到较稳定精确的数据,浓度在 10 μg/mL~100 μg/mL 范围内有良好线性(R2=0.991 9),平均回收率79.68%,RSD=3.67%。该方法检出限为0.1 μg/mL。
2.4 枸杞提取物对亚硝胺的抑制
试验中分别取枸杞多糖溶液 0.4、0.6、0.8、1.0、2.0 mL即添加量分别为0.02%、0.03%、0.04%、0.05%、0.1%进行抑制效果的实验。枸杞多糖与VC对NDMA的抑制作用如图3。
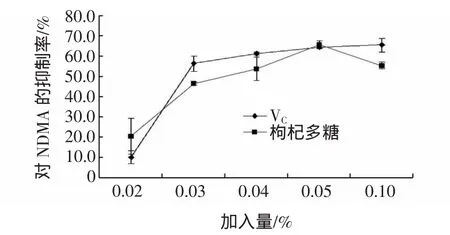
图3 枸杞多糖与VC对NDMA的抑制作用Fig.3 Inhibitory effect of Lycium barbarum polysaccharides and VCto NDMA
枸杞多糖最高抑制率色谱比较图如图4。结果表明,枸杞多糖的最高抑制率在添加量在0.05%时出现,为65.78%,在低于此剂量时抑制率随着枸杞多糖溶液加入量的增大而升高,但高于此水平时,抑制效果则表现出相反的变化趋势。而对照VC在添加量为0.05%时,抑制率也达到了64.42%,且在浓度为0.1%时它的抑制率为65.40%。
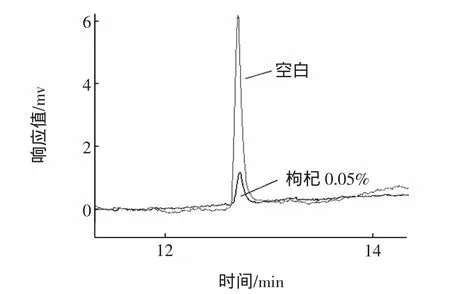
图4 枸杞多糖最高抑制率色谱比较图Fig.4 Lycium barbarum polysaccharides the maximum inhibition rate chromatographic comparison chart
枸杞多糖具有还原性,其阻断亚硝胺生成的机理是,首先与亚硝酸钠作用,使得反应物底物中的亚硝酸钠浓度降低,二甲胺反应程度降低,达到阻止亚硝胺生成的目的。
2.5 原花青素对亚硝胺的抑制
试验中分别取原花青素溶液 0.4、0.6、0.8、1.0、2.0 mL即添加量分别为0.02%、0.03%、0.04%、0.05%、0.1%进行抑制效果的实验。原花青素与VC对NDMA的抑制作用如图5。
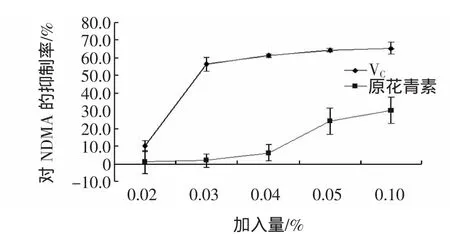
图5 原花青素对NDMA的抑制作用Fig.5 Inhibitory effect of procyanidins on NDMA
图5结果表明,在原花青素加入量小于0.04%时,抑制NDMA生成的效果,当加入0.04%原花青素溶液时,其抑制效果仅有3.28%。当加入0.05%原花青素溶液时,抑制效果达到27.04%。在添加量在0.1%时,抑制率仅为30.24%,是VC抑制率的50%。
当往原花青素中依次加入亚硝酸钠与二甲胺时,原花青素优先同亚硝酸钠作用,使得二甲胺不能与亚硝酸钠反应,达到阻止亚硝胺生成的目的。
2.6 八角精油对亚硝胺的抑制
实验中分别取八角精油 0.4、0.6、0.8、1.0、2.0 mL进行抑制效果的实验。八角精油对NDMA的抑制作用如图6。
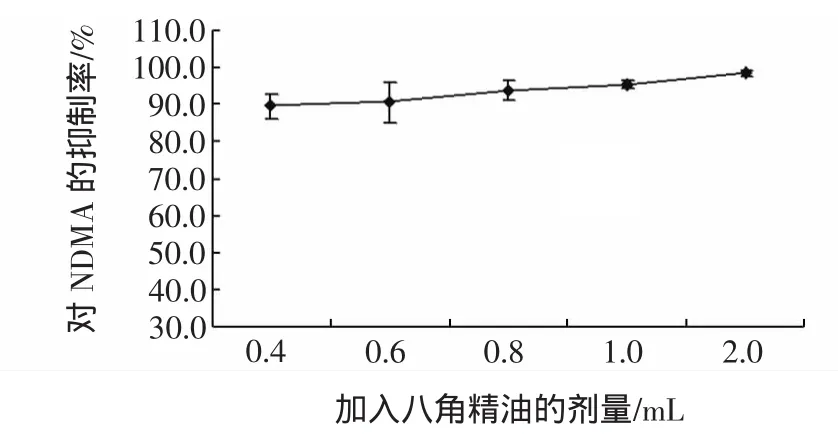
图6 八角精油对NDMA的抑制作用Fig.6 Inhibitory effect of star anise oil on NDMA
从图6可见,在加入0.4 mL八角精油时,抑制效果就已经达到89.45%,当剂量增加到0.6 mL八角精油时,抑制率已上升到90%以上,在随后的实验组中逐步加大八角精油的剂量,发现八角精油对NDMA生成反应的抑制效率也随之增高,在加入2.0 mL八角精油的反应体系中所得到的抑制率最高达到98.17%。
八角精油中成分比较复杂八角精油中含茴香醚、黄樟醚、茴香醛、茴香酮、水芹烯等。具有较好的抑菌、具有抗氧化性、杀虫活性和抗自由基氧化作用,可作为食品天然防腐剂和保鲜剂[15]。
3 讨论
1)以往的一些关于亚硝胺阻断的研究中,对于亚硝胺的检测使用的大多是利用分光光度法,对于气相色谱用于亚硝胺的抑制实验只有张健斌等[15]有报道,而配备氮磷检测器的气相色谱法(GC-NPD)在亚硝胺抑制中的应用报道更少。相对于分光光度法,GC-NPD对于样品颜色的干扰更小,提高了实验的准确度及稳定性。
2)枸杞的抑制率最大值在55%左右,这可能与枸杞多糖的纯度(50.66%)有关,而且其中存在其它成分,可能对亚硝胺的阻断作用有影响。枸杞多糖的纯品对亚硝胺的阻断作用还有待于进一步研究。
3)实验证明八角精油的抑制效果最明显,在添加量为2.0 mL时,最高抑制率在98%左右。本实验中体外抑制亚硝胺的方法模拟胃液代替超纯水,使反应体系的pH值相对稳定,八角精油较大的添加量(2 mL)也可能是高抑制率(98%)的原因,其它物质均是配制成一定的浓度,这可能是影响最终的抑制率较大的因素,还有待于研究。
4)在本试验中,枸杞多糖、原花青素及VC的抑制效果较低。分析其原因,可能是亚硝酸盐添加的浓度过高(添加量3.45 g/kg,国标为0.15 g/kg),使得低浓度的抑制剂产生“抑制疲劳”,不能完全发挥抑制作用。
[1]汤林虹,田应华.亚硝胺类化合物的危害及控制[J].肉品卫生,2000(4):10-11
[2] 袁毅桦,陈忻,陈纯馨,等.柚皮提取物对亚硝化反应抑制作用研究[J].化学世界,2004(1):26-28
[3] 陈蔚文,叶富强,李茹柳,等.黄连丁香提取物在模拟胃液酸性条件下对亚硝胺生成的影响[J].广州中医药大学学报,1997,14(4):258-260
[4] 熊潮慧,陈一资.香肠制品中亚硝酸盐的效应[J].肉类工业,2005(9):34-35
[5] Burton H R,Dye N K,Bush L P.Tobacco-specific nitrosamines,nitrate,and alkaloids[J].Agric Food Chem.1992,40:1050-1055
[6] Sun Young Choi,Mi Ja Chung.N.J.Sung,Volatile N-nitrosamine inhibition after intake Korean green tea and Maesil(Prunus mume SIEB.et ZACC.)extracts with an amine-rich diet in subjects ingesting nitrate.Food and Chemical Toxicology,2002,40(7):949-957
[7] 余华,汤修琴,曹丽容.天然植物成分体外模拟胃液清除亚硝酸钠及阻断亚硝胺合成的研究[J].四川食品与发酵,2005,41(2):7-9
[8] 袁叶飞,周燕园,马家骅,等.大枣抑制亚硝胺合成的体外实验研究[J].广西中医药,2005,28(4):52-53
[9]孔琪.五倍子鞣质的提取及抑制亚硝化反应的初步研究[J].应用科技,2005,32(9):62-64
[10]陈忻,刘爱文,陈纯馨,等.壳聚糖及其衍生物对亚硝化反应的抑制作用[J].精细化工,2005,22(3):209-211
[11]郭新竹,宁正祥.天然酚类化合物及其保健作用[J].食品工业,2002(3):28-29
[12]齐继成.植物类多糖产品开发应用趋势[J].医药产品,2005(8):25
[13]卢红兵,终科军,毛友安,等.毛细管气相色谱-氮磷检测器法测定卷烟烟气中TSNA的研究[J].湖南城市学院学报,2004,13(4):55-57
[14]杨华,马俪珍,王瑞,等.肉制品中N-亚硝胺及亚硝酸盐测定及其相关性分析[J].保鲜与加工,2006,6(4):21-23
[15]张健斌,马俪珍,孔宝华,等.几种香辛料对二甲基亚硝胺形成的抑制作用[J].食品与机械,2008,24(2):93-95
[16]Narmada R Shenoy,Ahmed S U Choughuley.Inhibitory effect of diet related sulphydryl compounds on the formation of carcinogenic nitrosamines[J].Cancer Letters,1992(65):227-232
