袖珍菇多糖提取的研究
2014-05-07王蓓
王蓓
(江苏省扬州商务高等职业学校,江苏 扬州 225127)
袖珍菇(P1eurotusgeesteranus Singer),别名小平菇,环柄侧耳,隶属担子菌亚门,层菌纲,伞菌目,侧耳科,侧耳属。它具有甜香的海鲜型气味,其味道鲜美,富含蛋白质、多糖、维生素和铁、钙等微量元素,且含有人体所必需的8种氨基酸,长期食用有降低高血压和降低胆固醇的功能,是开发前景十分广阔的珍贵食用菌。
食用菌具有多种功效因子和较高的药用价值。归纳起来,食用菌中的多糖]主要有以下几方面的保健功效[1]。
(1)增强机体免疫力;(2)抑制肿瘤作用;(3)降低胆固醇、降血压和抗血栓作用;(4)抗疲劳、抗衰老作用;(5)抗病毒作用;(6)抗氧化作用。
食用菌多糖具有多方面的活性,特别是增强人体免疫力,且对正常细胞无毒害作用,因此随着对食用菌多糖的研究的不断加强,食用菌多糖必将在食品和医药领域有很大的潜在发展空间和前景。本文以袖珍菇为原料进行多糖技术提取研究。
1 材料和方法
1.1 原料与设备
1.1.1 原料
新鲜袖珍菇:市售。
1.1.2 试剂
乙醚(分析纯)、氯仿、正丁醇(分析纯)、无水乙醇(分析纯)、60%的乙醇、70%的乙醇、80%的乙醇、浓硫酸(分析纯)、苯酚(分析纯)、葡萄糖(分析纯)。
1.1.3 仪器与设备
电热恒温鼓风干燥箱(DHG-9070):上海精密实验设备有限公司;电热恒温水浴锅(DK-S26):河南省巩义市英峪予华仪器厂;旋转蒸发仪(RE-52D):上海青浦沪西仪器厂;循环水真空泵(SHZ-ⅢB):上海仪表(集团)供销公司;磁力搅拌器(84-1A):上海闵行虹浦仪器厂;离心机(centrifuge5804):基因有限公司;电子天平AB54型:瑞士METTLER TOLEDO;高速万能粉碎机(A11 basic):广州仪科公司;分光光度计:上海凌光技术有限公司。
1.2 方法
1.2.1 原料的预处理
将市售的新鲜袖珍菇,置于烘箱内40℃烘干,用粉碎机粉碎,存放在干燥容器备用。
1.2.2 袖珍菇多糖含量的测定及标准曲线的绘制
采用硫酸-苯酚[2]法。糖在浓硫酸的作用下,水解生成单糖,并迅速脱水生成糖醛衍生物,然后与苯酚缩合成橙黄色化合物,且颜色稳定,在波长490 nm处和一定的浓度范围内,其吸光度与多糖含量呈线性关系正比,从而可以利用分光光度计测定其吸光度,并利用标准曲线测定样品的多糖含量。
制作标准曲线:准确称取标准葡萄糖100 mg于100 mL容量瓶中,加水至刻度,吸取10 mL,再定容至50 mL,得葡萄糖标准溶液0.2 mg/mL。分别吸取0、0.1、0.2、0.4、0.6、0.8、1.0、1.2 mg 以蒸馏水补至 2.0 mL,然后加入6%苯酚1.0 mL及浓硫酸5.0 mL摇匀,室温静置10 min,于490 nm测吸光度,以2.0 mL水按同样显色操作为空白,横坐标为多糖浓度,纵坐标为吸光度,得标准曲线,用excel软件求得回归方程。

表1 多糖标准曲线的吸光度Table 1 The absorbency polysaccharide standard curve
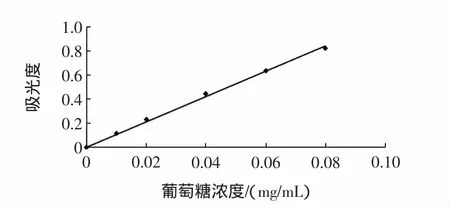
图1 多糖标准曲线Fig.1 Polysaccharide standard curve
1.2.3 热水浸提法提取袖珍菇多糖
1.2.3.1 工艺流程[3]
袖珍菇粉末→热水浸提→多糖浸提液→去杂蛋白→乙醇沉淀→检测多糖含量。
称取2 g袖珍菇粉末加入一定的水倒入烧杯内搅拌,放在恒温水浴锅内恒温到试验温度,浸提一定的时间,提取完毕后,对提取液进行抽滤,滤液用旋转蒸发器蒸馏,将 Sevag(V氯仿∶V正丁醇=4∶1)试剂加入到滤液中,使样品中的蛋白质变性成不溶状态沉淀离心除去,然后再加入一定浓度的乙醇溶液在一定温度下沉淀特定的时间,离心30 min,弃去上清液,得黄褐色沉淀,分别加入100 mL水复溶,得粗多糖溶液。
样品测定:吸取2 mL样品液于试管中,加入6%苯酚溶液1 mL,混匀,再加浓硫酸5 mL,充分混合,放置10 min,按试验方法测定吸光度,由于分光光度计只能测颜色较浅的溶液,所以实际测量时将上面的样品稀释10倍,为避免误差,吸光度多次测量求取平均值,计算多糖含量。

1.2.3.3 料液比对袖珍菇多糖得率的影响
设定浸提时间1 h,温度60℃,醇沉浓度80%,醇沉时间4 h,醇沉温度25℃,以多糖得率为指标,对料液比 1∶10、1∶20、1∶30、1∶40、1∶50(mg/mL)进行比较研究,确定最佳料液比。
1.2.3.4 浸提时间对袖珍菇多糖得率的影响
设定浸提料液比 1∶20(mg/mL),温度 60 ℃,醇沉浓度80%,醇沉时间4 h,醇沉温度25℃,以多糖得率为指标,对浸提时间 1、2、3、4、5 h 进行比较研究,确定最佳时间。
1.2.3.5 浸提温度对袖珍菇多糖得率的影响
式中:xq为需求某点X轴坐标值,m;yq为需求某点 Y轴坐标值,m;zq为需求某点 Z轴高程,m;xg、xd为已知点X轴坐标值,m;yg、yd为已知点 Y轴坐标值,m;zg、zd已知点 Z 轴高程,m;
设定浸提料液比 1∶20(mg/mL),时间 1 h,醇沉浓度80%,醇沉时间4 h,醇沉温度25℃,以多糖得率为指标,对浸提温度 60、70、80、90、100 ℃进行比较研究,确定最佳温度。
1.2.3.6 乙醇浓度对袖珍菇多糖得率的影响
设定浸提料液比 1∶20(mg/mL),时间 1 h,温度60℃,醇沉时间4 h,醇沉温度25℃,以多糖得率为指标,对乙醇浓度50%、60%、70%、80%、90%进行比较研究,确定最佳浓度。
1.2.3.7 醇沉温度对袖珍菇多糖得率的影响
设定浸提料液比 1∶20(mg/mL),时间 1 h,温度60℃,醇沉时间4 h,醇沉浓度60%,以多糖得率为指标,对醇沉温度4、25、40℃进行比较研究,确定最佳温度。
1.2.3.8 醇沉时间对袖珍菇多糖得率的影响
设定浸提料液比 1∶20(mg/mL),时间 1 h,温度60℃,醇沉温度25℃,醇沉浓度60%,以多糖得率为指标,对醇沉时间 4、6、8、10、12 h 进行比较研究,确定最佳时间。
1.2.3.9 正交试验
热水浸提法条件优化:
以料液比,浸提温度和浸提时间为直接因素,进行3因素3水平的正交试验。其中料液比水平为1∶20、1∶30、1∶40(mg/mL),浸提温度水平为 70、80、90 ℃,浸提时间水平为 1、2、3 h。
乙醇沉淀多糖工艺条件优化:
在料液比 1∶20(mg/mL),浸提温度 60 ℃,浸提时间1 h的相同条件下得到的浸提液,选取乙醇浓度,沉淀时间和沉淀温度为直接因素,进行3因素3水平的正交试验,其中乙醇浓度水平为60%、70%、80%,醇沉时间水平为 4、8、12 h,醇沉温度水平为 4、25、40℃。
2 试验结果
2.1 加水量对秀珍菇多糖得率的影响
采用不同的加水比例,其他试验条件完全相同,以多糖得率为指标,以确定最佳料液比,结果见表2。

表2 料液比对袖珍菇多糖得率的影响Table 2 Mushroom polysaccharides material liquid extraction ratio effects of pocket

图2 料液比对袖珍菇多糖得率的影响Fig.2 Material liquid extraction ratio effects of pocket mushroom polysaccharides
由图2可知,水的不同用量对袖珍菇多糖的得率有较大影响,随体系水含量的增加,其多糖得率呈现先上升后趋于稳定。随着料液比的增加,多糖与有水接触面的浓度差增大,多糖就越容易渗透出来,当料液比继续增大时,袖珍菇中的多糖绝大部分已被溶解出来,结果表明,料液比在1∶40时多糖浓度达最高。结合生产成本,故选用料液比为 1∶20、1∶30、1∶40 进行正交试验。
2.2 浸提时间对秀珍菇多糖得率的影响
对于浸提时间,在设定浸提温度60℃,料液比1∶40的条件下,以多糖得率为指标,确定最佳浸提时间,其结果见表3。

表3 浸提时间对袖珍菇多糖得率的影响Table 3 Extraction time for pocket mushroom polysaccharides extraction

图3 浸提时间对袖珍菇多糖得率的影响Fig.3 Extraction time for pocket mushroom polysaccharides extraction
由图3可知,浸提时间越长,热水对物料作用的越充分,多糖浸出的越多,袖珍菇多糖的得率增加。当达到一定时间后,多糖得率达到最大值,然后下降,这是由于随着时间增长,溶液体系浓度达到平衡。从图中可以看出,浸提2 h可以对袖珍菇多糖进行充分提取。因此,本试验选择1、2、3 h进行正交试验。
2.3 浸提温度对秀珍菇多糖得率的影响
以浸提温度为单一变量,其他条件完全相同,以多糖得率为指标,确定最佳浸提温度,其结果见表4。

表4 浸提温度对袖珍菇多糖得率的影响Table 4 Extraction of pocket mushroom polysaccharides extraction temperature

图4 浸提温度对袖珍菇多糖得率的影响Fig.4 Extraction of pocket mushroom polysaccharides extraction temperature
由图4可以看出,浸提温度高低对袖珍菇多糖得率影响比较明显。随着浸提温度的增高,多糖得率先增加,然后略有下降。这可能是由于温度升高,空化作用和机械作用越剧烈,媒质粒子的速度和加速度亦越大,界面扩散层上的分子扩散就越快,使袖珍菇中的多糖渗出速度就越快。但温度过高,袖珍菇中其它成分吸出,导致多糖得率缓慢下降。所以本试验选择70、80、90℃进行正交试验。
2.4 正交试验结果
由单因素试验可以看出,每种单一的因素达到一定程度时,对提高多糖得率都有一定的难度,必须综合多个因素,确定出合理的水平,才能得到理想的袖珍菇多糖提取工艺参数。因此,在各单因素初步试验的基础上,选择了各因素的3个水平,以多糖的得率作为参考指标,进行正交试验,确定袖珍菇多糖提取最佳工艺参数[4],结果见表 5。
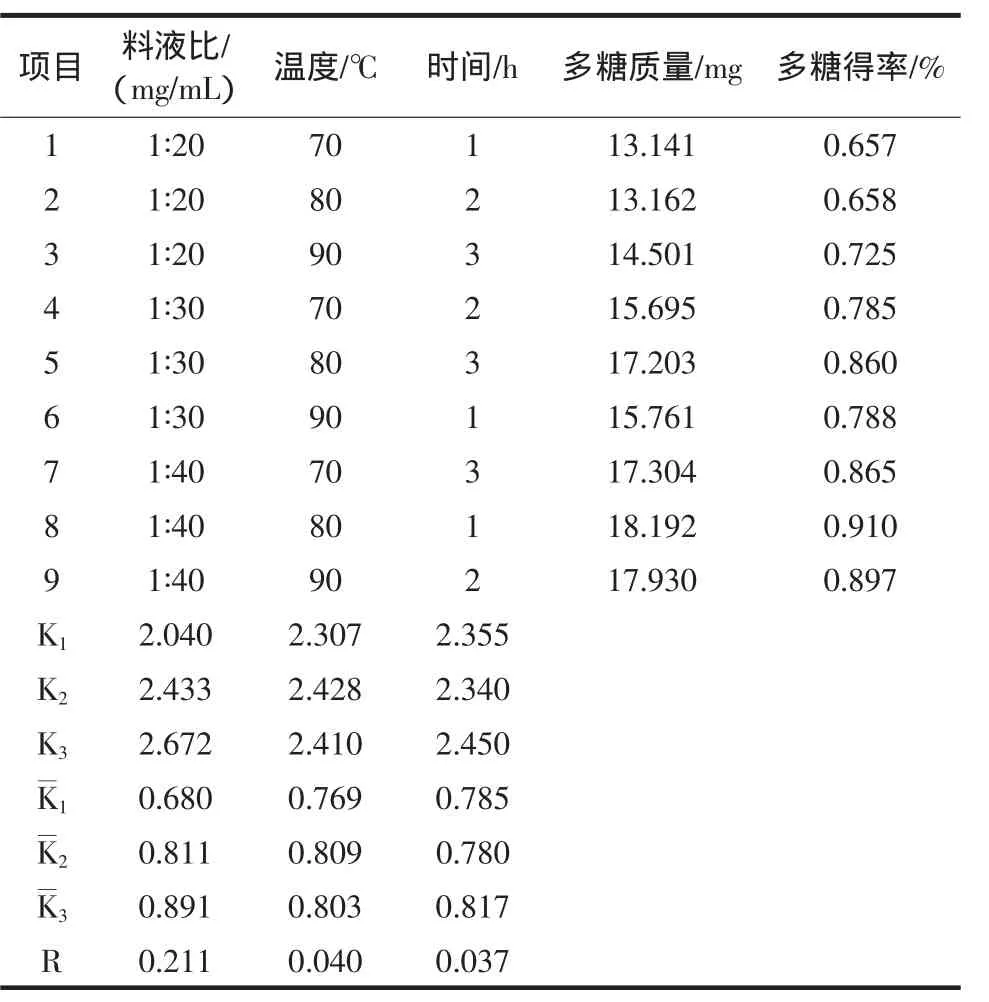
表5 不同浸提条件下的袖珍菇多糖提取效果Table 5 Under the condition of different extraction ofmushroom polysaccharides extract pocketbook
从表5可以看出,R值以料液比(0.211)最大,温度(0.040)其次,提取时间(0.037)最小。表明料液比决定袖珍菇多糖得率的主要影响因素,其次是浸提温度和提取时间。
从K值可以看出,料液比以 1∶40(mg/mL)处理提取效率最高,浸提时间以3 h处理提取效率最高,浸提温度以80℃提取效率最高。将3个因素的最优水平结合在一起得最佳浸提条件:料液比1∶40(mg/mL),时间3 h,浸提温度80℃。
按照最佳提取条件进行了验证,得出的多糖得率为0.931%,高于其他条件的得率,因此认为此工艺条件是可行的。
以上试验采用水作为浸提液对秀珍菇多糖进行了试验研究。对于多糖的得率中,我们还有一个重要的因素就是醇沉条件,下面对乙醇沉淀浓度、沉淀温度、沉淀时间进行了研究。
2.5 乙醇浓度对袖珍菇多糖得率的影响
对乙醇浓度我们采用了50%、60%、70%、80%、90%浓度的乙醇,在其他试验条件完全一定的条件下,以多糖得率为指标,确定最佳乙醇浓度,其结果见表6。

表6 乙醇浓度对袖珍菇多糖得率的影响Table 6 The concentration of ethanol extraction mushroom polysaccharides pocketbook

图6 乙醇浓度对袖珍菇多糖得率的影响Fig.6 The concentration of ethanol extraction mushroom polysaccharides pocketbook
由图6,乙醇浓度在50%~70%时随着乙醇浓度的升高多糖得率也升,乙醇浓度超过70%以后随着浓度升高多糖提取率反而下降,所以得最佳乙醇浓度70%。
2.6 醇沉温度对袖珍菇多糖得率的影响
对乙醇温度采用了4、25、40℃。浸提时间1 h,温度60℃,醇沉时间4 h,醇沉浓度60%,以多糖得率为指标,其结果见表7。

表7 醇沉温度对袖珍菇多糖得率的影响Table 7 Alcohol extraction temperature on the mushroom polysaccharides pocketbook
由图7得出,醇沉时醇沉温度在25℃范围内随着温度上升多糖得率升高,过了25℃以后,随着温度上升多糖得率反而下降,由此得出最佳醇沉温度25℃。
2.7 乙醇醇沉时间对袖珍菇多糖得率的影响
对醇沉时间采用了 4、6、8、10、12 h。浸提时间 1 h,温度60℃,醇沉温度4℃,醇沉浓度60%,以多糖得率为指标,其结果见表8。

图7 醇沉温度对袖珍菇多糖得率的影响Fig.7 Alcohol extraction temperature on the mushroom polysaccharides pocketbook

表8 醇沉时间对袖珍菇多糖得率的影响Table 8 Alcohol extraction time to a small mushroom polysaccharides

图8 醇沉时间对袖珍菇多糖得率的影响Fig.8 Alcohol extraction time to a small mushroom polysaccharides
以图8看,醇沉时间在8 h之内随着时间的增加多糖得率逐渐上升,8 h以后随着时间增加得率反而下降,多糖得率在醇沉8 h时达到最大值,所以醇沉最佳时间8 h。
2.8 不同醇沉条件正交试验结果
从以上单因素试验可以看出,每种单一的因素达到一定程度时,对提高多糖浓度都有一定的难度,必须综合多个因素,确定出合理的水平,才能得到理想的多糖醇沉的工艺参数。因此根据以上各单因素多水平的初步试验,选择了各因素的3个水平,以多糖得率作为参考指标,进行正交试验,来确定袖珍菇多糖醇沉工艺参数[5],结果见表 9。
从表9可以看出,R值以醇沉温度(0.128)最大,醇沉时间(0.167)次之,乙醇浓度(0.069)最小。表明醇沉温度对袖珍菇多糖的得率影响最大,乙醇浓度影响最小。

表9 不同醇沉条件的袖珍菇多糖提取效果Table 9 Different alcohol extract of pocket mushroom polysaccharides conditions
同时可以得出,醇沉温度以4℃处理多糖含量最高,但4℃与25℃条件下醇沉时多糖的得率相差甚微,考虑到节约能源,采用25℃醇沉温度进行醇沉较为适宜;醇沉时间4 h处理多糖含量达到最大值;醇沉时乙醇浓度60%处理多糖得率最高。将3个因素的最优水平结合在一起,得到优化的醇沉条件的组合。结果确定,最佳的醇沉条件为醇沉浓度60%,醇沉时间8 h,醇沉温度25℃。
按照最佳醇沉条件进行了验证,得到的多糖得率为0.775%,高于其他条件的得率,所以此工艺条件有可行性。
综合以上两个正交试验的试验结果,以料液比1∶40(mg/mL),浸提时间 3 h,浸提温度 80 ℃,醇沉时乙醇浓度60%,醇沉时间8 h,醇沉温度25℃为实验条件进行了验证,得到的多糖得率为0.968%,高于其他条件下的多糖得率,因此这工艺条件是可行的。
3 结论
热水浸提法相对于其它方法而言具有设备简单,操作方便,适用面广以及节约成本等优点本试验在用热水浸提法提取袖珍菇多糖的工艺中通过单因素和正交试验得出了袖珍菇多糖的最佳提取工艺参数:料液比 1∶40(mg/mL),浸提温度 80 ℃,浸提时间 3 h,醇沉时乙醇的浓度60%,醇沉时间8 h,醇沉温度25℃,在此条件下多糖的得率为0.968%。
近年来,食用菌多糖[6]的研究和应用已取得很大的进步,但仍存在许多问题,总结起来主要有以下三个问题:第一,是食用菌多糖的构效关系研究。有广泛生理活性的食用菌多糖活性强弱与分子组成、连接方式、立体构型、相对分子量、糖链的分支程度、溶解度等有密切关系。多糖官能团的改造已成为研究多糖构效关系的有效手段。目前人们对食用菌多糖构效关系的研究还仅限于对其一级结构的研究,还很不完善,须在现有的研究基础上,加快多糖结构研究的速度,争取在方法上有突破,深入了解其生物活性。第二,是食用菌多糖的提取纯化研究。随着对多糖认识的不断加深,寻找一种有效的提取方法是迫切需要解决的问题。目前提取多糖的方法很多,每种都有其优缺点。要根据提取物的性质、提取成本、工艺设备等选择适合的提取方法,提高多糖类的提取率,减少原材料的消耗[6]。第三,是食用菌多糖活性功能机理的研究。现人们对食用菌多糖的药理研究已有相当一段时间,虽取得较大进展,但创新研究很少。现在在这方面的研究多侧重在利用一些免疫指标分析其生物活性和免疫机理。
[1] 赵燕.袖珍菇栽培技术[J].中国食用菌,2006,25(1):59-60
[2] 于村,丁钢强,俞莎,等.香菇多糖测定的方法学研究[J].中国公共卫生,2000,16(3):245-246
[3] 顾红,于丽薇.食用菌多糖的保健作用探讨与提取工艺研究[J].哈尔滨师范大学自然科学学报,2008,24(5):87-89
[4] 唐启义,冯明光.实用统计分析及其计算机处理平台[M].北京:中国农业出版社,1997
[5] 黄纯,宋慧智,马驰,等.亮菌多糖提取工艺研究[J].安徽农业科学,2006,34(19):5027-5028
[6] Wojciech Jachymek,Jolanta Czaja,Tomasz Niedziela,et al.Structure studies of the specific polysaccharideof Haf nia alvei strain PCM 1207 lipopolysaccharide[J].Eur.J.Biochem,1999,266:53-61
