基于Ma t l a b的原料乳中金黄色葡萄球菌生长模型的分析
2014-05-07赵鑫鞠世颖周颖刘滨梁宏彰高晓峰郑遂霍贵成
赵鑫,鞠世颖,周颖,刘滨,梁宏彰,高晓峰,郑遂,霍贵成
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨150030)
金黄色葡萄球菌(Staphylococcus aureus)已被全世界公认为食品加工过程中卫生条件较差和引起食品腐败的主要原因[1]。葡萄球菌引起的食物中毒是由于摄入的食物中污染了耐热的金黄色葡萄球菌肠毒素(staphylococcal enterotoxin,SE)[2],肠毒素仅在金黄色葡萄球菌达到105cfu/g的情况下才会产生[3],如果食品在储备期间周围环境适合金黄色葡萄球菌的生长(例如时间和温度)时,肠毒素将产生,并且给消费者带来潜在的危害[4-5]。金黄色葡萄球菌的生长温度范围广泛,在7℃~48.5℃都可生长,最适生长条件为30℃~37℃[6],pH 4.0~10.0,耐盐浓度可达25%,这些特性使得金黄色葡萄球菌有广泛的生存空间,即使在较为恶劣的条件下也能存活很长时间。
在众多S型曲线函数中,Logistic方程和Gompertz方程能有效描述微生物生长,在腐败细菌生长动力学研究中被广泛使用[7-8]。近年来,人工神经网络(Artifi-cial Neural Network,ANN)逐渐被应用于科学研究,不同于其他非线性函数,ANN通过反复将输入输出模式提交给网络来调节高度非线性的神经网络结构,以便直接探索输入输出模式之间的关系[9]。
Matlab已被用于工程和科学研究中的诸多领域,它是一款在不同领域拥有多种专业工具箱的强大数学工具[10],Matlab提供了一个实验数据和电脑相连接的平台,取代了复杂的专业算法,Matlab的一些基础函数可被研究人员用于建立自己的Matlab工具箱,进而分析所得的实验结果。
本文利用Matlab编写程序,结合三种数学模型对金黄色葡萄球菌在12、25、37℃下的生长曲线进行拟合,并进行模型评价和分析,为原料乳的生产、运输及储藏过程中的金黄色葡萄球菌控制及检测提供理论依据。
1 材料与方法
1.1 材料与试剂
原料乳:市售。金黄色葡萄球菌标准菌株(ATCC 25923):乳品科学教育部重点实验室自存;3M快速金黄色葡萄球菌测试片:美国3M公司;
其他试剂均为分析纯。
1.2 仪器与设备
HPS-160生化培养箱:哈尔滨东联电子技术开发有限公司。
1.3 实验方法
1.3.1 金黄色葡萄球菌在原料乳中的培养及计数
参照GB4789.10-2010《食品微生物学检验金黄色葡萄球菌检验》第三法,利用3M金黄色葡萄球菌测试片,对金黄色葡萄球菌的纯培养物进行菌落计数,按照菌落计数结果取一定量菌液接种于符合要求的金黄色葡萄球菌阴性的巴氏灭菌乳中,取一定量的菌液离心尽量吸取上清液,用巴氏灭菌乳稀释,使接种终浓度在102CFU/mL~103CFU/mL范围内。将接种后的灭菌乳充分混匀后,以10 mL分装于6个中试管中,两管一组,然后分别置于12、25、37℃条件下进行培养。在12℃的情况下培养56 h,每4小时取1 mL样品,25℃培养28 h,每2小时取1 mL样品,37℃培养16 h,每1小时取1 mL样品,每次计数用生理盐水做3个倍数稀释,取1 mL添加到金黄色葡萄球菌测试片上。每个稀释度做两个平行。然后将3M快速金黄色葡萄球菌测试片放于37℃条件下培养,(24±2)h后计数。
1.3.2 原料乳中金黄色葡萄球菌生长模型的建立
分别以时间 t和 ln(N(t)/N0)为横、纵坐标,N0为初始菌数(CFU/mL),N(t)为 t时刻的细菌数,利用 Matlab分析不同温度条件下原料乳中金黄色葡萄球菌的生长数据,并根据对函数式的推导,求解描述微生物生长曲线特性的 3 个参数(μm,λ,A):最大比生长速率 μm(h-1)指对数期中拐点处的正切值,微生物生长的延滞期λ(h)是指该拐点处的切线与x轴的交点值,A=ln(Nmax/N0),Nmax是指稳定期微生物数量(cfu/mL)[11],模型函数及三个参数推导见表1。

表1 模型的函数式及参数Table 1 Functional equations and their parameters
以时间t为输入,ln(N(t)/N0)为输出,建立两层神经网络神经网络,第一层传递函数设置为tansig,第二层传递函数为purelin,网络训练函数为trainlm,其他均为默认缺省值,由于神经网络与非线性回归模型不同,不具有一定的函数表达式,无法求得(μm,λ,A)3 个参数,只能直观的从图像中表现出细菌的生长状态。
1.3.3 模型评价
模型建立完成后,需要将实验数据与预测值进行比较,以验证模型的准确性和可行性,通常采用的评价方法及函数的意义如表2[12-21]。

表2 评价方法及意义Table 2 Evaluations method and their significance
1.3.4 基于Matlab2012a的3种模型程序代码
1.3.4.1 Logistic和Gompertz模型


1.3.4.2 神经网络程序代码


利用本程序可直接从Excel中提取数据进行分析,将数据按时间为第一列,菌落计数结果为第二列存储在文件名为“zx.xls”的Excel文件中,便于操作。
2 结果与讨论
2.1 不同温度下金黄色葡萄球菌在原料乳中的一级生长模型
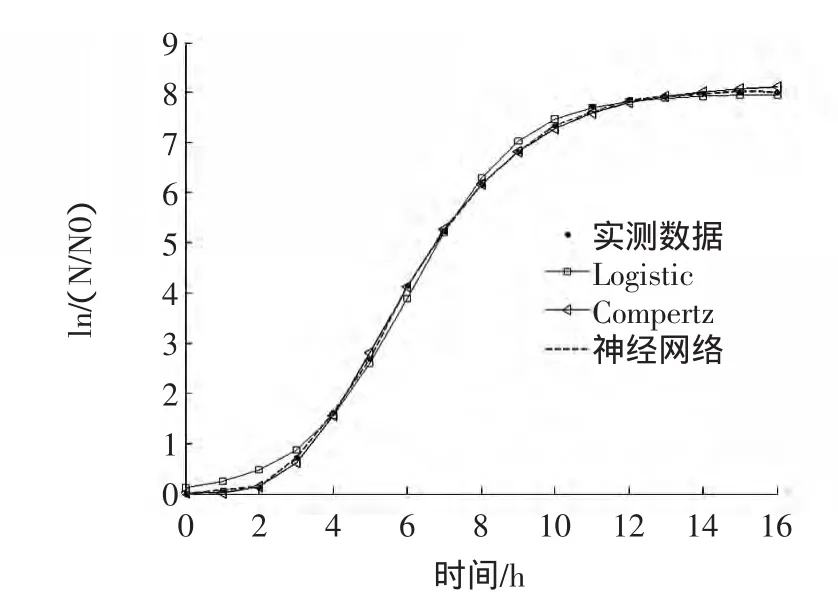
图1 原料乳中金黄色葡萄球菌的拟合曲线(37℃)Fig.1 Growth curves of Staphylococcus aureus in raw milk(37℃)

图2 原料乳中金黄色葡萄球菌的拟合曲线(25℃)Fig.2 Growth curves of Staphylococcus aureus in raw milk(25 ℃)

图3 原料乳中金黄色葡萄球菌的拟合曲线(12℃)Fig.3 Growth curves of Staphylococcus aureus in raw milk(12℃)
从图1~图3中可以直观的发现金黄色葡萄球菌在37℃的条件下生长较为迅速在14 h后达到稳定状态,而在25℃,即室温条件下在20 h后趋于稳定,在12℃的情况下生长颇为缓慢,需36 h才能达到最大生长量。并且在12℃~37℃温度范围内最大生长量随着温度的增加而增加。根据对实验数据的分析,在12、25、37℃条件下的Logistic模型稳定期时微生物数量A 分别为 1.9236、5.5581、7.9608;Gompertz模型稳定期时微生物数量 A分别为 1.9403、5.6158、8.1765。Logistic与Gompertz模型的函数式及微生物的最大比生长速率、延滞期时间见表3、4。

表3 Logistic模型及参数Table 3 Functional equation of Logistic and its parameters

表4 Gompertz模型及参数Table 4 Functional equation of Gompertz and its parameters
从表 3、4 中可以看出最大比生长速率 μm(h-1)随着培养温度的升高逐渐变大,但延滞期时间并没有特定规律,这是因为菌液的活化时间不同所引起的,菌液的活化时间直接影响了菌液的生长活性,因此本文只采用最大比生长速率μm(h-1)建立二级模型。
表5为通过程序计算出的10种常用的针对函数拟合的评价函数值,本文以修正决定系数R2Adj,均方误差MSE,预测标准误差SEP为主对三种模型进行了对比(表5中斜体),其余7种可适当参考,针对不同需求选取不同的评价函数。修正决定系数R2Adj,对R2的进一步修正,避免了由于样本大小和变量参数数目对拟合度的影响[14],R2Adj的值越接近于1,预测模型对实验数据的拟合度越高,从表5中R2Adj的值可以看出在12 ℃条件下,拟合度 Gompertz>ANN>Logistic,而在 25、37℃的条件下,ANN>Gompertz>Logistic,ANN 模型的R2Adj值为1,可见ANN在拟合函数方面的优越性;均方误差MSE,适用于评价预测模型的优劣和数据的变化程度,MSE的值越小,说明模型的精确度越好[16],根据表5数据可以发现在12℃的条件下Gompertz的精确度优于ANN,而在25、37℃这两个温度下精确度ANN>Gompertz>Logistic;预测标准误差 SEP 是指预测模型预测值和实验观测值差异的标准偏差,可以用来衡量和验证模型的准确度,SEP的值越小,说明模型对实验数据的描述性越好,比较表5的数值可以看出,在12℃的条件下Gompertz优于ANN,但数值大小相差不多,而在25、37℃这两个温度下3个钟模型的数值相差较为明显,ANN>Gompertz>Logistic。通过对三种评价函数的比较我们可以得出结论在拟合度、精确度、准确度这3个方面,ANN即神经网络均优于其他的两种模型,但神经网络也存在着一定的局限性,一是无函数表达式,无法对函数进行进一步的数学推导,二是存在过度拟合的局限性,一旦数据变化较大模型的形态将发生巨大变化,综合以上述原因,本文考虑以Gompertz模型所求得的最大比生长速率 μm(h-1)建立二级模型,进一步描述最大比生长速率μm(h-1)与温度之间的函数关系。

表5 评价方法的数值结果Table 5 The result of evaluations method
2.2 二级模型的建立
根据一级模型所求得的最大生长速率,利用Matlab2012a建立生长速率与温度的平方根模型,程序代码如下


图4 最大比生长率μm与温度间的关系Fig.4 Relationship of temperature with μm
所得拟合方程如下

方程相关系数为0.823 1,大于0.8说明相关性较强,模型的建立存在一定的意义。由该方程可推算出,在温度为8.958 0℃时最大比生长速率为0,即在9℃以下金黄色葡萄球菌几乎不生长。并且,在12℃~37℃范围内,随着温度的升高金黄色葡萄球菌的最大生长率逐渐增加。
3 结论与讨论
针对金黄色葡萄球菌的生长有很多影响因素,如温度,pH,水活度等,但在原料乳中比较容易发生大范围变化的主要是温度,因此本文选取温度进行研究,12℃为运送原料奶过程中的最高温度,25℃为常温,在原料乳的生产加工过程中比较常见,最后37℃为金黄色葡萄球菌生长的最适温度,也是奶牛体温,原料奶的初始温度,选取这3个具有代表性的温度关键点进行研究,大大提高了该研究的实用性。在模型的建立中,应用实验数据的自然对数值使得模型的拟合效果更好[11],并且以Matlab2012a为平台编写了模型的一级、二级程序及模型评价函数,解决了由于原料乳成分的复杂性而造成的生长模型存在较大差异的问题,为微生物生长模型的建立提供方便。
由以上的结果可以发现,针对金黄色葡萄球菌的一级生长模型,ANN的拟合特性最好(见表5),各评价函数均优于Gompertz和Logistic,但考虑到其过度拟合的性质和没有函数表达式的缺点,最终确定以Gompertz的一级模型所求得的最大比生长率μm(h-1)建立金黄色葡萄球菌的二级模型,预测金黄色葡萄球菌的生长特性与温度间的函数关系,在9℃~37℃范围内金黄色葡萄球菌的最大比生长率随温度的升高而变大,对于9℃以下,金黄色葡萄球菌几乎不生长。生长环境的不同可能导致金黄色葡萄球菌的生长特性发生一定变化,这也是二级模型的相关系数仅为0.823 1的原因,因此模型无法精确的反应金黄色葡萄球菌复杂的生长特性,但能反映微生物大体的生长趋势,对乳制品生产过程中病原菌的检测有一定的指导意义。
[1] Soriano J M,Font G,Moltó J C,et al.Enterotoxigenic staphylococci and their toxins in restaurant foods[J].Trends in Food Science&Technology,2002,13(2):60-67
[2] Scherrer D,Corti S,Muehlherr J E,et al.Phenotypic and genotypic characteristics of Staphylococcus aureus isolates from raw bulktank milk samples of goats and sheep[J].Veterinary Microbiology,2004,101(2):101-107
[3] Notermans S,Heuvelman C J.Combined Effect of Water Activity,pH and Sub-optimal Temperature on Growth and Enterotoxin Production of Staphylococcus aureus[J].Journal of Food Science,1983,48(6):1832-1835
[4] Notermans S,Van Otterdijk R L M.Production of enterotoxin A by Staphylococcus aureus in food[J].International Journal of Food Microbiology,1985,2(3):145-149
[5] Todd E C D,Greig J D,Bartleson C A,et al.Outbreaks where food workers have been implicated in the spread of foodborne disease.Part 4.Infective doses and pathogen carriage[J].Journal of Food Protection,2008,71(11):2339-2373
[6] Schmitt M,Schuler-Schmid U,Schmidt-Lorenz W.Temperature limits of growth,TNase and enterotoxin production of Staphylococcus aureus strains isolated from foods[J].International journal of food microbiology,1990,11(1):1-19
[7] Dalgaard P,Vancanneyt M,Euras Vilalta N,et al.Identification of lactic acid bacteria from spoilage associations of cooked and brined shrimps stored under modified atmosphere between 0℃and 25℃[J].Journal of applied microbiology,2003,94(1):80-89
[8] Koutsoumanis K,Nychas G J E.Application of a systematic experimental procedure to develop a microbial model for rapid fish shelf life predictions[J].International Journal of Food Microbiology,2000,60(2):171-184
[9] Hajmeer M,Basheer I,Cliver D O.Survival curves of Listeria monocytogenes in chorizos modeled with artificial neural networks[J].Food microbiology,2006,23(6):561-570
[10]Chapman S J.MATLAB programming for engineers[M].Cengage Learning,2008
[11]Zwietering M H,Jongenburger I,Rombouts F M,et al.Modeling of the bacterial growth curve[J].Applied and environmental microbiology,1990,56(6):1875-1881
[12]Karunakaran K,Thamilarasu P,Sharmila R.Statistical study on physicochemical characteristics of groundwater in and around Namakkal,Tamilnadu,India[J].Journal of Chemistry,2009,6(3):909-914
[13]Ding T,Rahman S M E,Purev U,et al.Modelling of Escherichia coli O157:H7 growth at various storage temperatures on beef treated with electrolyzed oxidizing water[J].Journal of Food Engineering,2010,97(4):497-503
[14]Snedecor G W,Cochran W G.Statistical methods[M].8th ed.Iowa:Iowa University Press,1989:360-362
[15]Huang L.Thermal inactivation of Listeria monocytogenes in ground beef under isothermal and dynamic temperature conditions[J].Journal of food engineering,2009,90(3):380-387
[16]Cayré M E,Vignolo G,Garro O.Modeling lactic acid bacteria growth in vacuum-packaged cooked meat emulsions stored at three temperatures[J].Food microbiology,2003,20(5):561-566
[17]Lebert I,Robles-Olvera V,Lebert A.Application of polynomial models to predict growth of mixed cultures of Pseudomonas spp.and Listeria in meat[J].International Journal of Food Microbiology,2000,61(1):27-39
[18]Ross T.Indices for performance evaluation of predictive models in food microbiology[J].Journal of applied microbiology,1996,81(5):501-508
[19]Oscar T P.Response surface models for effects of temperature,pH,and previous growth pH on growth kinetics of Salmonella typhimurium in brain heart infusion broth[J].JournalofFoodProtection,1999,62(2):106-111
[20]Bang W S,Chung H J,Jin S S,et al.Prediction of Listeria monocytogenes growth kinetics in sausages formulated with antimicrobials as a function of temperature and concentrations[J].Food Sci Biotechnol,2008,17(6):1316-1321
[21]Dong Q,Tu K,Guo L,et al.Response surface model for prediction of growth parameters from spores of Clostridium sporogenes under different experimental conditions[J].Food microbiology,2007,24(6):624-632
