根皮苷的微生物转化筛选及消耗率的测定
2014-05-07马卫俊延慧君宋新波刘岱琳
马卫俊,延慧君,宋新波,刘岱琳,*
(1.天津中医药大学,天津300193;2.中国人民武装警察部队后勤学院,天津300162)
根皮苷(Phlorhizin)多存在于苹果属的多种植物(苹果,杜梨,海棠等)中,在根、茎、叶和果实中均有分布[1]。根皮苷是一种二氢查耳酮苷类化合物[2],也是苹果中的特征酚类物质[3-4],由于具有良好抗氧化[5]、防治糖尿病及其并发症[6-8]、抗癌、美白[9]作用,因而引起人们的广泛关注。根皮苷不仅具有上述功能,同时也是一种甜度较高的天然非糖甜味剂,其甜度是葡萄糖的300倍[10],对于甜食爱好者和糖尿病人是一种理想的糖类替代品[11],并且具有低毒的特点[12]。因此在新型药物和功能性食品的开发中其已经成为重要的一种功能性成分[1]。有研究发现,微生物转化反应可以对黄酮类化合物进行结构修饰并获得结构新颖的化合物[13]。因此本文分别用24种真菌对根皮苷进行了转化,采用RP-HPLC分析结果,筛选出了对根皮苷具有转化作用的菌种,同时计算根皮苷底物的消耗率。其研究结果将确定能对根皮苷实现微生物转化的菌种,为后续利用微生物转化方法对根皮苷进行结构修饰,为功能食品的研发提供更具价值的先导化合物奠定基础。
1 材料与方法
1.1 材料与试剂
根皮苷标准品(纯度为98%):天津市科曼思特医药科技发展有限公司;根皮苷试药(纯度为90%):天津市尖峰天然产物研究开发有限公司;无水乙醇(分析纯)、乙腈(色谱纯):天津市康科德科技有限公司;纯净水:娃哈哈饮料有限公司;24种菌种:中科院微生物菌种库。
1.2 仪器与设备
SW-CJ-2FD双人单面净化工作台:苏州净化设备有限公司;HZQ-QX全温振荡器:哈尔滨东联电子技术开发有限公司;SB-2000旋转蒸发仪:瑞士BUCHI公司;SHB-ⅢS循环水式多用真空泵:郑州长城科工贸有限公司;FA1204B电子天平:上海精密科学仪器有限公司;岛津高效液相色谱仪(包括LC-20AT双泵、SPDM20A UV检测器、CTO-20A柱温箱):日本岛津公司;phenomenexLunaC18色谱柱(250mm×4.6mm,5μm)。
1.3 方法
1.3.1 色谱条件
流动相 A 相:冰醋酸 ∶水=1∶99(V/V),B 相:乙腈 ∶水 ∶冰醋酸=70 ∶29.8 ∶0.2(V/V/V),进行梯度洗脱:0(0%B)-20(25%B)-50(35%B)-80(60%B)-85 min(0%B);流速:1.0 mL/min;检测波长:280 nm。
1.3.2 标准品溶液的配制
精密称取根皮苷对照品,加色谱甲醇溶解并定容于25 mL容量瓶中,制成质量浓度为0.984 0 mg/mL的母液,用0.45 μm微孔滤膜过滤,4℃保存备用。
1.3.3 根皮苷的微生物转化与分析样品的制备[14]
把保存在固体斜面培养基中的24种真菌分别接种到200 mL液体土豆培养基中,每种真菌设置空白组和给药组,于全温振荡器中在160 r/min,28℃条件下培养48 h后,给药组加入6 mL的根皮苷(质量浓度为10 mg/mL)无水乙醇溶液,空白组加入6 mL的无水乙醇试剂。继续在相同条件下培养96 h后,将转化液分别超声20 min,过滤,滤液用等体积的正丁醇萃取3次,萃取液浓缩至干,甲醇溶解并定容于25 mL容量瓶中,即得到该菌的给药样品溶液和空白样品溶液,待测。
1.3.4 对根皮苷具有转化作用的菌种筛选[15]
根据“1.3.1”色谱条件,每种真菌的给药样品溶液和空白样品溶液进样20 μL,把每种真菌的给药组、空白组图谱及根皮苷的标准品图谱进行对比,分析给药组除根皮苷峰外是否比空白组多出明显的峰,从24种真菌中筛选出对根皮苷有转化作用的真菌。
对有转化作用的3种真菌进行消耗率的测定:将已形成孢子的斜面菌种,在无菌条件下注入无菌生理盐水10 mL,刮菌苔,用无菌四层纱布过滤,用力振荡滤液1 min,制成孢子悬液。经血球计数板对种子液计数得到孢子数数量级均为104CFU/mL,由此可知,3种真菌孢子悬液浓度近似一致,具有可比性。分别将此浓度的三种真菌孢子悬液1 mL接入到液体土豆培养基中,其后处理同“1.3.3”。
2 结果与分析
2.1 根皮苷含量测定结果[16-18]
2.1.1 系统适用性实验
取“1.3.2”中的对照品溶液 20 μL,注入液相色谱仪,按“1.3.1”下色谱条件进行测定,色谱图见图1。
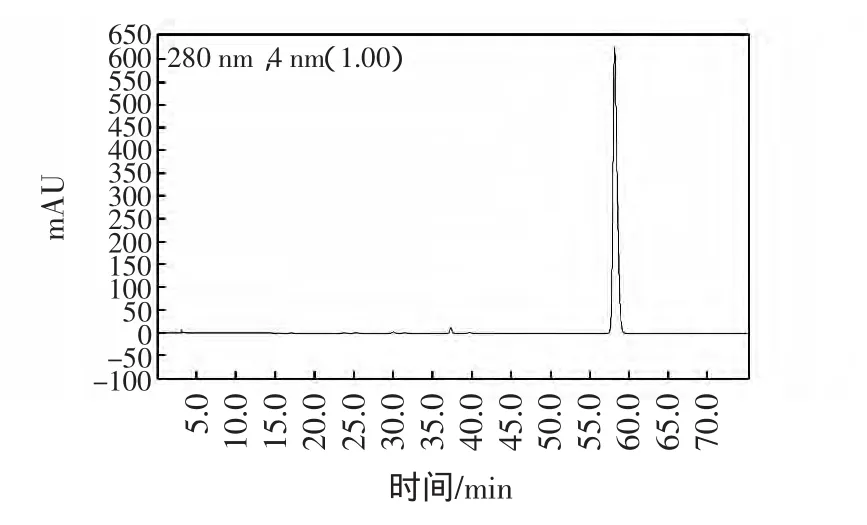
图1 根皮苷的高效液相色谱图Fig.1 HPLC chromatograms of Phlorizin
根皮苷的保留时间为57.95 min。精密量取标准品溶液 1.0、2.0、4.0、6.0、8.0 mL,置于 10 mL 容量瓶中,加甲醇稀释至刻度。按“1.3.1”色谱条件分别进样20 μL进行测定。以对照品峰面积Y/mV为纵坐标,以对照品质量浓度X/(mg/mL)为横坐标,绘制标准曲线。得根皮苷回归方程为:Y=4×107X+44 514(R2=0.999),结果表明在0.098 40 mg/mL~0.787 2 mg/mL范围内,进样量与峰面积呈良好线性关系。
2.1.2 精密度试验
取上述根皮苷对照品溶液连续进样5次,每次20 μL,测得各次峰面积的RSD为1.02%。结果表明,此分析方法精密度良好。
2.1.3 稳定性试验
取同一批样品,按样品溶液测定方法操作,分别在 0、2、4、6、8、12 h 进行测定,其 RSD 为 1.71%,结果表明样品溶液在12 h内测定稳定性良好。
2.2 根皮苷微生物转化结果
2.2.1 对根皮苷具有转化作用的菌种筛选结果
根据“1.3.1”色谱条件,每种真菌的给药样品溶液和空白样品溶液进样20 μL,把每种真菌的给药组、空白组图谱及根皮苷的标准品图谱进行对比,分析给药组除根皮苷峰外是否比空白组多出明显的峰,经分析从24种真菌中筛选出了3种对根皮苷有转化作用的真菌,即 AS3.739、AS3.2875、AS3.3450。3 种真菌除根皮苷峰外比空白都多出了明显的峰。这3种真菌的转化率测定的HPLC图谱见图2。

图2 3种真菌对根皮苷转化的液相图Fig.2 HPLC of biotransformation of Phlorizin by three kinds of fungi
2.2.2 加样回收率实验
取已知含量的转化后样品,按“1.3.6”方法制备供试溶液,精密吸取同一供试品溶液3份,每份0.1 mL,置于25 mL容量瓶中,分别加入0.1、0.08、0.05 mL根皮苷对照品溶液,按“1.3.2”色谱条件分别进样测量峰面积,计算测得量及其回收率,结果见表1。
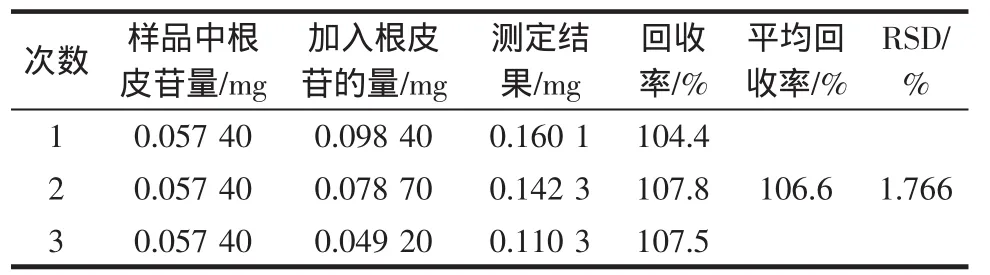
表1 根皮苷的加样回收率Table 1 Results of Phlorizin recovery
结果表明,本实验的处理方法对根皮苷具有较高的回收率。
2.2.3 重复性实验
按照“2.1”的色谱条件,分别对有转化作用的菌种AS3.739、AS3.2875、AS3.3450 的加药样品进行液相分析,每种真菌平行操作6份,测得这3种真菌的剩余根皮苷峰面积的RSD值分别为0.21%、2.29%、1.21%。
2.2.4 培养基中根皮苷回收率的测定
3组液体土豆培养基中分别加入6 mL根皮苷(质量浓度为10 mg/mL)无水乙醇溶液,按照样品的制备方法培养,萃取真空浓缩干燥,用色谱甲醇溶解定容至25 mL。各取适量用0.45 μm滤膜过滤,进样20 μL,测得根皮苷的峰面积,根据标准曲线的回归方程计算出根皮苷的含量。根皮苷的回收率=根皮苷质量(mg)/60 mg×100%,结果见表 2。

表2 培养基中根皮苷的回收率Table 2 The loss of Phlorizin in medium(n=3)
结果表明,本实验的培养方法对根皮苷具有较高的回收率,符合菌种筛选的要求。
2.2.5 根皮苷消耗率的测定
从有转化的3种真菌的给药组供试液中各取适量,在“1.3.1色谱条件下进样分析,测得根皮苷平均峰面积(n=3),根据回归方程求得剩余的根皮苷,算出消耗率。消耗率=(加药量-剩余量/回收率)/加药量×100%,结果见表3。
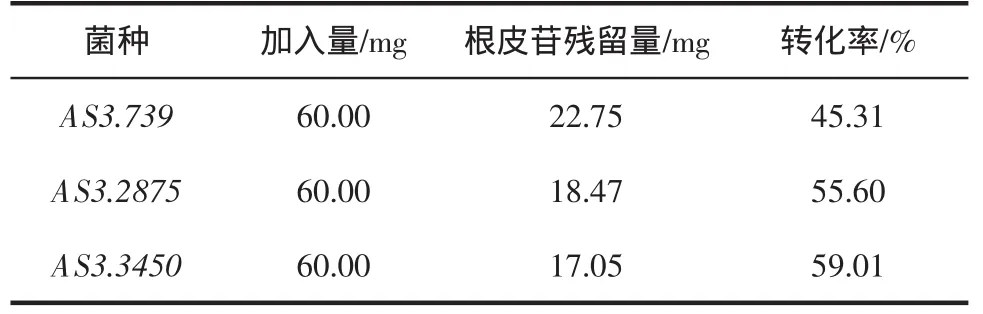
表3 消耗率结果Table 3 The results of consumption rate
结果表明,本实验所筛选的菌种对根皮苷有一定的消耗作用,但是要获得该菌种生物转化根皮苷的最佳条件,有待于进一步研究。
3 结论
通过实验,最后得出有3种真菌(AS3.739、AS3.2875、AS3.3450)对根皮苷有转化作用,为进一步深入研究其转化产物奠定基础。当液体培养基中底物浓度为0.3 mg/mL时,利用RP-HPLC法测定了3种真菌对根皮苷的消耗率分别为45.31%,59.01%,55.60%。本文建立的检测方法简便快速,使根皮苷的进样量在0.098 40 mg/mL~0.787 2 mg/mL内,峰面积和进样量之间线性关系良好。
RP-HPLC法能确定溶液中的物质,并能准确的测定其含量,且和TLC法相比,灵敏度高、准确、重现性好,为根皮苷微生物转化的进一步扩大生产奠定基础。
对比空白组和转化组HPLC图谱,转化组除了根皮苷和转化点的峰外,其它峰和空白组存在一定差异,其原因可能是加入的根皮苷对真菌的生长产生一些影响,所以会从图谱中看出一些差异。
同时,培养基组成、培养温度、摇床转速、转化时间、底物加入量等对微生物转化的影响也是很大的,这些因素不仅影响消耗率,还可能对转化产物的种类有所影响。在后续的研究过程中,本课题组将深入研究根皮苷的转化产物及转化条件,以期获得该菌株生物转化根皮苷的最佳条件。
[1] 方荣,杨茜,李莉,等.湖北海棠中根皮苷含量测定[J].实用医学进修杂志,2007,35(4):247-249
[2] 贺建荣,刘雪英,王庆伟,等.反相高效液相色谱法测定根皮苷原料药的含量[J].南方医科大学学报,2011,31(4):711-713
[3]VERSAR A,BIESENBRUCH S,BARBANTI D,et al.Adulteration of fruit juices:Dihydrochalcones as quality markers for apple juice identification[J].Wiss u Technol,1997,30:585-589
[4]CUSHMAN D W,CHEUNG H S.Spectrophotometric assay and properties of the angiotenxin-converting enzyme of rabbit lung[J].Biochemical Pharmacology,1971,20:1637-1648
[5 LOTITO S B,FREI B.Relevance of apple polyphenols as antioxidants in human plasma:contrasting in vitro and in vivo effects[J].Free Radic Biol Med,2004,36(2):201-211
[6] 董华强,宁正祥.根皮苷与糖尿病防治[J].食品科技,2006(12):192-195
[7] SHAO Xi,BAI Nai-sheng,HE Kan,et al.Apple Polyphenols,Phloretin and Phloridzin:New Trapping Agents of Reactive Dicarbonyl Species[J].Chem Res Toxicol,2008,21(10):2042-2050
[8] WANG Qin,QIU Ling,CHEN Xiang-ren,et al.Inhibitory effects of phloridzin dihydrate on the activity of mushroom(Agaricus bisporus)tyrosinase[J].Bioorganic&Medicinal Chemistry,2007,15:1568-1571
[9] 谢阳,赖维,万苗坚,等.荔枝果皮中的美白剂根皮苷的提取、纯化及鉴定[J].中国美容医学,2008,17(7):1032-1034
[10]杨大坚.甜茶化学成分研究I甜味成分[J].中草药,1991(3):99-100
[11]EHRENKRANZL J R L,LEWIS N G,KAHN C R,et al.Phlorizn:a review[J].Diabetes/Metabolism Research and Reviews,2005,21(1):31-38
[12]冯雪娇,曹学丽,李艳,等.根皮苷的应用及分离纯化研究进展[J].北京工商大学学报:自然科版,2008,26(4):13-16
[13]王园园,刘吉华,余伯阳.Streptomyces griseus ATCC 13273对4中黄酮生物转化的初步研究[J].药物生物技术,2005,12(5):308-311
[14]刘莹,刘岱琳,韩学良,等.齐墩果酸的微生物转化筛选及转化率的测定[J].沈阳药科大学学报,2010,27(2):139-141,162
[15]张泽生,王炫,段殷,等.熊果酸的微生物转化筛选及消耗率的测定[J].沈阳药科大学学报,2011,28(5):387-390,416
[16]殷法杰,秦国培,蒋海强,等.杜梨叶中根皮苷含量测定[J].山东中医杂志,2011,30(3):200,215
[17]阚周密,林建阳,王戏丹.气相色谱-质谱联用法测定食品中富马酸二甲酯的含量[J].食品科学,2007,28(1):247-249
[18]冉军舰,樊明涛,赵政阳,等.高效液相色谱法测定不同品种苹果芽中根皮苷的含量[J/OL].食品科学,(2013-01-07)[2013-1-18].http://www.cnki.net/kcms/detail/11.2206.TS.20130107.1636.059.html
