对进出口食品中亚硫酸盐测定方法的改进研究
2014-05-07廖和菁覃文长薛明薇孙高英胡礼渊李萍黄素萍
廖和菁,覃文长,薛明薇,孙高英,胡礼渊,李萍,黄素萍
(广西东兴出入境检验检疫局,广西东兴538100)
亚硫酸盐常作为漂白剂、保色剂、防腐剂、还原剂应用于果脯、蜜饯、葡萄酒及薯类淀粉等进出口食品中[1]。但研究表明,过多地摄入亚硫酸盐,会导致头痛、恶心、眩晕和气喘等过敏反应[2],同时易刺激呼吸道,损害支气管和肺[3],对人体的呼吸系统,胃、肠等器官都会有一定的损害[4],且食品中使用的硫磺多为纯度不高的工业硫磺,还含有砷等有害微量元素[5];此外,亚硫酸盐在体内还能转化成一种致癌物质亚硝胺,对人体的健康造成严重危害[6]。
因此,亚硫酸盐的检测在食品工业中显得尤为重要。目前国内外测定亚硫酸盐的方法,主要有美国采用MonierWilliams法[7],日本采用通氮蒸馏-滴定法和盐酸副玫瑰苯胺比色法[8],AOAC法[9],目前我国采用的是GB/T 5009.34-2003《盐酸副玫瑰苯胺比色法》[10]来检测亚硫酸盐含量,其原理是亚硫酸盐与四氯汞钠反应生成稳定的络合物,再与甲醛及盐酸副玫瑰苯胺作用生成紫红色络合物,与标准系列比较定量。该法原理简单,可同时处理大批量样品,能够满足进出口食品快速检测的需求;但也存在一些不足,如操作繁琐、检测周期长,灵敏度低、显色体系不稳、盐酸加入量难于判断,导致重现性差,检测误差较大,因此本文对GB/T 5009.34-2003《盐酸副玫瑰苯胺比色法》进行了改进研究,通过实验缩短盐酸副玫瑰苯胺比色法的检测时间,改进SO2标准溶液的配制方法,同时研究了盐酸的最佳加入量,及有色样品中SO2含量的测定,以获得操作简捷,灵敏度高、反应速度快、重现性好,适用范围广的SO2检测方法。
1 材料与方法
1.1 主要仪器与试剂
UV-2501PC紫外可见分光光度计:日本岛津;25mL具塞比色管;100 mL容量瓶;四氯汞钠吸收液;氨基磺酸铵(12 g/L);甲醛溶液(2 g/L);盐酸副玫瑰苯胺;亚硫酸氢钠;0.1 mol/L硫代硫酸钠标准溶液;冰乙酸。
1.2 方法
1.2.1 样品的前处理方法的改进
GB/T 5009.34-2003《盐酸副玫瑰苯胺比色法》中样品试样,需粉碎过筛,浸泡4 h以上,以使样品中的SO2完全被吸收,整个实验周期比较长,目前超声波技术常用于药品、食品等样品的前处理,它有加速分散,助溶,加速化学反应等特点[11]。且操作方便省时省力,同时能大大提高检验效率等优点。本论文拟采用超声波处理水不溶性固体样品,并与浸泡法进行对比。
1.2.2 SO2标准溶液配制方法的改进
GB/T 5009.34-2003《盐酸副玫瑰苯胺比色法》中亚硫酸氢钠采用四氯汞钠吸收,此方法配制的标准溶液存在不稳定,容易氧化变质,每次实验前需要重新标定等缺陷。由于SO2在弱碱性溶液中能够稳定存在,本文拟先测定固体试剂NaHSO3中SO2的纯度,然后根据其已知的SO2纯度,用0.1 mol/L的NaOH溶液配制成SO2标准溶液。
SO2标准溶液配制:称取0.5 g亚硫酸氢钠(NaHSO3)于100 mL容量瓶中,加水溶解至刻度,标定方法同GB/T 5009.34-2003《盐酸副玫瑰苯胺比色法》中二氧化硫标准溶液的测定。经测定SO2的纯度为0.62mg/mg,换算成NaHSO3质量为199.7 mg,称好后置于100 mL容量瓶内用0.1 mol/L NaOH溶液溶解,并稀释至刻度,该溶液SO2浓度为1.00 mg/mL,作为储备液。用前用水将其稀释成0.1 mg/mL,最后再用四氯汞钠吸收液稀释至2.0 μg/mL作为使用液。其它试剂与GB/T 5009.34-2003《盐酸副玫瑰苯胺比色法》法相同。
1.2.3 盐酸副玫瑰苯胺中盐酸加入量的研究
在GB/T 5009.34-2003《盐酸副玫瑰苯胺法》中,盐酸的加入量没有给出具体的数值,只是通过观察溶液颜色由红变黄来判断终点,但是对于初学者来说,常常因为颜色很难判断准确而导致实验失败,本文对盐酸副玫瑰苯胺中盐酸的酸度范围进行了研究,选择合适的酸度以同时满足空白低和灵敏度高的要求。
1.2.4 有色食品中SO2含量的测定
对于颜色较深的物质,如玫瑰红色的葡萄酒,采用国标法直接测定,可能存在干扰物质产生假阳性的结果[12],且国标法中没有说明对于此类产品怎样扣除干扰等问题[13]进行亚硫酸盐含量的测定。据报道,采用活性炭吸附色素类物质来消除干扰的效果较好[14],因此本论文拟研究活性炭的最佳用量,并通过加标回收试验验证方法的可靠性。
2 结果与分析
2.1 对水不溶性固体样品的前处理改进结果比较
分别采用超声波法和传统的浸泡法对几种进出口食品进行前处理,测得亚硫酸盐含量如表1所示。

表1 不同前处理方法测定亚硫酸盐含量对比Table 1 The comparison of different pre-processing for colorimetric determination of sulfites mg/kg
对上述数据进行统计学分析,浸泡5 h,与超声波40 min、50 min之间的数据,经 t检验,P > 0.05,说明两种方法的检测结果无显著性差异。但考虑到检测效率,采用超声波40 min来代替浸泡法对水不溶性的固体样品进行前处理,可缩短检测周期。
2.2 SO2标准溶液的配制及纯度的标定
本论文中所采用的SO2标准溶液的配制方法,可直接称取NaHSO3配置成所需浓度的SO2标准溶液,使用时不需标定。对于NaHSO3固体试剂在密封良好的情况下,对其SO2含量进行监测,其含量在一年内没有变化,按此方法配置的SO2标准溶液置于4℃冰箱中其浓度在3个星期变化不大,一个月后需要重新配制。因此本实验SO2标准溶液的配制方法的改进,为检测工作带来极大的方便。
2.3 盐酸副玫瑰苯胺中盐酸浓度的研究
盐酸浓度对盐酸副玫瑰苯胺的空白值和灵敏度的影响如表2和图1所示。
从表2和图1可以看出,盐酸浓度为0.5 mol/L、0.6 mol/L时灵敏度高,但是空白值也高(0.136、0.103)盐酸副玫瑰苯胺溶液中盐酸浓度为0.7 mol/L~1.0 mol/L之间时空白吸光度较低(0.086~0.062),并且灵敏度较高。选择盐酸浓度为0.7 mol/L。测得的SO2标准曲线数值见表3。

表2 盐酸副玫瑰苯胺法中盐酸浓度与吸光值间的联系Table 2 The connection between hydrochloric acid concentration and absorption value by hydrochloric para-rosaniline method

图1 盐酸浓度对空白值及标准吸光度值的影响Fig.1 Effect of different hydrochloric acid concentration to absorbance of blank and the standard solution deducting blank
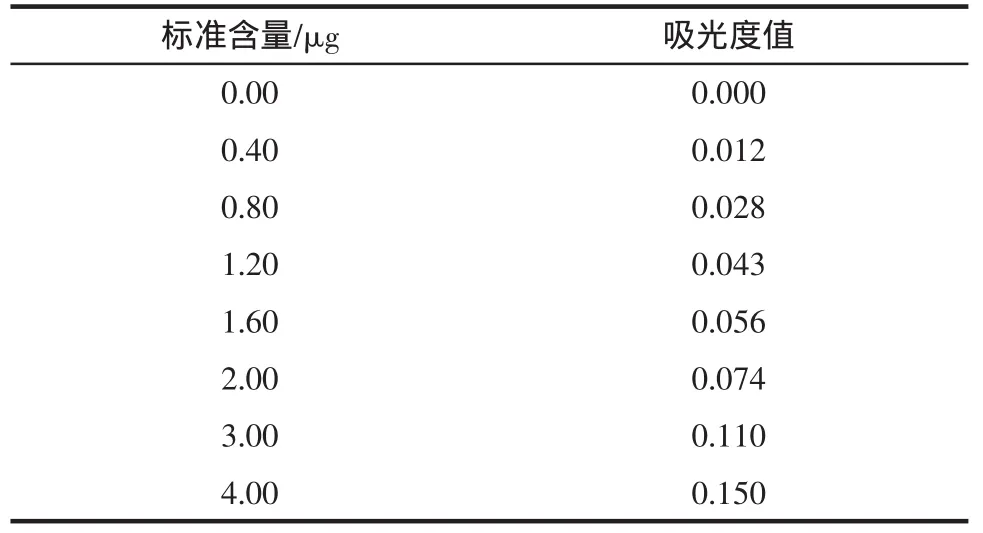
表3 盐酸副玫瑰苯胺法测定SO2标准曲线Table 3 The standard curve of sulfur dioxide determined by hydrochloric para-rosaniline method
此标准曲线线性方程y=0.037 7x-0.002 1,相关系数R2=0.999 3。最低检出量为0.1 μg,而国标要求为1 μg,提高了方法的灵敏度。
2.4 红葡萄酒中SO2含量测定

图2 盐酸副玫瑰苯胺测定SO2标准曲线Fig.2 The standard curve of sulfur dioxide determined by hydrochloric para-rosaniline method
本实验采用活性炭对红葡萄酒脱色后,再测定其SO2含量测定。移取红葡萄酒10 mL于100 mL容量瓶中,用少量蒸馏水稀释后,加入20 mL四氯汞钠吸收液摇匀,浸泡4 h以上,用水定容至100 mL。分别取0.5、1.0、1.5 g活性炭于滤纸上,过滤滤液备用。滤液中SO2含量的测定同GB/T 5009.34《盐酸副玫瑰苯胺比色法》。每个样品做3次平行试验,实验结果见表4。

表4 活性炭用量与吸光值精密度的关系Table 4 The relationship between carbon dosage and absorbance precision
从表4可知,活性炭用量为0.5、1.0、1.5 g时,吸光度值变化不大,综合成本考虑,确定活性炭的最佳添加量为0.5 g。并同时做3组加标试验,分别加入1、2、3 μg二氧化硫标准溶液,加标回收实验结果见表5。

表5 二氧化硫加标回收实验Table 5 The test of recovery of sulfur dioxide
由表5可知,采用活性炭吸附有色物质的方法具有较高的回收率,进一步验证了方法的可行性。
3 结论
对GB/T 5009.34《盐酸副玫瑰苯胺比色法》进行了改进研究,采用超声波法代替传统的浸泡法可极大缩短检测时间,改进了SO2标准溶液的配制方法,减少了标定的频率,并延长了SO2标准溶液的贮存时间,确定了盐酸副玫瑰苯胺中盐酸的最适浓度,采用活性炭吸附法消除葡萄酒中的有色干扰避免了假阳性的出现。经改进后的盐酸副玫瑰苯胺比色法操作简单易控,重现性好、灵敏度和可信度高。但由于盐酸副玫瑰苯胺比色法中需使用的四氯汞钠是一种有毒物质,对检验人员的身体健康及环境都存在一定的威胁,因此在下一步的研究中,将重点开发安全、快速的检测技术。
[1]张汉鹏.食品中二氧化硫的快速测定[J].科技创新与应用,2012(34):94
[2] 王刚,贺东霞,王丹.香菇中二氧化硫测定方法改进探索[J].农业机械,2012(15):125-128
[3] Bernstein Jonathan A,Alexis Neil,Barnes Charles,et al.Health effectsofairpollution[J].TheJournalofallergyandclinicalimmunology,2004,114(5):1116-1123
[4] Meng Z.Oxidative damage of sulfur dioxide on various organs of mice:sulfur dioxide is a system oxidative damage agent[J].Inhal Toxicol,2003,15:181-195
[5] 王丽丽,纪淑娟,李顺.食品中二氧化硫及亚硫酸盐的作用与检测方法[J].食品与药品,2007,9(2):64-66
[6] 扈美庄,李秀娟,陈奕鹏.果脯中二氧化硫含量检验及2种测定方法的比较[J].职业与健康,2008,24(5):431-432
[7] Hillery B,Elkins E,warner C,et al.Optimized Monier Williams method for determination of sulfites in foods:Colladorative study[J].AOAC,1989,72(3):470-475
[8] 日本药学会.卫生试验法·注解[M].北京:华文出版社,1995:66-67
[9]中国光学会光谱专业委员会.AOAC分析方法手册(上册)[M].1984:708-709
[10]中华人民共和国卫生部.GB/T 5009.34-2003食品中亚硫酸盐的测定[S].北京:中国标准出版社,2003
[11]钟赛意,王善荣,刘寿春.超声波技术在动物食品中的应用[J].2006(11),33-36
[12]李忠波,汤慕雷,张家友.食品中配制盐酸副玫瑰苯胺溶液的方法改进[J].中国卫生检验杂志,2000,10(5):625-626
[13]苏少英.测定食品中亚硫酸盐的盐酸副玫瑰苯胺配制方法的改进[J].冷饮与速冻食品工业,2000(2):20
[14]安文佳,李伟明,赵涛,等.盐酸副玫瑰苯胺法测定进口葡萄酒中二氧化硫的方法补充[J].食品研究与开发,2010,31(9):144-146
