N-叔丁基-α-苯基硝酮对大鼠脊髓损伤后神经生长因子表达的影响
2014-05-06刘少辉刘伟邱少汕徐锡金
刘少辉,刘伟,邱少汕,徐锡金
N-叔丁基-α-苯基硝酮对大鼠脊髓损伤后神经生长因子表达的影响
刘少辉,刘伟,邱少汕,徐锡金
目的观察N-叔丁基-α-苯基硝酮(PBN)对脊髓损伤大鼠脊髓组织和血清中神经生长因子(NGF)蛋白表达的影响。方法174只健康雌性Sprague-Dawley大鼠,体质量180~220 g,随机分为正常对照组(n=54)、生理盐水(NS)对照组(n=60)和PBN组(n=60),每时间段6只。鞘内置管后,采用自行改制的Ò型NYU装置建立大鼠脊髓损伤模型。PBN组鞘内注射PBN 3 mg(15µl),NS对照组注射NS 15µl,术后30min第1次注射,连续注射7 d,每天1次。术前3 d和1 d,以及术后1 d、5 d、10 d、15 d、20 d、25 d、30 d和35 d对NS对照组和PBN组进行Basso-Beattie-Bresnahan(BBB)运动功能评价,并在术后1 h、12 h、24 h、48 h、3 d、7 d、14 d和21 d各组取血清和脊髓组织测定NGF水平。结果术后血清中NGF蛋白含量出现明显改变,而脊髓组织中含量变化不明显。血清NGF/总蛋白比值48 h时达到峰值,NS对照组(0.92%±0.02%)与PBN组(0.77%±0.05%)相比有显著性差异(P= 0.021)。两组大鼠BBB评分在伤后第10天开始升高,PBN组恢复程度明显好于NS对照组(P<0.01)。结论PBN能有效降低脊髓损伤大鼠血清中NGF蛋白的表达,促进神经功能恢复。
脊髓损伤;自由基;N-叔丁基-α-苯基硝酮;神经生长因子;大鼠
[本文著录格式]刘少辉,刘伟,邱少汕,等.N-叔丁基-α-苯基硝酮对大鼠脊髓损伤后神经生长因子表达的影响[J].中国康复理论与实践,2014,20(8):709-712.
脊髓损伤(spinal cord injury)导致躯体运动与感觉神经功能等一系列的损害。其中慢性中枢性神经疼痛(chronic central neuropathic pain,CNP)严重影响患者的生活质量,甚至是自杀的原因之一[1]。脊髓损伤后继发产生的活性氧(reactive oxygen species,ROS)与中枢性痛觉敏化密切相关。活性氧及其诱导产生的致炎因子与神经营养因子如神经生长因子(nerve growth factor,NGF)和脑源性神经营养因子(brain derived neurotrophic factor,BDNF)结合,使谷氨酸受体蛋白的磷酸化上调,谷氨酸释放增多,诱发疼痛信号转导系统的激活,导致脊髓损伤后中枢性疼痛敏化的发生[2-3]。
本研究在应用自由基清除剂N-叔丁基-α-苯基硝酮(α-phenyl-N-tert-butylinitrone,PBN)抑制大鼠脊髓损伤后中枢性痛觉敏化表现的基础上,进一步观察脊髓损伤大鼠脊髓组织和血清中NGF的变化,探讨脊髓损伤后活性氧下游谷氨酸受体激活和相关细胞因子所致中枢性痛觉敏化的机制。
1 材料与方法
1.1 实验动物与分组
选取174只健康成年SPF级雌性Sprague-Dawley大鼠,体质量180~220 g,由南方医科大学动物实验中心提供(合格证号:SCXK粤2006-0015)。将大鼠在实验环境中适应性饲养3 d,随机分为正常对照组(n= 54)和脊髓挫伤组(n=120)[4]。脊髓挫伤组又分为生理盐水(normal saline,NS)对照组(n=60)和PBN组(n=60)。各组手术前后因麻醉死亡的,从每批次组中补充。
本实验经汕头大学医学院实验动物伦理审查委员会批准。实验结束后,采用麻醉处死动物。
1.2 脊髓损伤模型制备
用0.3%戊巴比妥钠30 mg/kg腹腔内注射麻醉,腰背部脱毛,常规消毒,暴露脊髓棘突。固定T8-12棘突,咬开T9-11棘突及T9-10椎板,充分显露硬脊膜约1 cm,避免损伤硬脊膜[5-7]。于所暴露脊髓尾端旁侧,在显微手术镜下,缝线针刺穿硬脊膜孔,见少量脑脊液流出时,将充满相应液体的PE-10微管向颈部方向插入约6 mm。缝扎固定于竖脊肌,穿过皮下,到达颈部,暴露出15 cm,以热熔蜡封闭。根据Basso等[8]介绍的脊髓冲击损伤模型,采用自行改制的Ò型NYU装置[2],根据NYU实验标准,对暴露脊髓大鼠的T10进行撞击(150 kDyne),停留1 s。撞击后,用伤口周围脂肪组织填充骨缺损部位,创口撒上青霉素粉,分层缝合。在撞击造成损伤后15min,鞘内注射PBN 3 mg(15µl)。PBN注射浓度是通过组内对比,找出能最大限度减轻机械性和温度性异常性疼痛的剂量。NS对照组注射NS 15µl。注射后用10µl NS冲洗微管。连续注射7d,每天1次,共8次[9]。
大鼠术后3h内开始饮食。手术后立即使用青霉素1×106U注射,7 h后第2次注射,此后,每天1次,连续3 d以上。人工膀胱按摩排尿每天2次。所有的脊髓挫伤大鼠在4d后达到自主排尿。
1.3 取材
于术前及术后1h、12h、24h、48h、3d、7d、14d和21d每组各取6只。用0.3%戊巴比妥钠30 mg/ kg腹腔内注射麻醉后,打开胸腔暴露心脏与大血管,左心室抽取血液1.5 ml,置Eppendorf管,室温下2 h,4℃冰箱内静置过夜,3000 r/min离心15min,吸取上清液,-80℃分装保存。采血后,在左心室插灌注导管,止血钳固定并封闭采血针孔,剪开右心耳,灌注肝素化生理盐水200 ml(50 U/ml)冲洗,随后灌注4℃4%多聚甲醛250 ml,取损伤节段脊髓组织[10]。
1.4 脊髓组织总蛋白提取
采用组织总蛋白提取试剂盒(ChemiKine, CN.2140)提取组织总蛋白。按照说明要求进行操作。吸取上清液,-80℃分装保存。
1.5 蛋白含量检测
血清和脊髓组织总蛋白的测定使用BCA Protein Assay Kit(Santa Cruz Biotechnology Inc.,sc-202389), 562nm处测平均光密度值(OD)(RAYTO RT-2100C)。血清和脊髓组织中NGF蛋白含量测定使用大鼠NGF ELISA 96孔板试剂盒(ChemiKine,CYT304),492nm测OD值(RAYTO RT-2100C)。按照各自说明书进行操作。
1.6 BBB运动功能评价(The Basso-Beattie-Bresnahan Locomotor Rating Scale)[8]
在手术前3~5 d(体质量200~245 g),各组剩余6只大鼠均进行BBB运动功能评价,以确定行为基线。术后1d、5d、10d、15d、20d、25d、30d和35d时分别进行BBB运动功能评价。
测试时间固定在9:00~12:00,由对分组情况不知情的测试人员在25℃安静的环境中,将大鼠放入60× 50×45 cm的透明有机玻璃箱中,适应20~30min,待其安静后开始检测。
1.7 统计学分析
采用SigmaStat 3.5和SigmaPlot 10.0软件分别进行统计和制图。计量资料用(±s)表示,组间比较采用单因素方差分析,组内比较采用配对t检验。显著性水平α=0.05。
2 结果
2.1 大鼠血清中NGF蛋白含量变化
通过检测大鼠血清NGF浓度和血清总蛋白浓度,计算各时段NGF蛋白所占总蛋白含量的比值(见图1)。结果显示,术后48 h血清NGF/总蛋白比值迅速上升,达最高水平,且NS对照组(0.92%±0.02%)与PBN组(0.77%±0.05%)相比有显著性差异(P=0.021)。术后第3天,NS对照组血清NGF/总蛋白比值迅速回落,而PBN组一直处于相对低水平表达状态,在术后7 d停止给予PBN治疗后略显增加。
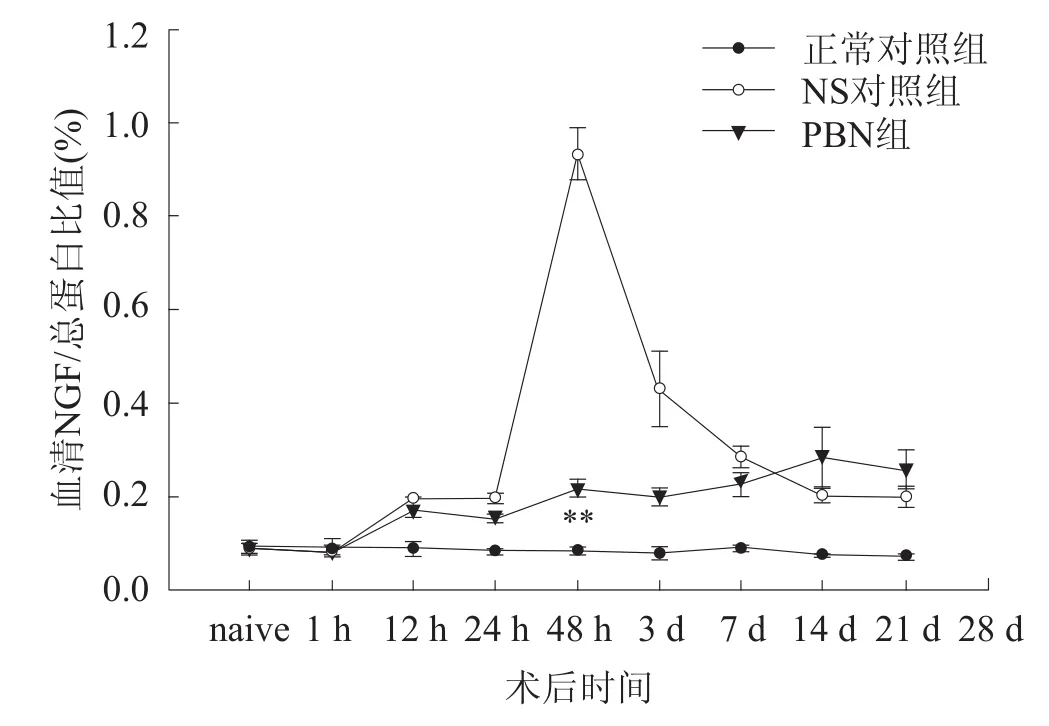
图1 三组大鼠血清NGF蛋白含量变化
2.2 大鼠脊髓组织中NGF蛋白含量变化
脊髓组织中NGF蛋白含量与血清NGF蛋白含量变化总趋势没有明显差异。术后12 h开始,NS对照组各时段NGF蛋白水平出现波动较大,与PBN组各时段相比无显著性差异(见图2)。术后7 d,PBN组NGF蛋白表达呈现逐步升高趋势,但各时段组内比较也无显著性差异。NS对照组各时段相对PBN组NGF表达水平相对略高。

图2 NS对照组和PBN组大鼠脊髓组织中NGF蛋白含量变化
2.3 大鼠运动功能恢复情况
两组大鼠BBB评分在伤后第10天开始各时间点都有非常显著性差异(见图3),PBN组恢复程度明显好于NS对照组。其中第20天时间点,NS对照组BBB评分为(4.010±0.426),PBN组为(8.883±0.423);第35天时间点,NS对照组为(9.250±0.463),PBN组为(16.750±0.524)。各时间点两组评分值之间有非常显著性差异(P<0.01)。
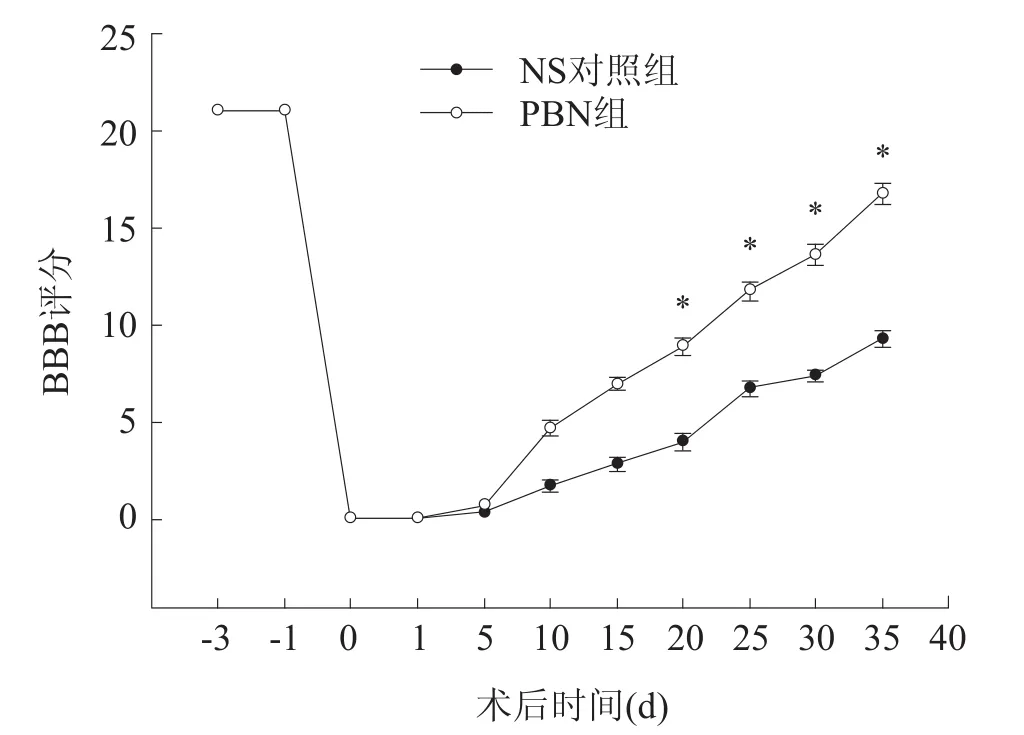
图3 NS对照组和PBN组BBB运动功能评分
3 讨论
中枢性疼痛是脊髓损伤所致的多种慢性疼痛中的一种,包括在没有可见的刺激条件下出现的自发痛与由刺激所诱发的伤害性刺激痛觉过敏以及非伤害性刺激的痛觉超敏诱发痛[11]。表现为多特征、部位广泛的疼痛和/或感觉缺失,并随脊髓损伤时间的延长而增加。
脊髓损伤后中枢性疼痛的产生与中枢神经系统兴奋性过高密切相关[1]。可能与脊髓感觉下行抑制的解除,感觉传入缺失使脊髓及丘脑感觉神经元高度兴奋,以及突触递质释放与受体活性的改变、脊髓的出芽增殖等所有可使背角神经元保持高兴奋性的改变相关。由于脊髓组织膜结构含有丰富脂质,脊髓损伤后组织缺血、缺氧及水肿引起活性氧产生增加,且清除功能下降,致使自由基在局部堆积。作为氧代谢产物的活性氧包括超氧自由基、过氧化氢及其下游产物过氧化物和羟化物等,可以参与脂质过氧化、DNA链断裂、蛋白质修饰变性及影响细胞内信号转导和基因表达,既可引起神经细胞和组织能量代谢系统障碍,又可触发胞内Ca2+内流,使Ca2+超载,且使Ca2+-ATP酶失活,还可直接导致神经变性坏死[12]。
脊髓组织损伤后导致氧自由基堆积的原因主要包括三个方面:第一是由于损伤组织缺氧,细胞能量合成减少,ATP分解增多,AMP浓度增高,黄嘌呤氧化酶被激活,作用于蓄积在细胞内的次黄嘌呤及其他一些底物,使氧分子获得一个电子,而形成过氧化氢、羟自由基及其他离子[13];第二是损伤时中枢神经元释放大量儿茶酚胺类和5-羟色胺等神经递质,这些递质不仅影响微血管自动调节功能,而且在自身氧化过程中,将电子传递给氧分子,产生自由基[14];第三是组织损伤激活磷脂酶A2,作用于花生四烯酸生成前列腺素,在前列腺素G2转化为前列腺素H2的过程中,将电子传递给氧分子,产生超氧阴离子自由基。
由于自由基的特点是未配对的电子,这种未配对的电子容易脱离自由基电子轨道而成为自由电子。大量的自由电子形成损伤局部负电位,形成电位差。当电位差达到阈值电位时,Na+、K+通道开放,膜电位翻转,产生动作电位,引起疼痛[15]。而PBN在组织中能很好地消除堆积的活性氧,从而消除或减低疼痛的产生。
近年来的研究表明,活性氧诱导中枢性痛觉性敏化的产生,可能通过三个方面实现。
第一方面是活性氧通过激活谷氨酸受体来实现。谷氨酸受体广泛存在于中枢和外周神经系统,在脊髓背角神经元上有特异性分布,因其受体激活,可介导外周伤害性信息的传递。
第二方面是通过促进致炎细胞因子(白细胞介素-1α、白细胞介素-1β、白细胞介素-6和肿瘤坏死因子-β)的产生[16]。如白细胞介素-1β可通过上调P物质及NGF的表达,敏化脊髓后角神经元,也可使脊髓神经元处于过度兴奋状态,易化突触,并可通过抑制神经胶质细胞清除突触间谷氨酸,使神经元处于高度兴奋状态[17]。
第三方面就是活性氧通过影响神经营养因子的释放,特别是NGF和BDNF。NGF的增加,可以导致BDNF的上调,后者可调控脊髓背角神经元的功能,激发突触效能的改变[18]。
脊髓损伤后损伤组织细胞内的谷氨酸立即增加,介导细胞内谷氨酸受体途径立即被激活,包括细胞内Ca2+、环氧化酶-2(cyclooxygenase,COX-2)介导的前列腺素途径活性增强,导致活性氧的形成。当二次损伤进一步加深时,由于氧化应激结果促进嗜中性粒细胞介导炎症反应,产生大量致炎细胞因子[19],使外周血液中的中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、淋巴细胞和单核细胞浸润到脊髓实质,浸润的淋巴细胞、巨噬细胞和嗜酸性粒细胞可以分泌NGF,从而导致初级传入神经的敏化[20]。
通常脊髓损伤后1 h为脊髓谷氨酸波动末期,6 h时脊髓中一些促炎细胞因子达到高峰,24 h时中性白细胞产生达到高峰,48 h时血清中NGF水平达到高峰,第14天部分大鼠中开始出现异常性疼痛,第35天时所有大鼠出现异常性疼痛。
本研究结果与上述病理机制基本一致。48 h时血清中NGF蛋白含量迅速增加,达最高水平,且NS对照组与PBN组相比较有显著性差异。术后第3天,NS对照组血清NGF/总蛋白比值迅速回落,而PBN组血清NGF蛋白一直处于相对低水平表达状态,在术后7 d停止给予PBN治疗后略显增加。表明PBN能够有效清除损伤组织产生的活性氧,并降低活性氧引起的二次损伤。同时也表明,脊髓损伤后血清NGF蛋白的增加与活性氧激活密切相关。为进一步阐明脊髓损伤后活性氧下游谷氨酸受体激活和相关细胞因子所致中枢性痛觉敏化的机制以及临床动态观察抗氧化剂的治疗效价提供依据。
[1]Hulsebosch CE,Hains BC,Crown ED,et al.Mechanisms of chronic central neuropathic pain after spinal cord injury[J]. Brain Res Rev,2009,60(1):202-213.
[2]刘晓瑜,徐锡金,霍霞.活性氧在脊髓损伤性中枢疼痛敏化中作用机制的研究进展[J].中国组织化学与细胞化学杂志, 2007,16(2):223-224.
[3]李晓,罗晨禹,杨拯,等.番茄红素抗氧化应激效应对大鼠脊髓损伤后运动功能恢复的影响[J].中国康复理论与实践,2013, 19(2):132-135.
[4]赵伟,孙国志.常用实验动物随机分组方法[J].畜牧兽医科技信息,2009,4:61-62.
[5]徐锡金,林新华,霍霞,等.抑制性消减杂交法筛选植入人发角蛋白与单纯脊髓损伤大鼠基因表达的差异[J].中国临床康复,2006,10(8):85-88.
[6]刘少辉,刘伟,邱少汕.自由基清除剂苯-N-叔丁基硝酮抑制大鼠脊髓损伤后中枢性痛觉敏化的行为学观察[J].中国康复医学杂志,2014,29(3):199-203.
[7]陈虹,李俊岑,党彦丽,等.电刺激对大鼠脊髓损伤后神经生长因子表达的影响[J].中国康复理论与实践,2012,18(1):33-36.
[8]Basso DM,Beattie MS,Bresnahan JC.Graded histological and locomotor outcomes after spinal cord contusion using the NYU weight-drop device versus transection[J].Exp Neurol,1996, 139(2):244-256.
[9]Kim HK,Zhang YP,Gwak YS,et al.Phenyl-N-tert-butylnitrone,a free radical scavenger,reduces mechanical allodynia in chemotherapy-induced neuropathic pain in rats[J].Anesthesiology,2010,112(2):432-439.
[10]Xu X,Wang P,Zou X,et al.The effects of sympathetic outflow on upregulation of vanilloid receptors TRPV(1)in primary afferent neurons evoked by intradermal capsaicin[J].Exp Neurol,2010,222(1):93-107.
[11]Finnerup NB.Pain in patients with spinal cord injury[J]. Pain,2013,154(Suppl):S71-S76.
[12]Salvemini D,Little JW,Doyle T,et al.Roles of reactive oxygen and nitrogen species in pain[J].Free Radic Biol Med, 2011,51(5):951-966.
[13]Christie SD,Comeau B,Myers T,et al.Duration of lipid peroxidation after acute spinal cord injury in rats and the effect of methylprednisolone[J].Neurosurg Focus,2008,25(5):1-7.
[14]Cervantes-Durán C,Rocha-González HI,Granados-Soto V. Peripheral and spinal 5-HT receptors participate in the pronociceptive and antinociceptive effects of fluoxetine in rats[J]. Neuroscience,2013,252:396-409.
[15]O`Rielly DD,Loomis CW.Increased expression of cyclooxygenase and nitric oxide isoforms,and exaggerated sensitivity to prostaglandin E2,in the rat lumbar spinal cord 3 days after L5-L6spinal nerve ligation[J].Anesthesiology,2006,104(2):328-337.
[16]del Rey A,Apkarian AV,Martina M,et al.Chronic neuropathic pain-like behavior and brain-borne IL-1β[J].Ann N Y Acad Sci,2012,1262:101-107.
[17]Ho CM,Su CK.Ketamine attenuates sympathetic activity through mechanisms not mediated by N-methyl-d-aspartate receptors in the isolated spinal cord of neonatal rats[J].Anesth Analg,2006,102(3):806-810.
[18]Kayano T,Kitamura N,Moriya T,et al.Chronic treatment with NGF induces spontaneous fluctuations of intracellular Ca (2+)in icilin-sensitive dorsal root ganglion neurons of the rat[J].J Vet Med Sci,2010,72(12):1531-1538.
[19]Zhang L,Berta T,Xu ZZ,et al.TNF-α contributes to spinal cord synaptic plasticity and inflammatory pain:distinct role of TNF receptor subtypes 1 and 2[J].Pain,2011,152(2):419-427.
[20]Trang T,Beggs S,Salter MW.Brain-derived neurotrophic factor from microglia:a molecular substrate for neuropathic pain[J].Neuron Glia Biol,2011,7(1):99-108.
Effect of α-phenyl-N-tert-butylinitrone on Expression of Nerve Growth Factor in Spinal Cord Injured Rats
LIU Shao-hui,LIU Wei, QIU Shao-shan,XU Xi-jin.Department of Cell Biology and Genetics,Shantou University Medical College,Shantou,Guangdong 515041, China
ObjectiveTo explore the effect of α-phenyl-N-tert-butylinitrone(PBN)on expression of nerve growth factor(NGF)in serum and spinal cord tissue in rats after spinal cord injury(SCI).Methods174 female Sprague-Dawley rats were randomly assigned to following groups:normal control group(n=54),normal saline control group(NS group,n=60,intrathecally injected normal saline 15µl),and PBN group(n=60,intrathecally injected PBN,3 mg,15µl).The model was established with New York University blow device(150 kDyne, 1 s dwell time).PBN was intrathecally injected into the damaged areas 30min after operation,then once a day for 7 days.The Basso-Beattie-Bresnahan(BBB)Locomotor Rating Scale was used to assess the rats 3 days and 1 day before,and 1 day,5 days,10 days,15 days,20 days, 25 days,30 days and 35 days after SCI.NGF in the injured spinal cord tissue and serum was measured 1 h,12 h,24 h,48 h,3 days,7 days, 14 days and 21 days after SCI.ResultsNGF increased in serum but not in spinal cord.The ratio of NGF/total protein in serum rose and peaked 48 h after SCI,and the ratio was higher in NS group(0.92%±0.02%)than in PBN group(0.77%±0.05%)(P=0.021).BBB scores increased from the 9th day,and PBN group improved better than NS group(P<0.01).ConclusionPBN could reduce the expression of NGF in the SCI rats,and promote the recovery of neurol function.
spinal cord injury;free radical;α-phenyl-N-tert-butylinitrone;nerve growth factor;rats
10.3969/j.issn.1006-9771.2014.08.002
R651.2
A
1006-9771(2014)08-0709-04
2013-07-17
2014-01-21)
1.广东省自然科学基金项目(No.10151503102000008);2.汕头大学医学院李嘉诚科研基金资助项目(No.200906)。
汕头大学医学院细胞生物学与遗传学教研室,广东汕头市515041。作者简介:刘少辉(1964-),汉族,男,广东河源市人,助理实验师,主要从事脊髓损伤修复基础研究。通讯作者:徐锡金,男,医学博士,教授。E-mail:xuxj@stu.edu.cn。
时间:2014-06-13 10:05
http://www.cnki.net/kcms/detail/11.3759.R.20140613.1005.002.html
