雷诺嗪缓释片在比格犬体内的药代动力学
2014-05-04孟庆芳陈知航车津晶刘运龙单成启钱小红程远国
孟庆芳,陈知航,车津晶,刘运龙,单成启,钱小红,程远国
1.北京理工大学 生命学院,北京 100081;2.军事医学科学院 微生物流行病研究所,北京 100071;
3.军事医学科学院 放射医学研究所,国家蛋白质组学重点实验室,北京蛋白质组研究中心,北京 102206
心绞痛是较常见的心血管疾病,随着人们生活水平的提高和生活方式的变化,其发病率呈连续上升趋势。公认的抗心绞痛药的基本模式为:提高心肌氧的供需平衡,增加冠脉流量或降低心肌机能或两者兼有。目前,广泛应用于缺血性心脏病的药物包括硝酸酯类、β-肾上腺素能受体阻滞剂、钙离子通道拮抗剂等,这些药物均是通过减慢心率、降低血压或削弱心脏泵血功能,从而使心脏做功减少,以缓解心绞痛症状,但同时对已经衰竭的心脏功能也有产生进一步损害的可能。因此,研究人员一直致力于寻找其他更有效且副作用少的疗法来改善心肌缺血,代谢途径治疗这一理论上可行的新手段便应运而生。此种治疗方法通过优化心肌能量供应的代谢,抑制脂肪酸的β-氧化,进而活化丙酮酸脱氢酶,增加葡萄糖氧化,由于在产生等量的ATP的前提下,葡萄糖氧化比脂肪酸氧化节约10%~15%的耗氧量,使得心肌在缺血缺氧时能提高氧的利用率,使心脏做功更多[1-3]。通过代谢途径治疗从而改变心脏代谢方式的代表药物是美国CV Therapeutics公司最新研制的部分脂肪酸氧化抑制剂雷诺嗪(化学分子式为 C24H33N3O4,分子量427.54,化学结构见图1),已获得美国FDA批准上市。为减少服药次数,避免血药浓度的波动过大,减低毒副作用,北京某医药公司开发了雷诺嗪缓释片。我们受该公司委托,对其开发的雷诺嗪缓释片进行了临床前药物代谢动力学研究,并与参照制剂雷诺嗪片比较,为其是否具有缓释特征提供依据。雷诺嗪的液相色谱与单级质谱联用检测方法此前有文献报道[4],但其灵敏度无法满足本实验要求,故本实验拟建立一种灵敏度高、准确可靠的液相色谱与串联质谱联用的检测方法来对比格犬体内药物浓度进行定量分析,并对雷诺嗪缓释片和雷诺嗪片的药代动力学特征进行比较分析,为了解雷诺嗪缓释片在比格犬体内的药代动力学过程提供依据。
1 材料和方法
1.1 研究对象
健康比格犬12只[北京协尔鑫生物资源研究所提供,体重 3.5~4.6 kg,许可证号 SCXK(京)2005-0005],饲养于动物房,定时排风,光照良好,常温,自由饮水,每日进食2次,实验前禁食12 h。
1.2 材料
雷诺嗪标准品(批号070223)、缓释片(批号071210)、参比片均由北京某医药公司提供,规格为500 mg/片,阴凉干燥处保存。
内标物盐酸维拉帕米(化学分子式为C27H38N2O4·HCl,分子量491.07,化学结构见图 2)对照品购自中国药品生物制品检定所(批号100223-200102),4℃、遮光、密闭保存。
试验所用甲醇、乙腈购自Fisher Scientific公司,色谱纯;甲酸购自Tedia公司,纯度为96%;超纯水采用军事医学科学院自制去离子水,经0.2 μm微孔滤膜过滤。
Agilent1100(Wilmington公司)液相系统包括真空脱气机、四元泵、自动进样器和柱温箱;API4000三重四极串联质谱(Applied Biosystems公司);TDL5M台式大容量冷冻离心机(Sigma Laboratory Centrifuges);BF-2000M型氮气吹干仪(北京八方世纪公司)。
1.3 服药方案与采血时间
采用随机对照试验设计。将12只比格犬随机分为A、B组,每组6只。
受试动物禁食过夜,A组于试验当日8∶00空腹口服给予受试制剂雷诺嗪缓释片(500 mg/片)1片。给药前抽取空白血样2 mL,给药后15、30、45 min和1、2、3、4、6、8、12、24、48 h由后肢外侧皮下小隐静脉取血各约2 mL,肝素抗凝,立即离心,分离血浆,置-20℃保存备测。
B组于试验当日8∶00空腹口服给予参比制剂雷诺嗪片(500 mg/片)1片。给药前抽取空白血样2 mL,给药后10、20、30、45 min和1、1.5、2、3、4、6、8、12 h由后肢外侧皮下小隐静脉取血各约2 mL,肝素抗凝,立即离心,分离血浆,置-20℃保存备测。

图1 雷诺嗪的化学结构式
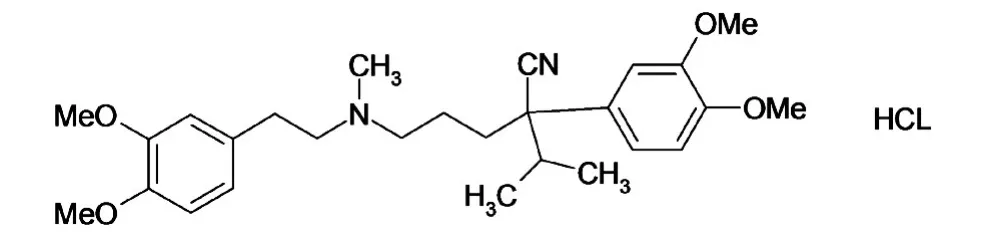
图2 盐酸维拉帕米的化学结构式
1.4 色谱条件
色谱柱为Agilent Zorbax Eclipse Plus-C18柱(50 mm×2.1 mm,粒径5 mm),流动相A为0.1%甲酸水,流动相B为0.1%甲酸乙腈,流速0.2 mL/min。采用梯度洗脱模式,洗脱程序详见表1。柱温为室温,进样量20 μL。
1.5 质谱条件
以盐酸维拉帕米为内标,按内标法定量。以高纯氮气作为碰撞气、源内气体和气帘气,ESI源正离子模式下MRM扫描方式。测试前质谱通过灵敏度和质量准确度校正实验。离子源参数:碰撞气(colli⁃sion gas)压力 6 psi,气帘气(curtain gas)压力 10 psi,源内气体 1(gas1)压力45 psi,源内气体2(gas2)压力50 psi,离子喷雾电压(ion spray voltage)5000 V,温度500℃。
用于定量分析的离子对分别为雷诺嗪428.5/279.2(其中279.2是雷诺嗪的子离子)(图3A)和盐酸维拉帕米456.5/165.2(其中165.2是维拉帕米的子离子)(图3B)。化合物参数见表2。
1.6 血浆样品处理
取血浆50 μL,加入内标工作液(500 ng/mL维拉帕米水溶液)50 μL,混匀,加入1 mL乙醚旋涡混合4 min,16 000 r/min离心5 min,吸取上清液,残渣加入1 mL乙醚重复提取一次,上清与第一次上清合并后,通入高纯氮气挥干,残渣用200 μL溶解液(5%乙腈∶水)溶解,16 000 r/min离心5 min,进LCMS/MS,进样量为20 μL。由药物峰面积与内标的峰面积比在各自的标准曲线上求得雷诺嗪浓度。
1.7 标准工作曲线和质控样本的制备
在每个离心管中分别加入50 μL空白比格犬血浆,加入雷诺嗪标准系列(浓度分别为 4.88、9.77、19.5、39.1、78.1、156、312、625、1250、2500、5000 ng/mL)溶液50 μL和500 ng/mL内标维拉帕米水溶液,制成标准血浆样本。

表1 色谱洗脱程序
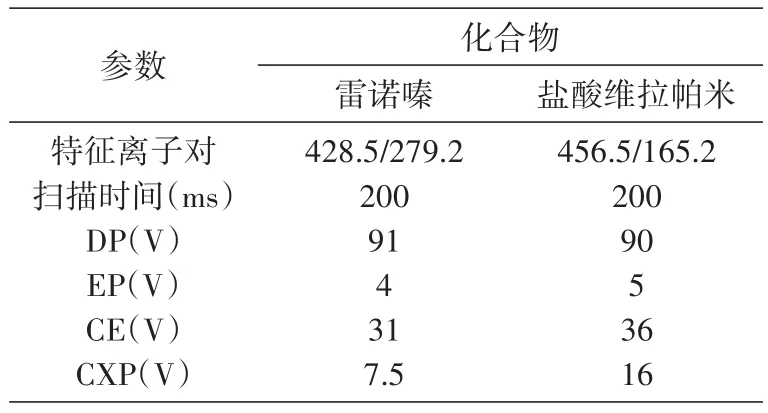
表2 用于定量分析的化合物参数设置
QC样品同法操作,分低、中、高三个浓度,雷诺嗪终浓度分别为9.77、625、5000 ng/mL。
内标溶液临用时用溶解液5%乙腈∶水稀释至500 ng/mL。
1.8 方法学验证
1.8.1 专属性 取正常比格犬空白血浆,按1.6项下方法操作,获得空白血浆样品的色谱图;将1号受试比格犬口服1片雷诺嗪缓释片后1.5 h的血浆样品依同法操作,获得相应的色谱图。将空白血浆色谱图和给药后犬血浆色谱图相比较,得知空白血浆对样品检测有无干扰。
1.8.2 线性关系及检测限 取标准血浆样本,按1.6项下方法操作,记录待测物及内标的峰面积。以雷诺嗪和内标维拉帕米面积比(Y)与雷诺嗪浓度(C:ng/mL)进行线性回归(内标浓度为500 ng/mL),得回归方程和线性关系。
取6份空白血浆(各50 μL),分别加入4.88 ng/mL雷诺嗪标准溶液50 μL,制成检测线标准血浆样本6份,按照1.6项下方法操作,根据随行标准曲线计算准确度、精密度,判断是否符合检测下限要求。
1.8.3 提取回收率与基质效应 将含雷诺嗪质量浓度分别为9.77、625和5000 ng/mL各5份的200 μL标准品溶液(5%乙腈∶水)进样,分析记录雷诺嗪和内标峰面积。此时雷诺嗪面积记为“A”。
另取比格犬空白血浆100 μL,加入1 mL乙醚,按照前述2次液液萃取方法得到空白血浆提取物,将此空白血浆提取物加入含雷诺嗪浓度分别为9.77、625和5000 ng/mL各5份的200 μL标准品溶液(5%乙腈∶水)溶解,离心进样,分析并记录雷诺嗪和内标峰面积。此时雷诺嗪面积记为“B”。
按1.7项标准工作曲线和质控样本制备方法,制备含雷诺嗪浓度分别为9.77、625和5000 ng/mL的血浆质控样品各5份,按1.6项方法操作,分别记录雷诺嗪和内标峰面积。此时雷诺嗪面积记为“C”。
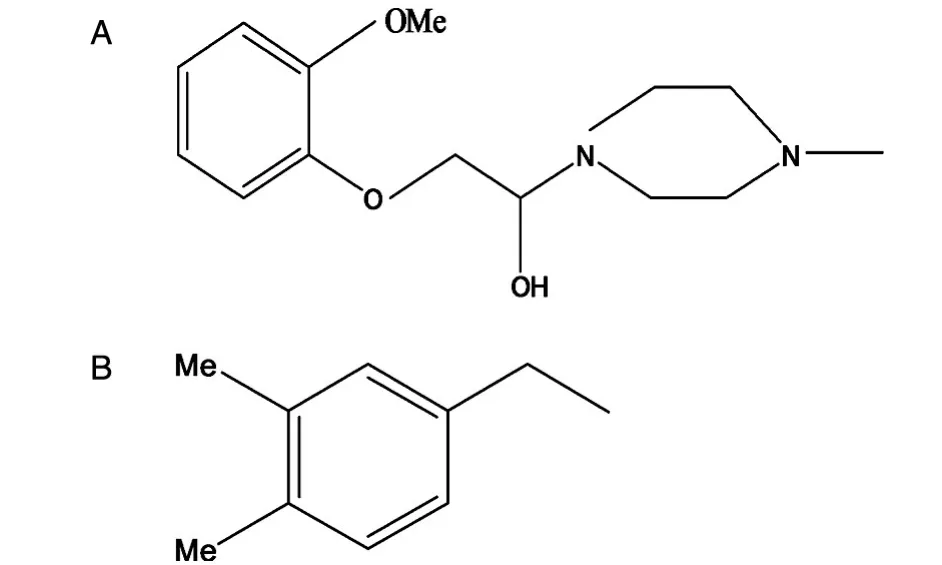
图3 雷诺嗪子离子279.2(A)和维拉帕米子离子165.2(B)的化学结构式
以雷诺嗪血浆样品峰面积(C)与外加空白血浆提取物的雷诺嗪标准品峰面积(B)的比值计算提取回收率;以外加空白血浆提取物的雷诺嗪标准品峰面积(B)与雷诺嗪标准品峰面积(A)的比值计算基质效应。
1.8.4 准确度及精密度 按1.7项下标准曲线和质控样本的制备方法制备含雷诺嗪低、中、高三个浓度的QC样品,根据当日工作曲线,分别计算QC样品的测得浓度,与理论浓度对照,求得测定方法的准确度与精密度,在同一天内测定5次,按回归方程计算浓度,计算日内精密度变异系数。
1.8.5 血浆样品稳定性考察 按1.7项下标准曲线及质控样本制备方法,分别配制空白比格犬血浆中的低、中、高三个浓度的QC样品,每个浓度各5份,在-20℃冰箱中冷冻后取出,室温融化,重复操作3次,按1.6项操作,计算雷诺嗪的浓度,考察样品在3次冻融过程中是否稳定。
按1.7项下标准曲线及质控样本制备方法,分别配制大鼠血浆中的低、中、高三个浓度的QC样品,每个浓度各5份,在-20℃冰箱中放置,分别在0、30 d取样,按1.6项操作,计算雷诺嗪的浓度,考察样品在30 d冻存过程中是否稳定。
1.9 数据处理及统计
所有原始数据在Analyst 1.4.2软件中转换为血药浓度-时间数据,并按照随行标准曲线得到回归方程。在Excel 7.0软件中按梯形法则计算AUC,非房室模型统计矩法估算其他药动学参数,达峰时间tmax与峰浓度Cmax用实测值。用Origin6.0软件作图。
2 结果
2.1 方法学确证
2.1.1 专属性 空白血浆样品和1号受试比格犬口服雷诺嗪缓释片后1.5 h的血浆样品的色谱图见图4。雷诺嗪的保留时间约为5.5 min,内标维拉帕米的保留时间约为5.8 min。内源性物质基本不干扰测定,方法专属性强。
2.1.2 线性关系及检测限 以雷诺嗪和内标维拉帕米的面积比(Y)与雷诺嗪浓度(C:ng/mL)进行线性回归(内标浓度为500 ng/mL),得回归方程血浆中雷诺嗪线性范围为4.88~5000 ng/mL,该浓度范围内与峰面积比线性良好。

按照随行标准曲线计算血药浓度,6份理论浓度为4.88 ng/mL的样本中雷诺嗪的实测浓度分别为5.06、5.13、4.75、4.92、4.67、4.59 ng/mL(表 3),准确度、精密度均符合80%~120%规定范围,所以血浆中雷诺嗪最低定量浓度为4.88 ng/mL。
2.1.3 提取回收率与基质效应 提取回收率和基质效应考察结果见表4。提取回收率约为60%,基质效应在80%~120%范围内,显示空白血浆提取物即基质对标准品的色谱相应信号没有明显的抑制或增强作用,基本可以不考虑基质效应。
2.1.4 准确度及精密度 准确度和精密度考察结果见表5。日内精密度变异系数低于11.37%,准确度为101.0%~104.9%。对质控样品每个浓度进行5样本分析,连续测定3 d,日间精密度变异系数低于9.13%,准确度为97.7%~102.7%。

图4 空白血浆(A)和1号受试比格犬口服雷诺嗪缓释片后1.5 h的血浆样品(B)色谱图蓝色为雷诺嗪,红色为内标维拉帕米
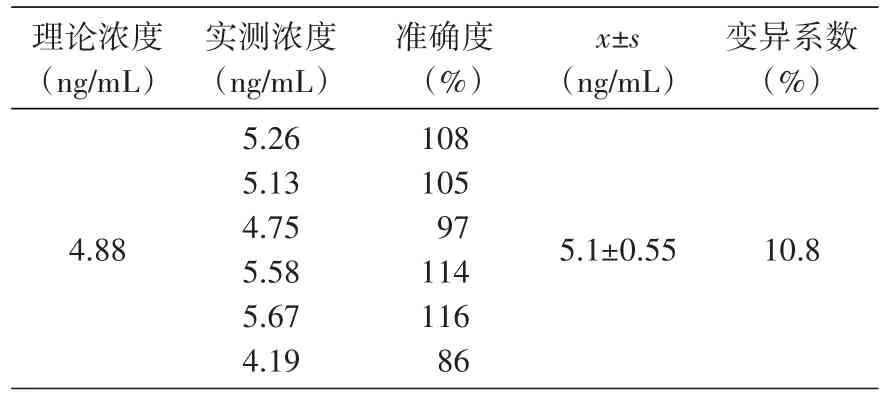
表3 定量下限考察结果

表4 雷诺嗪血浆提取回收率
2.1.5 血浆样品稳定性考察 血浆样品稳定性考察结果见表6。雷诺嗪血浆样本经过3次冻融过程和在-20℃条件下放置30 d内稳定。
2.2 比格犬体内雷诺嗪缓释制剂、参比制剂的药代动力学
给药后受试组、参照组比格犬平均血药浓度-时间变化比较见图5。表7为单次给药后参照组和受试组个体比格犬的主要药代动力学参数。按成组设计实验Student t检验等方差双样本(双尾分布)检验方法对受试组和参照组药代参数进行统计学分析,计算P值,受试组与参比组相比,曲线下面积AUC0~∞、清除率Cl、表观分布容积Vd没有统计学差异,而达峰时间Tmax、峰浓度Cmax、平均驻留时间MRT、半衰期t1/2、消除速率常数Kel有明显差异。表明雷诺嗪缓释片与参照片相比,达峰时间、半衰期、平均驻留时间明显延长,峰浓度和消除速度常数明显降低,符合缓释片的基本药代动力学特点。
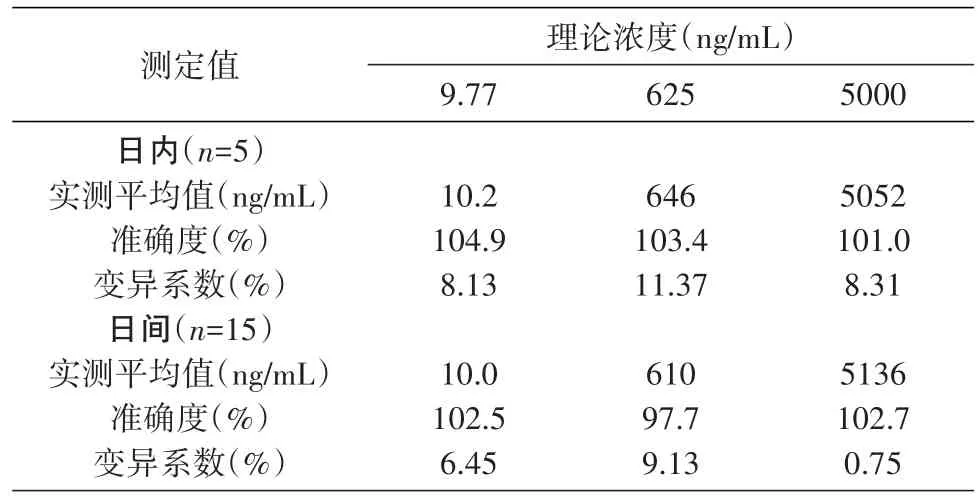
表5 雷诺嗪质控样本日内、日间精密度准确度考察结果

表7 单次给药参照组和受试组主要药代动力学参数及统计分析

图5 雷诺嗪参照组和受试组平均血药浓度-时间变化比较
3 讨论
我们建立了比格犬体内的雷诺嗪血药浓度LCMS/MS检测方法,此法简单易行、灵敏度比报道的单级质谱方法[4]高7倍,重现线性、稳定性、回收率等均满足要求,可以用来检测给药后比格犬药代动力学血浆样本。
将此方法用于受试组与参照组比格犬的药代动力学研究,2组犬血药浓度-时间变化趋势截然不同。参照组血药浓度峰值远高于受试组,有明显的突释效应;受试组血药浓度则缓慢上升和下降,峰值较低。雷诺嗪缓释片与参照制剂相比,达峰时间、半衰期、平均驻留时间明显延长,峰浓度和消除速度常数明显降低,符合缓释片的基本药代动力学特点。在后续工作中,将进行比格犬连续7 d给药的多次给药药代动力学研究,以比较多次给药后,雷诺嗪缓释片与雷诺嗪片的药代动力学特征的不同,进一步证明在比格犬体内雷诺嗪缓释片的缓控释特性。
[1] Herron W J,Eadie J,Penman A D.Estimation of ranolazine and eleven phase I metabolites in human plasma by liquid chromatography-atmospheric pressure chemical ionisation mass spectrometry with selected ion monitoring[J].J Chromatogr A,1995,712(1):55-60.
[2] Pepine C J,Wolff A A.A controlled trial with a novel antiischemic agent,ranolazine,in chromic stable angina pectoris that responsive to conventional antianginal agents.Ranolazine study group[J].Am J Cardiol,1999,84(1):46-50.
[3] Bagger J P,Botker H E,Thomassen A,et al.Effects of rano⁃lazine on ischemic threshold coronary sinus blood flow,and myocardial metabolism in coronary artery disease[J].Cardio⁃vasc Drugs Ther,1997,11(3):479-484.
[4] 谢林,梁艳,刘晓东,等.犬血浆中雷诺嗪LC-MS测定及药代动力学[J].中国药科大学学报,2004,35(2):156-159.
