调节性T细胞在健康人群中的表达
2014-05-04周文超李薇熊小敏
周文超,李薇,熊小敏
1.广州军区 广州总医院检验科,广州军区 检验中心,广东 广州 510010;2.广州中医药大学,广东 广州 510405
Sakaguchi等于1995年首次提出CD4+CD25+调节性T细胞(Treg细胞)是一种具有免疫抑制/调节作用的细胞群;2003年,Treg细胞被正式确认为独立的T细胞亚群。Treg细胞与感染、肿瘤、移植、自身免疫性疾病等多种疾病密切相关[1-2]。
CD4+CD25+Treg细胞特异性表达Foxp3(fork⁃head/winged helix transcription factor 3,叉头状/翼状螺旋转录因子3),Foxp3与Treg细胞的发育和功能密切相关,同时也是维持其免疫抑制功能的必要条件[3]。目前公认Foxp3是CD4+CD25+Treg细胞特有的细胞标志。CD4+CD25+Treg细胞高表达Foxp3,而只有很少的其他细胞表达Foxp3[4]。由于Foxp3位于细胞内,检测时需要打孔破膜,影响细胞活性,目前的技术尚不能直接分离活的Foxp3阳性细胞。2006年Liu等[5]发现,CD127(IL-7受体)与Foxp3的表达有相关性。Seddiki等[6]发现,CD4+T细胞活化后高表达CD127,而Treg细胞则低表达CD127(CD4+CD25highCD127dim),因此CD127可以帮助识别Treg细胞与活化的T细胞。王会平等[7]报道,CD4+CD25+CD127low三标记法是检测Treg细胞的最理想指标。目前少见有关CD4+CD25+CD127lowTreg细胞的正常人参考范围的报道,迄今有关CD4+CD25+CD127lowTreg细胞的报道大部分是对照组与不同疾病组进行比较,且所有有关对照组CD4+CD25+CD127lowTreg细胞的表达范围均不相同。为此,我们采用流式细胞术,对2011年12月~2012年8月来我院健康体检的人群外周血单个核细胞中CD4+CD25+CD127lowTreg细胞的表达水平进行了调查分析,以此建立本实验室健康成年人外周血中的参考范围,方便我院临床医生对移植、肿瘤等相关疾病的研究,期望能够为临床治疗、判断病程预后提供有价值的数据。
1 材料与方法
1.1 观察对象
收集2011年12月~2012年8月广州军区广州总医院体检中心健康成年人外周血标本180例,这些观察对象在本院体检期间血常规、尿常规、生化、肝功能、肾功能、肿瘤标志物等各项指标均在正常范围内;心电图、胸部X线检查、腹部B超影像分析均未见明显异常;无明显的心、脑血管疾患,故视为健康人群。其中男99例、女81例,年龄17~84岁,平均43.64岁。根据性别分为男女2组;根据不同年龄段分为17~29岁(n=51)、30~39岁(n=34)、40~49岁(n=24)、50~59岁(n=36)、≥60岁(n=35)共5个组,依次编为1、2、3、4、5组。
1.2 其他材料
CD4-FITC、CD25-PE、鼠抗人 CD127-PerCPCy5.5、鼠IgG1-PE、鼠IgG1-PerCP-Cy5.5、溶血剂、鞘液、流式细胞仪BD FACS Calibur、细胞分析管(BD Biosciences公司);TL-5.0w台式离心机(上海市离心机械研究所有限公司)。
1.3 方法
清晨空腹采取EDTA-K3抗凝静脉血2 mL,每份标本设测定、同型对照2管,于测定管中加入CD4-FITC、CD25-PE 各 10 μL、鼠抗人 CD127-PerCPCy5.5 2 μL;同 型 对 照 管 中 加 入 CD4-FITC、鼠IgG1-PE 各 10 μL,鼠 IgG1-PerCP-Cy5.5 2 μL;分别于2管中各加入100 μL抗凝血剂后振荡混匀,室温避光标记15 min;加入1 mL溶血剂,振荡混匀,室温避光溶血10 min;2000 r/min离心2 min,弃上清液,加鞘液1 mL,2000 r/min离心2 min,弃上清液,加鞘液500 μL,充分混匀后上机分析。用Cell⁃quest软件,以同型对照管CD4/SSC散点图中CD4+FITC细胞群设门,确定鼠IgG1-PE/鼠IgG1-PerCPCy5.5散点图中的阴性区域,分析测定管Cellquest图中右下象限CD25+CD127low细胞群阳性百分率。
1.4 统计学处理
采用SPSS 13.0软件进行统计分析,计量资料以x±s表示,组间比较采用t检验或单因素方差分析。
2 结果
2.1 不同性别健康成年人外周血中CD4+CD25+CD127lowTreg细胞的百分率
用Levene检验方差齐性,结果显示方差齐(F=0.321,P=0.572),采用独立样本的 t检验,不同性别健康成年人外周血中CD4+CD25+CD127lowTreg细胞百分率男、女分别为(4.06±1.56)%和(3.59±1.48)%,无显著性差异(P>0.05)。
2.2 不同年龄段各组间外周血中CD4+CD25+CD127lowTreg细胞的百分率
应用单向方差分析,各组间进行两两比较,结果显示1、2、3组间无显著性差异(P>0.05),4、5组间无显著性差异(P>0.05);1、2、3组分别与4、5组间具有显著性差异(P<0.05)。参见表1。
2.3 健康成年人外周血中CD4+CD25+CD127lowTreg细胞百分率参考范围的确定
统计结果显示,不同性别健康成年人CD4+CD25+CD127lowTreg细胞的百分率无显著性差异;17~49岁不同年龄段3组间无显著差异,≥50岁2组间亦无显著差异,而这2个年龄段之间则存在显著性差异。根据统计分析结果,CD4+CD25+CD127lowTreg细胞参考范围在实际使用中可忽略性别,但须依据17~49岁、≥50岁2个年龄段设不同的截断值,具体范围确定为≤49岁为(3.30±1.45)%,≥50岁为(4.69±1.27)%。参见表2、图1。
3 讨论
CD4+CD25+CD127lowTreg细胞与肿瘤、移植疾病、自身免疫性疾病等密切相关,在不同的疾病中有升高或降低的趋势。以往有关Treg细胞的研究中,多以CD4+CD25+细胞群中的Foxp3为主。Foxp3被认为是特异性表达于CD4+CD25+Treg细胞的关键标记分子,在一定程度上可反映CD4+CD25+Treg细胞的水平和功能活性,可作为证实CD4+CD25+Treg细胞的表面标志[8-9]。但由于Foxp3是在细胞内表达,检测分析时须破膜打孔,检测过程长、复杂,且易影响细胞活性及丢失细胞数目,从而影响检测结果的准确性[10]。2006年Liu等发现CD127(IL-7受体)与Foxp3的表达呈负相关。与此同时,Seddiki等发现CD127可以帮助识别CD4+CD25+Treg细胞与活化的T细胞,CD4+T细胞活化后高表达CD127(CD4+CD25+CD127high),而真正的Treg细胞仅表达较低的CD127(CD4+CD25+CD127low)。因此,在 CD4+CD25+基础上联合CD127抗原,可以更好地识别人CD4+CD25+Treg细胞[7]。迄今在有关CD4+CD25+CD127lowTreg细胞的研究中,少见该指标参考范围的报道,多建立在疾病观察组与对照组比较上[11-13]。国内郭新红等[11]报道健康对照组为(4.02±1.66)%,严波等[12]报道健康对照组为(6.027±0.854)%,结荆线等[13]报道健康对照组为(3.21±0.96)%,王盈等[14]报道健康人为(6.55±0.11)%,Zhang 等[15]报道健康对照组为(5.44±1.44)%,Guo 等[16]报道 健 康对照组(2.5±0.9)%。综上,有关CD4+CD25+CD127lowTreg细胞指标的报道不尽一致。本研究结果显示,CD4+CD25+CD127lowTreg细胞指标男性略高于女性,但经过统计学分析,性别之间无显著差异,表明该指标在应用于临床时可以忽略性别。本研究还显示,17~49岁间3个年龄段无显著性差异,≥50岁的2个年龄段无显著差异,而17~49岁与≥50岁2个年龄段间则存在显著差异,表明临床应用该指标时应根据17~49岁及≥50岁设2个不同的截断值为参考范围。

表1 不同年龄段健康成年人外周血中CD4+CD25+CD127lowTreg细胞的百分率(x±s)

表2 健康成年人外周血中CD4+CD25+CD127low Treg细胞的百分率(x±s)
本实验数据与有关报道存在差异[11~16],可能与地域、试剂、标本的选择有关。本研究建立的CD4+CD25+CD127lowTreg细胞健康成年人表达范围具前瞻性与创新意义,可用于肿瘤、器官移植、慢性特发性血小板减少性紫癜等多种疾病的临床治疗与疗效观察,并对疾病的病程转归具有一定的探讨价值。由于年龄大于50岁的人群或多或少存在某些慢性疾患,真正意义上的健康人标本来源较少,存在一定的局限性,有待于后续研究中加以补充完善。
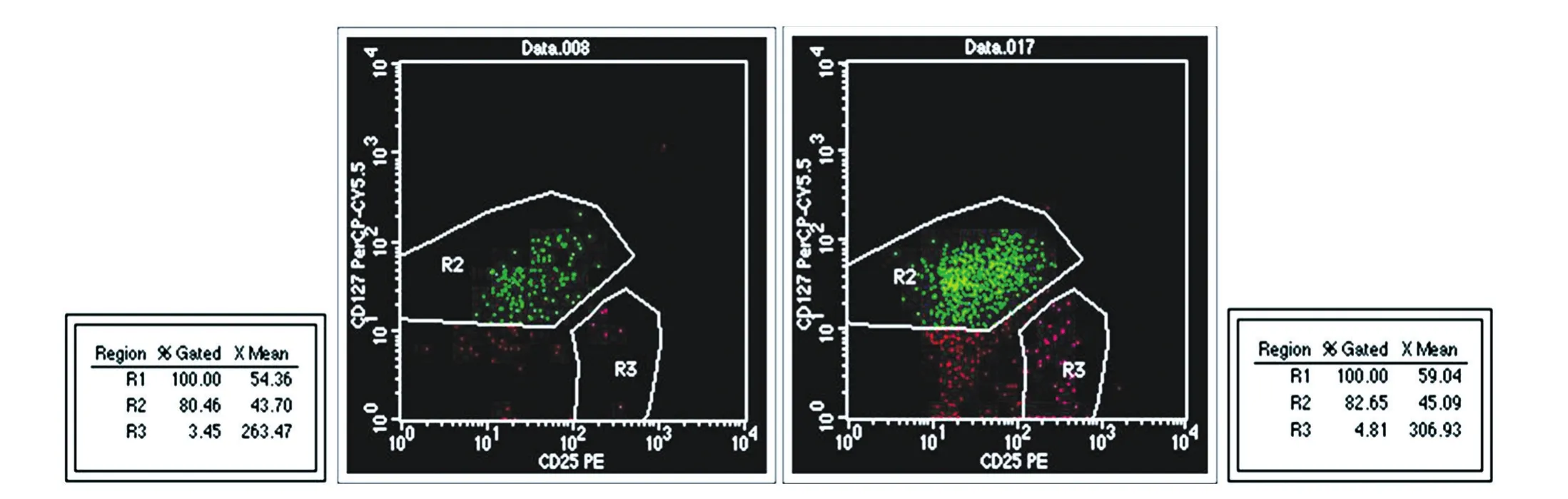
图1 流式细胞术检测≤49岁与≥50岁健康成年人外周血中CD4+CD25+CD127lowTreg细胞的表达范围
[1] 邓茜,肖影群.CD4+CD25+调节性T细胞及其在肝病的研究进展[J].重庆医学,2012,41(10):1004-1006.
[2] 何凡,陈知水,陈孝平,等.术前调节性T细胞水平与肝癌肝移植术后肿瘤复发的关系[J].外科理论与实践,2008,13(4):341-343.
[3] Shevach E M.Mechanisms of foxp3+T regulatory cell-mediat⁃ed suppression[J].Immunity,2009,30:636-645.
[4] Pacholczyk R,Kraj P,Ignatowicz L.Peptide specificity of thy⁃mic selection of CD4+CD25+T cells[J].Immunology,2002,168(2):613-620.
[5] Liu W,Putnam A L,Zhou X Y,et al.CD127 expression in⁃versely correlates with FoxP3 and suppressive function of hu⁃man CD4+T reg cells[J].J Exp Med,2006,203(7):1701-1711.
[6] Seddiki N,Santner-Nanan B,Martinson J,et al.Expression of interleukin(IL)-2 and IL-7 receptors discriminates between human regulatory and activated T cell[J].J Exp Med,2006,203:1693-1700.
[7] 王会平,翟志敏,张爱梅,等.CD4+CD25+CD127low识别人外周血CD4+CD25+调节性T细胞的优势[J].中国免疫学杂志,2008,24(12):1059-1062.
[8] Yagi H,Nomura T,Nakamura K,et al.Crucial role of Foxp3 in the development and function of human CD4+CD25+regula⁃tory T cells[J].Int Immunol,2004,16(11):1643-1656.
[9] Hori S,Nomura T,Sakaguchi S.Control of regulatory T cell developmentby the transcription factorFoxP3[J].Science,2003,299(5609):1057-1061.
[10]Morgan M E,van Bilsen J H,Bakker A M,et al.Expression of FOXP3 mRNA is not confined to CD4+CD25+T regulatory cells in humans[J].Hum Immunol,2005,66(1):13-20.
[11]郭新红,范佳鑫,阿依姆妮萨,等.CD4+CD25+CD127low调节性T细胞及相关细胞因子与慢性特发性血小板减少性紫癜的研究[J].中国免疫学杂志,2011,27(1):73-75.
[12]严波,燕善军.恶性肿瘤患者腹水及外周血中CD4+CD25+CD127low调节性T细胞表达及其意义[J].实用医学杂志,2010,26(9):1570-1571.
[13]结荆线,乔丽娟,郭爱芝,等.卵巢癌患者外周血CD4+CD25hiCD127lo调节性T细胞格局变化及临床意义[J].中国免疫学杂志,2012,28(1):49-53.
[14]王盈,周磊明,宫菊丽,等.中国健康人外周血中具有CD4+CD25nt/hCD127low特征的调节性T细胞频率[J].细胞与分子免疫学杂志,2007,23(9):816-819.
[15]Zhang Shenghui,Han Yixiang,Wu Jianbo,et al.Elevated fre⁃quenciesCD4+CD25+CD127lowregulatory T cells is associated to poor prognosis in patients with acute myeloid leukemi[J].Int J Cancer,2011,129(6):1373-1381.
[16]Guo Y,Wu C Z,Liao Y,et al.The Expression and signifi⁃cance of CD4+CD25+CD127low/-regulatory T cells and Foxp3 in patients with portal hypertension and hypersplenis[J].Hepato⁃gastroenterology,2013,60(123):581-584.
