含p53保守结合位点的microRNA表达载体的构建及应用
2014-05-04秦性良苏雪婷丁红梅黄皑雪李慧侯绿滨葛兴枫李洁邵宁生
秦性良,苏雪婷,丁红梅,黄皑雪,李慧,侯绿滨,葛兴枫,李洁,邵宁生
1.广西医科大学,广西 南宁 530021;2.军事医学科学院 基础医学研究所,北京 100850
经过数十年深入研究,人们发现p53在多种肿瘤应激相关分子网络中处于核心地位[1-2]。p53作为一种能够与DNA结合的特异转录因子,在DNA损伤、药物作用、原癌基因激活等多种应激信号下被活化,进而调控下游靶基因,参与DNA损伤修复、细胞周期调节等一系列重要生命过程[3]。p53特异性DNA结合位点通常由2条长度约10 bp的序列组成,序列模式为5'-RRRCWWGYYY(N)RRRCWW⁃GYYY-3'(R=A或G,W=A或T,Y=C或T),2个拷贝间由0~13个随机碱基隔开(N=0~13 nt)。
microRNA(miRNA)是一类长约19~25 nt的单链非编码小RNA,在进化过程中高度保守。这类内源性非编码小RNA分子主要通过与靶基因mRNA的3'UTR结合,导致靶mRNA降解或抑制其翻译,从而调控基因表达[4-6]。越来越多的证据表明,miRNA调控靶基因通路与p53信号通路相互交叉并相互影响。2006年,Voorhoeve等通过遗传学手段筛选人miRNA,首次发现miRNA参与p53信号通路[7]。随后Xi等分析HCT-116细胞系表达谱发现,表达水平存在显著差异的326条miRNA中,46%的miRNA在其上游5 kb预测启动子区内含有p53结合位点,这一发现表明p53调控miRNA表达的可能性[8]。随后,有5个相互独立的研究小组相继报道了miR-34家族与p53的相互作用,揭开了miRNA参与p53信号通路、p53调控miRNA生物合成的相互作用关系。随后越来越多能够参与p53信号通路的miRNA被发现,如miR-34家族(miR-34a,miR-34b,miR-34c)、miR-29家族(miR-29a,miR-29b,miR-29c)、miR-125b、miR-145、miR-192、miR-215、miR-194 和miR-21l等[9-10]。
基于上述研究基础,我们利用p53的转录激活活性,构建含有p53保守结合位点的高效miRNA表达载体,希望实现在表达野生型p53的细胞中对靶标进行有效调控。本研究选用3条人源miRNA,即miR-138、miR-34a和miR-21及其各自对应的已有文献报道的靶基因Cyclin D3、CDK2和PTEN[11-13]来证实这一方法。
1 材料与方法
1.1 材料
人非小细胞肺癌H1299细胞和人宫颈癌上皮细胞HeLa由本实验室保存;miRNA表达载体pCMV-miR购自OriGENE公司;p53真核表达载体购自义翘神州公司;siRNA由上海吉玛公司合成。
DMEM和1640培养基购自Gibco公司;胎牛血清购自Hyclone公司;TRIzol和LipofectAMINE2000购自Invitrogen公司;限制性内切酶AscⅠ、BamHⅠ、XhoⅠ、EcoRⅤ,M-MLV反转录系统,SYBR GreenⅠ荧光定量PCR系统,质粒提取试剂盒购自Promega公司;pfu高保真酶、dNTP及相关缓冲液购自天根公司;其他试剂均为进口分装或国产分析纯产品;所有引物及其他DNA序列均由上海生工生物工程有限公司合成。
1.2 载体构建
分别合成3条具有p53保守结合位点的DNA序列,用BamHⅠ和AscⅠ双酶切pCMV-miR载体和p53结合位点序列,用T4DNA连接酶连接,转化大肠杆菌感受态细胞DH5α,挑取单克隆测序鉴定(由中美泰和生物公司完成),将所获阳性克隆质粒命名为pCMV/p53-miR。
以H1299细胞基因组为模板,PCR扩增miR-138、miR-34a、miR-21 前体序列,分别得到 135、146、108 bp的DNA片段,经12%PAGE,乙醇沉淀法切胶回收纯化,将回收的DNA片段用XhoⅠ和EcoRⅤ双酶切后构建到pCMV-miR和pCMV/p53-miR载体中,分别命名为pCMV-miR-138、pCMV/p53-miR-138、pCMV-miR-34a、pCMV/p53-miR-34a、pCMV-miR-21和pCMV/p53-miR-21。
1.3 细胞培养及转染
在37℃、5%CO2饱和湿度的细胞培养箱中,用含10%胎牛血清的DMEM培养基培养HeLa细胞,用含10%胎牛血清的1640培养基培养H1299细胞,采用胰酶消化法进行细胞传代。将生长状态良好的HeLa或H1299细胞接种于24孔板中,于37℃、5%CO2饱和湿度条件下培养24 h,将质粒DNA、Lipo⁃fectAMINE2000按照说明书的比例分别稀释于50 μL无血清培养基中,然后将两者轻轻混合,室温放置20 min,用无血清培养基洗24孔板细胞2次,加入400 μL无血清培养基后,将质粒-转染试剂混合物轻轻加入24孔板细胞,混匀,培养4 h,更换为含血清的正常培养基,继续培养48 h,收取细胞进行后续实验。转染实验用500 ng质粒、20 nmol/L p53 siRNA(AAGACUCCAGUGGUAAUCUACdTdT)。
1.4 RNA的提取及其完整性、浓度鉴定
用TRIzol试剂提取细胞总RNA,将提取的RNA稀释至1/50,在紫外分光光度计上检测RNA浓度及D260nm/D280nm值,取1 μg RNA用1%琼脂糖电泳鉴定RNA的完整性。
1.5 逆转录及实时荧光定量PCR
1.5.1 逆转录获得cDNA 取1 μg 细胞总RNA样品,加入1 μL oligo(dT),用DEPC水补足至11 μL,70℃变性5 min后立即置冰上退火,之后加入如下试剂的混合物[5×M-MLV逆转录缓冲液4 μL,dNTP(25 mmol/L)2 μL,M-MLV 逆转录酶 1 μL,RNase抑制剂 0.5 μL],组成 20 μL 的反应体系,42℃反应90 min后95℃处理10 min以灭活逆转录酶,置-20℃备用。
取1 μg细胞总RNA样品加尾,25 μL反应体系包括 QmiR-RT(GCGAGCACAGAATTAATACGACT⁃CACTATAGGTTTTTTTTTTTTTTTTTTVN)(500ng/μL)1 μL、10×大肠杆菌 poly(A)聚合酶缓冲液 2.5 μL、2.5 mmol/L MnCl22.5 μL、dNTP(25 mmol/L)2.5 μL、100 mmol/L ATP 2.5 μL、M-MLV 逆转录酶1 μL、大肠杆菌poly(A)聚合酶1 μL、RNase抑制剂0.5 μL,37℃反应90 min后95℃处理10 min以灭活酶,置-20℃备用。
1.5.2 实时荧光定量PCR 用安捷伦公司的Strata⁃gene MX3000P荧光定量PCR仪和SYBR Green PCR MasterMix对miR-138、miR-34a、miR-21及其各自靶基因Cyclin D3、CDK2和PTEN的mRNA水平进行检测,特异性引物序列见表1。采用MX3000P软件进行分析。
1.6 Western印迹检测
转染48 h后收集细胞,加入适量RIPA裂解液[50 mmol/L Tris-HCl(pH8.0),150 mmol/L NaCl,1%NP-40,1%去氧胆酸钠,1 mmol/L EDTA,0.1%SDS,0.2 mmol/L PMSF,1 μg/mL蛋白酶抑制剂]于冰上裂解30 min,4℃、12 000 r/min离心20 min,收集上清,用BCA法测定蛋白质浓度,用12%SDSPAGE分离蛋白;转膜至PVDF膜,用1×TBST配制5%的脱脂奶粉封闭1 h,根据一抗说明书稀释一抗,室温孵育2 h,1×TBST洗4次,每次10 min,室温孵育山羊抗兔带HRP标记的IgG(1∶8000稀释),洗膜5次,每次10 min,用增强发光液在化学发光成像系统中发光显色。

表1 实时荧光定量PCR中的引物序列
2 结果
2.1 含有p53保守结合位点的miRNA表达质粒的构建
通过生物信息学网站TP53 database数据库(http://p53.iarc.fr/)选取 3 条经典的 p53保守结合位点序列(图1)。

图1 p53保守结合位点生物信息学分析
将合成的带有酶切位点的p53结合位点序列经BamHⅠ和AscⅠ酶切处理,插入pCMV-miR载体,命名为pCMV/p53-miR;以H1299细胞基因组为模板,通过 PCR获得miR-138、miR-34a、miR-21前体序列,得到135、146、108 bp的DNA片段(图2);将扩增的片段经XhoⅠ和EcoRⅤ双酶切后插入pCMV/p53-miR质粒,命名为pCMV/p53-miRNA。

图2 天然胶PAGE鉴定miR-138、miR-34a和miR-21前体序列M:pUC18 marker;1:miR-138;2:miR-34a;3:miR-21
以pCMV-miR载体为对照,将改构的miRNA表达载体转染HeLa细胞48 h后,用qRT-PCR检测miR-138、miR-34a和miR-21的表达量,结果见图3。相对于商业化的pCMV-miR载体,pCMV/p53C-miRNA表达载体能够更加高效地表达miR-138、miR-34a和miR-21。
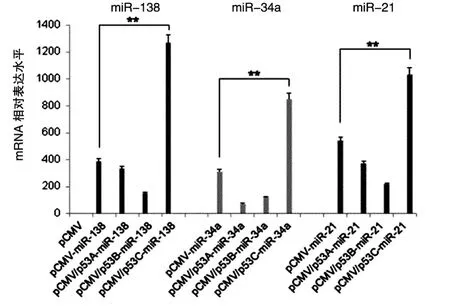
图3 HeLa细胞中miR-138、miR-34a和miR-21的表达水平(**P<0.01)
2.2 利用pCMV/p53C-miRNA载体检测miR-138、miR-34a和miR-21对其各自靶基因的调控
2.2.1 HeLa细胞中miR-138、miR-34a和miR-21对各自靶基因的调控 在具有野生型p53的HeLa细胞中,我们选取了pCMV/p53C-miRNA与商业化的pCMV-miR载体来比较miR-138、miR-34a和miR-21对各自靶基因的调控作用效果。结果显示,向HeLa细胞中转染pCMV/p53C-miR-138、pCMV/p53C-miR34a、pCMV/p53C-miR21后,Cyclin D3、CDK2、PTEN无论在mRNA水平还是蛋白水平的下调都最为明显(图4)。
用siRNA沉默HeLa细胞中的p53基因,靶基因Cyclin D3、CDK2、PTEN的表达量下调无明显变化(图5),提示pCMV/p53C-miRNA表达载体在野生型p53存在的条件下才能更好地促进miRNA表达。
2.2.2 H1299细胞中miR-138、miR-34a、miR-21对各自靶基因的作用效应检测 在不表达p53的H1299细胞中,同样用pCMV/p53C-miRNA与商业化的pCMV-miR载体比较了miR-138、miR-34a和miR-21对各自靶基因的作用效果。向H1299细胞中转染 pCMV/p53C-miR138、pCMV/p53C-miR34a、pCMV/p53C-miR21后,Cyclin D3、CDK2、PTEN无论在mRNA水平还是蛋白水平的下调程度都与商业化miRNA表达载体无明显差别;而在H1299细胞中将改构的miRNA表达载体与p53真核表达载体共转染后,靶基因Cyclin D3、CDK2、PTEN无论在mRNA水平还是蛋白水平的下调都更为明显(图6)。

图4 HeLa细胞中过表达miR-138、miR-34a和miR-21后对靶基因的作用A:实时荧光定量PCR检测HeLa细胞中用miRNA表达载体过表达miR-138、miR-34a和miR-21后各自对应靶基因Cyclin D3、CDK2和PTEN的mRNA表达水平,*P<0.05;B:Western印迹检测HeLa细胞中用miRNA表达载体过表达miR-138、miR-34a和miR-21后各自对应靶基因Cyclin D3、CDK2和PTEN的蛋白表达水平
3 讨论
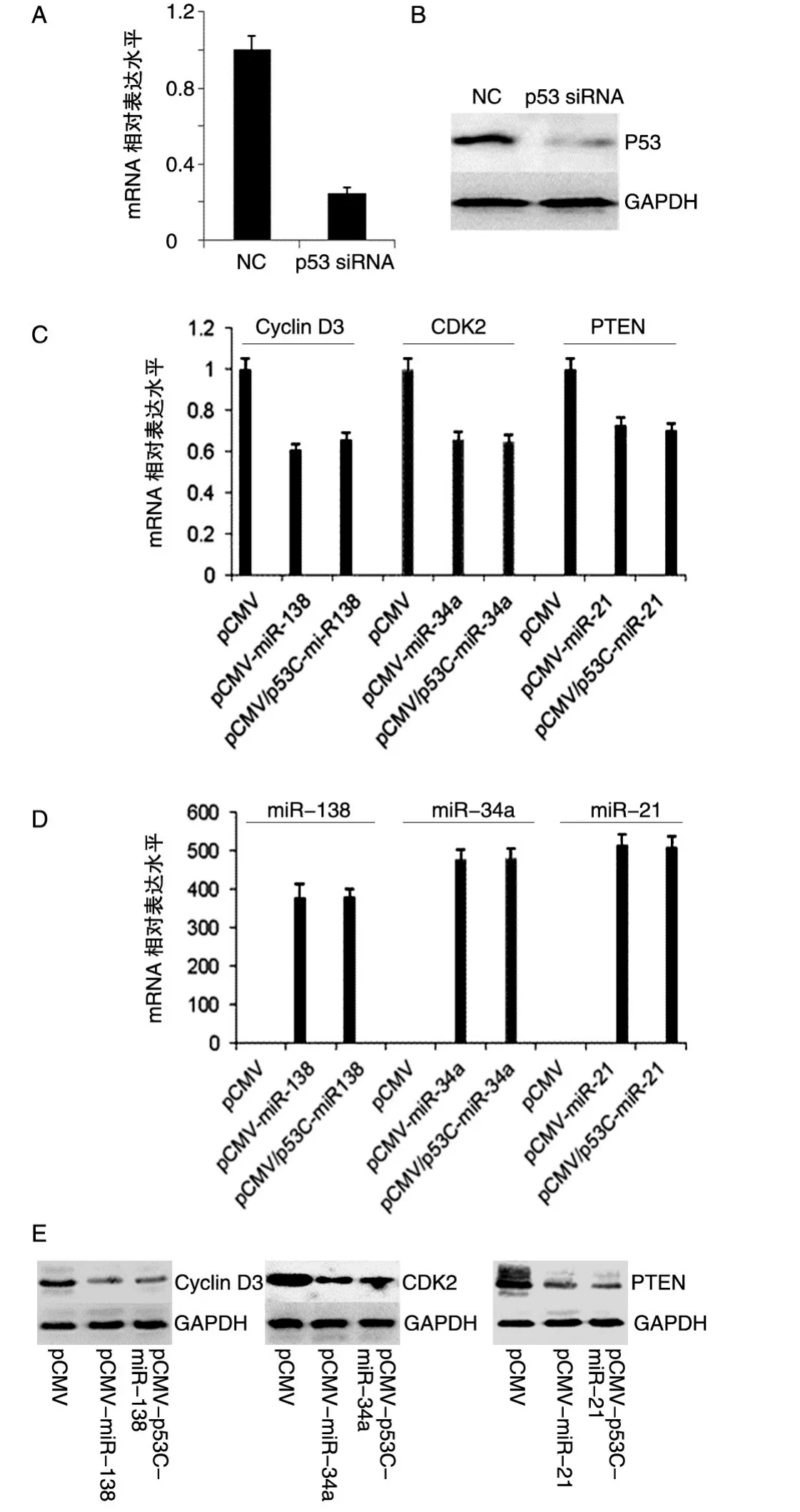
图5 敲低HeLa细胞中p53的表达后过表达miR-138、miR-34a和miR-21对靶基因表达水平的影响A:实时荧光定量PCR检测用siRNA沉默p53的mRNA表达水平;B:Western印迹检测用siRNA沉默p53的蛋白表达水平;C:实时荧光定量PCR检测过表达miR-138、miR-34a和miR-21后各自对应靶基因Cyclin D3、CDK2和PTEN的mRNA表达水平;D:实时荧光定量PCR检测过表达miR-138、miR-34a和miR-21后的miRNA表达水平;E:Western印迹检测过表达miR-138、miR-34a和miR-21后Cyclin D3、CDK2、PTEN的蛋白表达水平
从最初发现miR-34家族作为p53的直接调控因子以来[12,14-15],miRNA参与的p53信号通路便得到研究者的广泛关注。在miRNA参与的p53信号通路中,p53可以上调miRNA的表达。为了验证表达野生型p53的细胞中,p53是否可促进miRNA表达,我们将p53保守结合位点构建到miRNA表达载体中,希望借此进一步探讨p53与miRNA的调控关系。
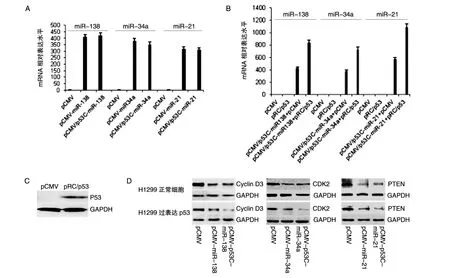
图6 H1299细胞中miR-138、miR-34a和miR-21对靶基因的作用
在表达野生型p53的HeLa细胞中转染带有p53结合位点的miRNA表达载体后,能够有效上调miR-138、miR-34a和miR-21的表达。在p53缺失型的H1299细胞中,转染带有或不带有p53结合位点的miRNA表达载体,miR-138、miR-34a和miR-21的表达量并无明显变化;将p53真核表达载体与带有p53结合位点的miRNA表达载体共转染H1299细胞,则能极大地促进miR-138、miR-34a和miR-21的表达。我们同时选用已有文献报道的miR-138、miR-34a和 miR-21靶基因 Cyclin D3、CDK2和PTEN,检测所构建的载体是否能够有效发挥基因调控功能,发现Cyclin D3、CDK2和PTEN的蛋白表达水平与mRNA水平结果是一致的。
综上所述,我们构建了含有p53结合位点的miRNA表达载体,并通过miR-138、miR-34a、miR-21及其靶基因Cyclin D3、CDK2和PTEN进行了实验验证,证实转染含有p53结合位点的miRNA表达载体后,与商业化miRNA表达载体相比,在表达野生型p53的HeLa细胞中可以提高miRNA的表达效率,而在p53缺失型H1299细胞中我们的改构载体与商业化载体的表达效率没有明显差异。这表明在表达野生型p53的细胞中,利用我们构建的载体可以更高效地促进miRNA及其对相应靶基因的调控。同时,我们可以利用该载体来初步验证细胞是否具有p53转录活性,这对研究p53-miRNA信号通路具有重要意义。
[1] Lowe S W,Cepero E,Evan G.Intrinsic tumour suppression[J].Nature,2004,432:307-315.
[2] Vogelstein B B,Lane D D,Levine A A J.Surfing the p53 network[J].Nature,2000,408:307-310.
[3] Harms K,Nozell S,Chen X.The common and distinct target genes of the p53 family transcription factors[J].Cell Mol Life Sci,2004,61(7-8):822-842.
[4] Filipowicz W,Bhattcharyya S N,Sonenberg N.Mechanisms of post-transcriptional regulation by microRNAs:are the answers in sight[J]?Nat Rev Genet,2008,9:102-114.
[5] Krol J,Loedige I,Filipowicz W.The widespread regulation of microRNA biogenesis,function and decay[J].Nat Rev,2010,11:597-610.
[6] Bartel D P.MicroRNAs:target recognition and regulatory func⁃tions[J].Cell,2009,136(2):215-233.
[7] Voorhoeve P M,le Sage C,Schrier M,et al.A genetic screen implicates miRNA-372 and miR-373 as on cogenes in testicular germ cell tumors[J].Cell,2006,124(6):1169-1181.
[8] Xi Y,Shalgi R,Fodstad O,et al.Differentially regulated mi⁃croRNAs and actively translated messenger RNA transcripts by tumor suppressor p53 in colon cancer[J].Clin Cancer Res,2006,12:2014-2024.
[9] Hermeking H.MicroRNAs in the p53 network:micromanage⁃ment of tumour suppression[J].Nat Rev Cancer,2012,12:613-626.
[10]Suth S O,Chen Y,Zaman M S,et al.MicroRNA-145 is reg⁃ulated by DNA methylation and p53 gene mutation in pros⁃tate cancer[J].Carcinogenesis,2011,32(5):772-778.
[11]Wang W,Zhao L J,Tan Y X,et al.MiR-138 induces cell cycle arrest by targeting cyclin D3 in hepatocellular carcinoma[J].Carcinogenesis,2012,33(5):1113-1120.
[12]He L,He X,Lim L P,et al.A microRNA component of the p53 tumoursuppressornetwork[J].Nature,2007,447(7148):1130-1134.
[13]Zhang J G,Wang J J,Zhao F,et al.MicroRNA-21(miR-21)represses tumor suppressor PTEN and promotes growth and in⁃vasion in non-small cell lung cancer(NSCLC)[J].Clin Chim Acta,2010,411(11-12):846-852.
[14]Tarasov V,Jung P,Verdoodt B,et al.Differential regulation of microRNAs by p53 revealed by massively parallel sequenc⁃ing:miR-34a is a p53 target that induces apoptosis and G1-arrest[J].Cell Cycle,2007,6(13):1586-1593.
[15]He X,He L,Hannon G J.The guardian's little helper:microR⁃NAsin thep53 tumorsuppressornetwork[J].CancerRes,2007,67(23):11099-11101.
