羟基磷灰石涂层镁铝合金的体外生物相容性研究
2014-05-04陈旭琼尹庆水吴增晖王智运艾福志王建华
陈旭琼,尹庆水,夏 虹,吴增晖,王智运,艾福志,王建华
基础研究
羟基磷灰石涂层镁铝合金的体外生物相容性研究
陈旭琼,尹庆水,夏 虹,吴增晖,王智运,艾福志,王建华
目的评价羟基磷灰石(HA)涂层镁铝合金(AZ31B)的体外生物相容性。方法实验分为3组:HA涂层AZ31B浸提液组(H组)、阳性对照组(P组)和空白对照组(N组)。将L929细胞与各组混合液培养3、5和7 d,采用WST-1法检测细胞活力并进行细胞毒性分级。各组混合液与稀释兔血混匀,测定吸光度(OD)并计算溶血率。采用各组混合液对白化豚鼠分别进行皮内诱导、局部诱导和激发,观察去除贴敷片24、48、72 h动物激发部位皮肤情况。结果3、5和7 d N组和H组细胞毒性反应分级为0级,P组部分细胞毒性反应分级为3级;各时间点H组、N组细胞活力均高于P组,差异有统计学意义(P<0.05)。H组、P组和N组OD值分别为(0.004± 0.001)、(0.648±0.050)和(0.008±0.003);H组溶血率为—0.6%,无溶血反应。去除贴敷片24、48、72 h H组皮肤无明显改变,P组可见中度至重度融合性红斑。结论体外实验提示HA涂层镁铝合金具有良好的体外生物相容性。
镁;铝;合金;羟基磷灰石类;骨代用品;生物相容性材料;组织相容性实验;体外研究
大部分骨科手术患者需要进行内固定来稳定骨折,以达到促进骨折愈合的目的。目前临床应用的内固定材料主要为铬镍不锈钢、钴合金、钛合金等传统金属,最大的弊端是术后需二次手术取出[1]。镁合金具有与人体相匹配的力学特性,以及其它金属所不具有的可降解性,可望成为一种新型骨科植入材料[2-3]。但镁合金本身降解太快,无法直接应用于人体。镁铝合金可在增强镁金属力学强度的同时减少其降解速率[4-6];羟基磷灰石(hydroxyapatite,HA)涂层则可在此基础上进一步保护镁铝合金不被快速降解,但生物相容性如何,相关报道不多。本研究对HA涂层镁铝合金进行体外生物安全性评价,为该材料在骨科领域的应用提供实验数据。
1 材料与方法
1.1 主要仪器、试剂和材料
酶标仪(澳大利亚,Biocell公司),Du530分光光度计(美国,Beckman公司);CO2培养箱(美国,Thermo Scientific公司);高糖DMEM培养液、优等胎牛血清、胰蛋白酶(美国,Hyclone公司),WST-1(上海碧云天生物技术有限公司),草酸钾(广州化学试剂厂),二甲基亚砜(DMSO)、完全氟氏佐剂(美国,Sigma公司);HA涂层镁铝合金(AZ31B)圆盘型样品,直径10 mm、厚3 mm(中国科学院金属所提供);小鼠成纤维细胞L929(广州军区广州总医院医学实验科细胞库提供)。
1.2 实验动物
新鲜抗凝兔血取自新西兰大白兔[广东省医学实验动物中心提供,SCXK(粤)2008-0002],白化豚鼠购自广东省实验动物中心[SCXK(粤)2008-0002]。
1.3 细胞毒性实验
将传代培养良好的L929细胞用培养液稀释至细胞浓度为104/mL。各取100 μL稀释后的含细胞培养液加入培养板中,于37℃CO2培养箱中培养。共54个孔,分为3组,每组分为3个观察期(即细胞培养3、5、7 d),各组每一观察期平行6孔。
将AZ31B浸泡于2 mL含10%胎牛血清DMEM培养液内,置于37℃培养箱中浸提24 h。AZ31B组(H组)加入含血清DMEM培养液的AZ31B浸提液;阳性对照组(P组)加入5%DMSO的含血清DMEM培养液(即DMSO与含细胞培养液的体积比为1∶20);空白对照组(N组)加入含血清DMEM培养液。24 h后各组分别取100 μL浸提液,加入含细胞培养液的培养板中,于37℃CO2培养箱中培养,2、4、6 d各孔分别加入50 μL含血清DMEM培养液,以保证细胞生存生长获得持续的营养。
分别于培养3、5、7 d取各组6孔观察细胞形态,按细胞毒性反应分级标准(表1)判定毒性分级。培养板内每孔加入10 μL WST-1溶液后置于摇床上摇动1 min,37℃培养箱内继续孵育2 h。采用酶标仪在420和620 nm下测量吸光度(optical density,OD)值,检测细胞活力。
1.4 溶血实验
实验分为HA涂层AZ31B浸提液实验组(H组)、蒸馏水阳性对照组(P组)以及生理盐水阴性对照组(N组)。各组平行操作3个样本。其中H组将HA涂层AZ31B样品完全浸泡于生理盐水(浓度为0.9%)中,37℃恒愠水浴保持30 min。取0.1 mL草酸钾溶液(浓度为20 g/L)加入干燥管中。
取新西兰白大白兔血2 mL加入干燥管,2.5 mL生理盐水(浓度为0.9%)稀释。AZ31B浸提液、蒸馏水、生理盐水(各2 mL)中分别加入0.02 mL稀释兔血,混匀后37℃水浴继续保温60 min,取出后以1 000 r/min离心5 min。比色皿中移入各组上清液,分光光度计于545 nm波长处测定OD值。
实验样品溶血率按以下公式计算:实验样品溶血率=(实验组OD值—阴性对照组OD值)/(阳性对照组OD值—阴性对照组OD值)。阴性对照组的OD值不应大于0.03,阳性对照组的OD值应在0.5~1.0之间。
1.5 最大剂量致敏实验
白化豚鼠共30只,体重250~350 g,雌雄不限。随机分为3组,阴性和阳性对照组各8只,实验组14只。HA涂层AZ31B浸提液组为实验组(H组),阳性对照为5%甲醛溶液组(P组),阴性对照为生理盐水组(N组)。
1.5.1 浸提液制备 实验组取14个HA涂层AZ31B样品,浸泡于2.0 mL生理盐水(浓度为0.9%)中,37℃恒温水浴浸提24 h。
1.5.2 溶液制备 A液:完全氟氏佐剂与生理盐水以1∶1体积比混合;B液:HA涂层AZ31B浸提液、5%甲醛和生理盐水,分别对应H组、P组及N组;C液:将B液和A液以1∶1体积比混合。
1.5.3 皮内诱导阶段 实验前一天剔除白化豚鼠颈背部(两侧肩胛骨内侧)鼠毛,面积约40 mm× 50 mm。实验第一天在去毛区中线两侧划3个对称点,从头到尾分别为对称的a、b、c点,两侧点间距15 mm,头尾点之间间距25 mm,各组取0.1 mL A、B、C液分别注射于a、b、c点。
1.5.4 局部诱导阶段 实验第六天,将10%十二烷基硫酸钠按摩导入原去毛区皮肤;第七天将25 mm ×30 mm医用一次性中单的粗糙面浸透B液后贴敷于每只白化豚鼠原去毛区的诱导注射点,缠绕固定,48 h后除去包扎带和贴敷片。
1.5.5 激发阶段 实验第二十天,剔除豚鼠右上腹部被毛,范围40 mm×60 mm;第二十一天将25 mm ×30 mm医用一次性中单粗糙面浸透C液后贴敷于豚鼠腹部去毛区,缠绕固定,24 h后去除。
激发阶段除去贴敷片后24 h、48 h、72 h观察各组动物激发部位皮肤情况,以出现红斑表示有致敏反应。
1.6 统计学分析
应用SPSS 18.0统计软件进行分析。计量资料以均数±标准差(x-±s)表示,多组细胞毒性实验OD值的比较采用Factorial ANOVA分析,组间两两比较采用S-N-K法;多组溶血试验OD值的比较采用One-way ANOVA。P<0.05为差异有统计学意义。
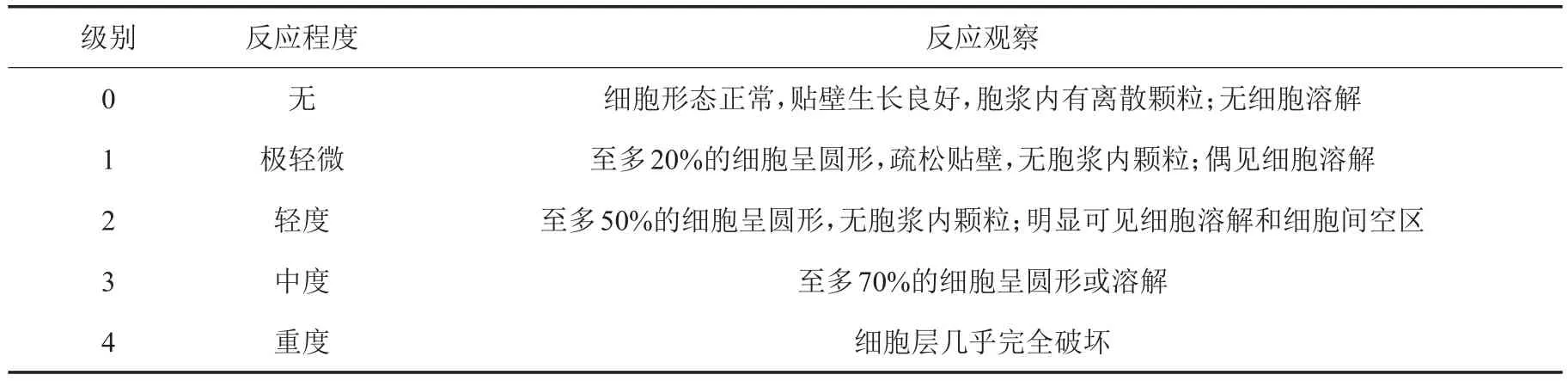
表1 细胞毒性反应分级标准
2 结果
2.1 细胞毒性实验
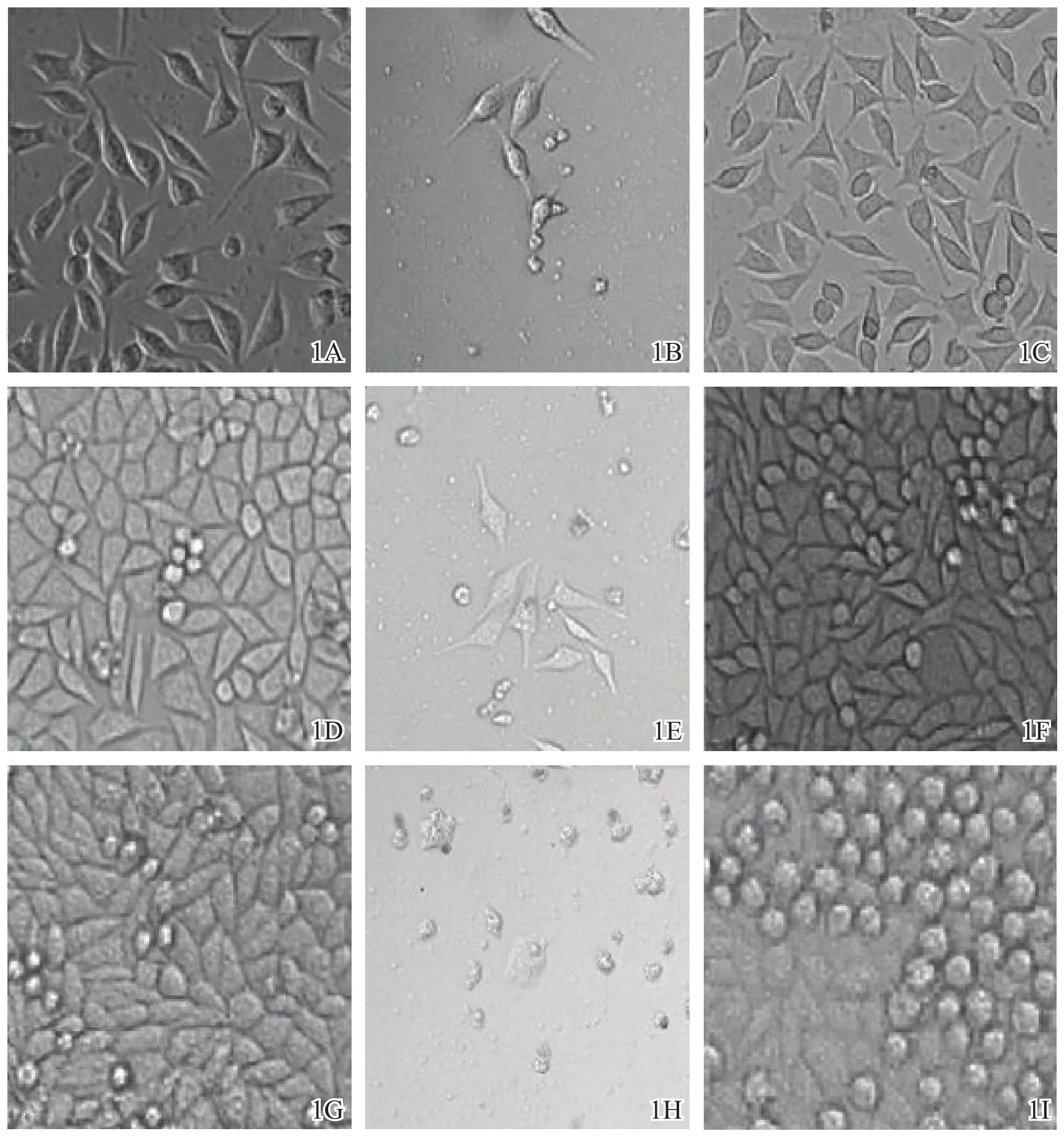
图1 细胞培养观察期(×200)1A H组培养3 d 1B P组培养3 d 1C N组培养3 d 1D H组培养5 d 1E P组培养5 d 1F N组培养5 d 1G H组培养7 d 1H P组培养7 d 1I N组培养7 d注:H组:加入含血清DMEM培养液的AZ31B浸提液组;P组:加入5%DMSO含血清DMEM培养液的阳性对照组;N组:加入含血清DMEM培养液的空白对照组
如图1所示,培养3、5、7 d N组和H组细胞贴壁生长良好,无细胞悬浮,毒性反应分级为0级;P组部分细胞呈悬浮状态,细胞量较少,毒性反应分级为3级。N组和H组培养3 d细胞密度较低,细胞伸展良好,呈长梭形或多边形;培养5 d细胞密度增加,细胞间较为拥挤,绝大部分细胞伸展良好,呈长梭形或多边形,部分细胞因细胞密度增加而形成圆形;培养7 d细胞密度极高,细胞间极其拥挤,出现分层现象,细胞难以伸展,细胞形态变小,出现大量圆形细胞。
如表2所示,H组和N组各观察期OD值均较P组为高,差异有统计学意义(P<0.05);H组和N组随时间推移细胞活力逐渐增大,5 d时达到最高峰后开始下降(P<0.05)。
2.2 溶血试验
如表3所示,N组、P组平均OD值分别为(0.008±0.003)和(0.648±0.050),本组实验有效;H组溶血率为—0.6%,无溶血反应。
2.3 最大剂量致敏实验
如图2所示,H组和N组去除贴敷片后24、48、72 h皮肤未见明显改变,P组可见中度至重度融合性红斑。
表2 各组细胞培养不同时相点OD值比较(±s,n=6)
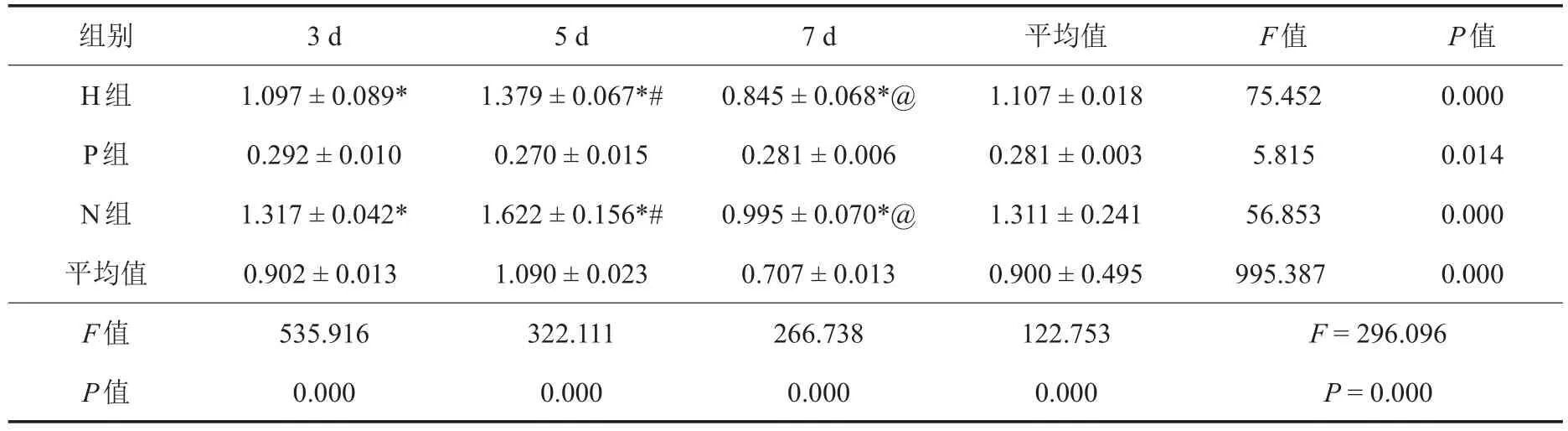
表2 各组细胞培养不同时相点OD值比较(±s,n=6)
注:OD:光密度;H组:加入含血清DMEM培养液的AZ31B浸提液组;P组:加入5%DMSO含血清DMEM培养液的阳性对照组;N组:加入含血清DMEM培养液的空白对照组。*与同一时间点P组比较,P<0.05;#与同一组3 d比较,P<0.05;@与同一组5 d比较,P<0.05
组别H组P组N组平均值F值P值3 d 1.097±0.089* 0.292±0.010 1.317±0.042* 0.902±0.013 535.916 0.000 5 d 1.379±0.067*# 0.270±0.015 1.622±0.156*# 1.090±0.023 322.111 0.000 7 d 0.845±0.068*@ 0.281±0.006 0.995±0.070*@ 0.707±0.013 266.738 0.000平均值1.107±0.018 0.281±0.003 1.311±0.241 0.900±0.495 122.753 0.000 F值75.452 5.815 56.853 995.387 F=296.096 P=0.000 P值0.000 0.014 0.000 0.000
表3 溶血试验各组OD值和溶血率(±s,n=3)
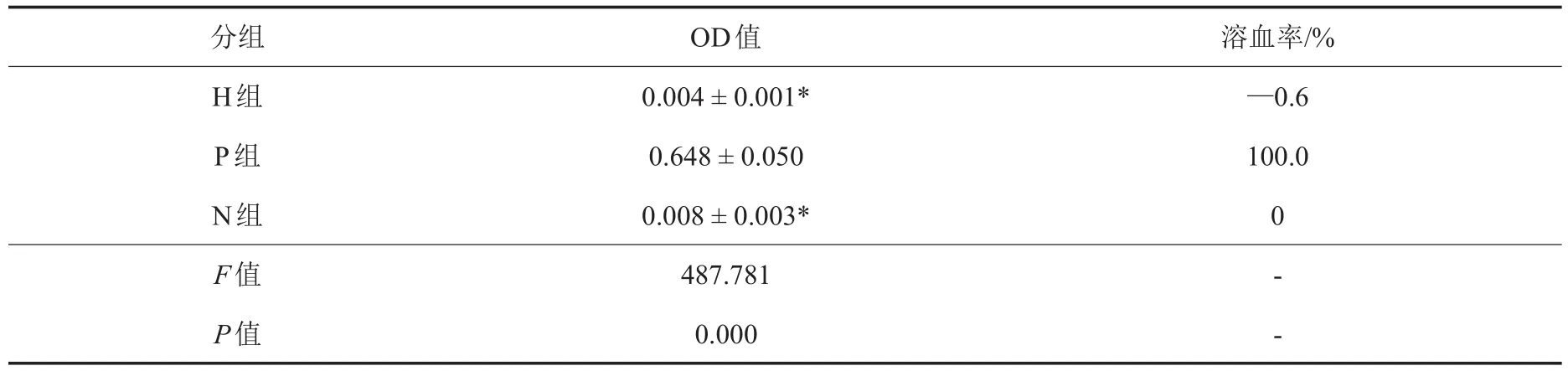
表3 溶血试验各组OD值和溶血率(±s,n=3)
注:OD:光密度;H组:AZ31B浸提液实验组;P组:蒸馏水阳性对照组;N组:生理盐水阴性对照组;*与P组比较,P<0.05
分组H组P组N组F值P值OD值0.004±0.001* 0.648±0.050 0.008±0.003* 487.781 0.000溶血率/%—0.6 100.0 0- -
3 讨论
为解决传统骨科植入物需二次取出或长期残留体内的弊端,人们致力于开发一种新型骨科植入材料,其应该具备的条件包括:①初始力学强度足以支撑病变部位的受力,与骨组织具有良好的力学相容性;②可适当降解;③降解过程所产生的离子对机体无不良影响,具有无毒、无过敏性、无致癌性的特点;④尽可能减少并发症发生风险[7-8]。镁合金是目前研究较多的金属材料,其主要缺点是低耐蚀性,生理环境下的快速腐蚀是其成为骨科植入材料的最大障碍[9]。因此,提高镁合金的耐蚀性能,是目前镁合金材料学研究的一个方向。
中科院金属所研制的AZ31B镁铝合金成分为3%Al,1%Zn,其余为Mg;挤压后抗拉强度为280 MPa,延伸率为20%,弹性模量为45 GPa,具有良好的力学特性。目前的研究表明,对合金进行保护性涂层和表面处理,可以提高材料的抗腐蚀性,并增强材料的生物相容性和镁基植入物的生理活性[10-13]。人工HA材料的组成性质与人体组织HA极为相似,具有良好的生物相容性和骨传导作用,可为新骨形成提供支架[14]。刘魁等[15]的研究结果表明,与AZ31B比较,HA涂层的AZ31B材料生物安全性明显增加,溶血率降低,抗腐蚀性能增强。我们的研究结果显示,HA涂层的镁铝合金与L929细胞培养3、5、7 d后,浸提液内细胞贴壁生长良好,无细胞悬浮,毒性反应为0级,OD值亦明显高于阳性对照组(P<0.05)。这些结果均提示该合金材料无细胞毒性。
我们还观察到,HA涂层镁铝合金与L929细胞培养3、5、7 d,细胞活力随时间推移,一开始呈现逐渐增加的趋势,5 d达到最大活力,随后开始下降,这一随时间变化的趋势与阴性对照组相似。原因可能是,一开始两组细胞在培养孔中密度适中,培养液中的营养足以为细胞生长提供充分的养料,因此细胞活力能随时间推移而增加;5 d后,两组细胞在培养孔中密度增加,细胞相对拥挤,加入的培养液已无法满足培养孔中细胞营养的需求,细胞无法完全伸展,细胞形态变小、变圆,进而影响了细胞的活力。这种现象并非是HA涂层镁铝合金的毒性表现,而是该材料良好细胞相容性的佐证。阳性对照组细胞活力随时间变化并未出现明显改变,表明细胞生长始终处于受抑制状态。
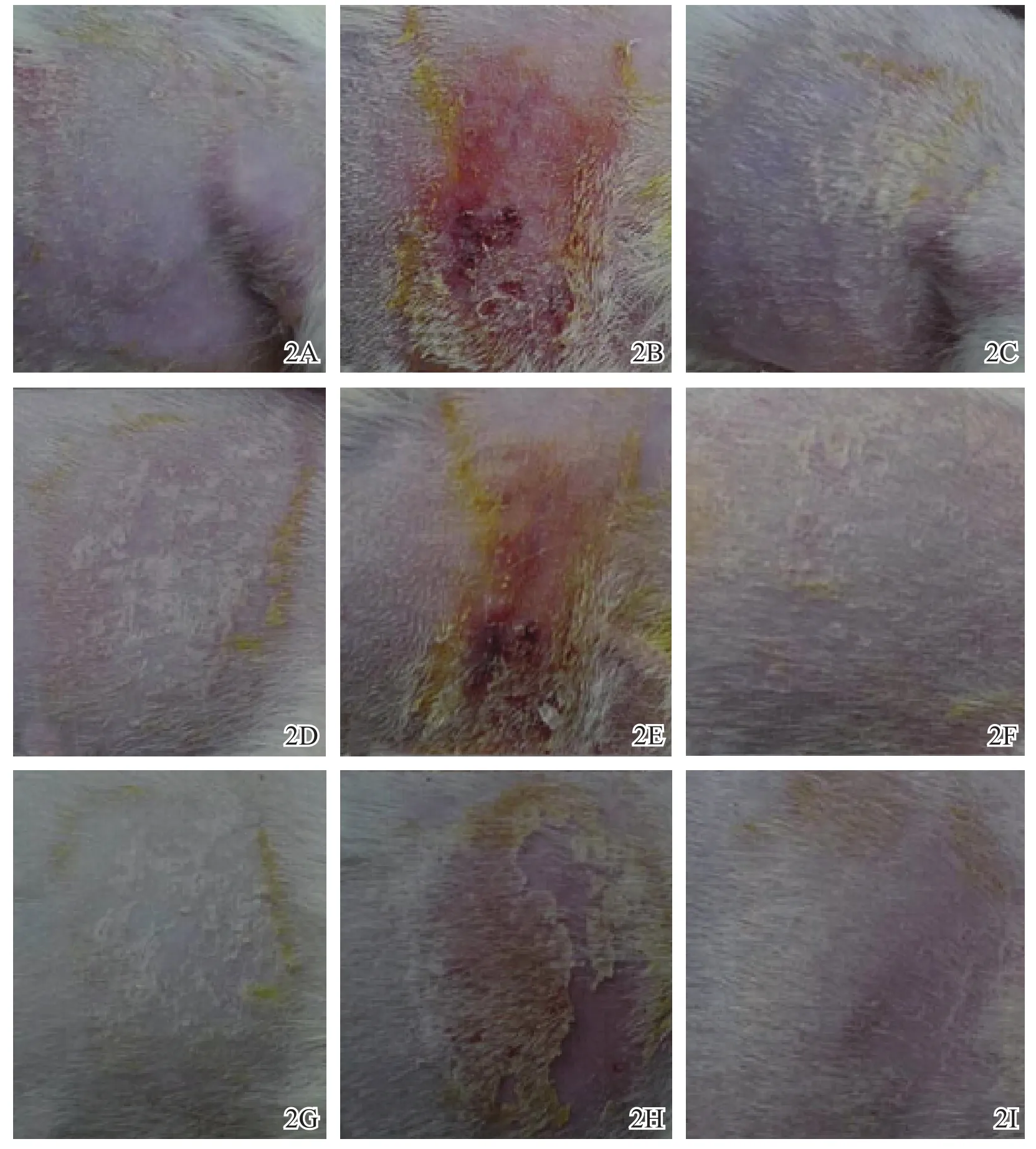
图2 激发阶段去除贴敷片后白化豚鼠皮肤反应图片 2A H组去除贴敷片后24 h 2B P组去除贴敷片后24 h 2C N组去除贴敷片后24 h 2D H组去除贴敷片后48 h 2E P组去除贴敷片后48 h 2F N组去除贴敷片后48 h 2G H组去除贴敷片后72 h 2H P组去除贴敷片后72 h 2I N组去除贴敷片后72 h注:H组:AZ31B浸提液实验组:P组:5%甲醛溶液阳性对照组;N组:生理盐水阴性对照组
我们既往的实验研究结果证实,无涂层镁铝合金具有严重的溶血反应[16],本实验结果显示,HA涂层镁铝合金溶血率为—0.6%,无溶血反应。孟祥翔等[17]报道,表面进行阶跃式阳极氧化改性后的镁合金(AZ-1和AZ-3)材料溶血率<5%,具有良好的血液相容性;郭磊等[18]对氧化镁表面膜处理的AZ31B镁合金材料进行安全性评价,结果显示,与AZ31B镁材料较高的溶血率相比,经氧化镁表面膜处理的AZ31B镁合金材料其溶血率符合生物材料标准,表明涂层处理可大大减少镁合金的溶血作用。
尽管我们的既往研究[19]提示镁铝合金无皮肤致敏作用,但毕竟涂层改变了镁铝合金的性状,因此我们对HA涂层镁铝合金作了进一步的皮肤致敏实验,结果显示豚鼠皮肤无明显改变,该涂层材料无致敏作用。
[1]Park JB,Kim YK.Metallic biomaterials//Park JB,Bronzino JD.Biomaterials principles and application[M].Boca Raton: CRC Press,2003.
[2]Niinomi M,Nakai M,Hieda J.Development of new metallic alloys for biomedical applications[J].Acta Biomater,2012,8 (11):3888-3903.
[3]Persaud-Sharma D,McGoron A.Biodegradable magnesium alloys:a review of material development and applications[J]. J Biomim Biomater Tissue Eng,2012,(12):25-39.
[4]陈旭琼,尹庆水,张余,等.镁铝合金界面螺钉骨腱固定重建前交叉韧带的实验研究:猪腱骨骨腱固定的生物力学分析[J].中国骨与关节损伤杂志,2010,25(4):312-315.
[5] NiederlaenderJ,WalterM,KrajewskiS,etal.Cytocompatibility evaluation of different biodegradable magnesium alloys with human mesenchymal stem cells[J].J Mater Sci Mater Med,2014,25(3):835-843.
[6]Xu L,Yu G,Zhang E,et al.In vivo corrosion behavior of Mg-Mn-Zn alloy for bone implant application[J].J Biomed Mater Res A,2007,83(3):703-711.
[7]Böstman OM.Absorbale implant for the fixation of fractures [J].J Bone Joint Sur Am,1991,73(1):148-153.
[8]Matsusue Y,Hanafusa S,Yamamuro T,et al.Tissue reaction of bioabsorbable ultra high strength poly(L-lactide)rod[J]. Clin Orthop Relat Res,1995,(317):246-253.
[9] Shaw BA.Corrosion resistance ofmagnesium alloys// Stephen D.ASM handbook:volume 13a:corrosion:fundamentals,testing and protection[M].UK:ASM Int.2003.
[10]Drynda A,Hassel T,Hoehn R,et al.Development and biocompatibility of a novel corrodible fluoride-coated magnesium-calcium alloy with improved degradation kinetics and adequate mechanical properties for cardiovascular applications[J].J Biomed Mater Res A,2010,93(2):763-775.
[11]Gray-Munro JE,Seguin C,Strong M.Influence of surface modification on the in vitro corrosion rate of magnesium alloy AZ31[J].J Biomed Mater Res A,2009,91(1):221-230.
[12]Wong HM,Yeung KW,Lam KO,et al.A biodegradable polymer-based coating to control the performance of magnesium alloy orthopaedic implants [J].Biomaterials, 2010,31(8):2084-2096.
[13]Xin Y,Jiang J,Huo K,et al.Corrosion resistance and cytocompatibility of biodegradable surgical magnesium alloy coated with hydrogenated amorphous silicon[J].J Biomed Mater Res A,2009,89(3):717-726.
[14]Hench LL.Bioceramics:from concept to clinic[J].J Am Ceram Soc,1991,74(7):1487-1510.
[15]刘魁,郭磊,黄晶晶,等.AZ31B镁合金植入小鼠的生物相容性考察[J].中国生物工程杂志,2008,28(3):59-63.
[16]陈旭琼,尹庆水,张余,等.镁合金材料的溶血率及影响因素[J].中国组织工程研究,2012,16(25):4632-4636.
[17]孟祥翔,王钢,王飞,等.新型医用镁合金材料的体外生物相容性研究[J].中华创伤骨科杂志,2009,11(3):243-246.
[18]郭磊,刘魁,张世亮,等.氧化镁膜AZ31B镁合金材料的细胞毒性研究[J].稀有金属材料与工程,2008,37(6):1027-1031.
[19]陈旭琼,尹庆水,张余,等.镁铝合金最大剂量的致敏试验[J].中国组织工程研究与临床康复,2010,14(16): 2899-2902.
Biocompatibility of magnesium-aluminum alloy with hydroxyapatite coating in vitro
CHEN Xuqiong,YIN Qingshui,XIA Hong,WU Zenghui,WANG Zhiyun,AI Fuzhi,WANG Jianhua.Hospital of Orthopaedics,Guangzhou Gerneral Hospital of Guangzhou Military Command,Guangzhou,Guangdong 510010,China
YIN Qingshui,E-mail:gz_yqs@126.com
ObjectiveTo evaluate the biocompatibility of magnesium-aluminum alloy(AZ31B)with hydroxyapatite (HA) coating in vitro.Methods The experimentincluded three groups,group of HA-coated AZ31B leaching liquors(H group),positive control group(P group)and blank group(N group).L929 cells were cultured with mixtures in 3 groups for 3,5 and 7 days,the cell toxicity was graded,and cell viability was measured by WST-1.Optical density(OD)was examined and hemolysis rate was then calculated after diluted cony blood mixed with mixtures in each group.Intradermally,locally induction and stimulation were underwent on the skin of Cavia Cobaya with mixtures in 3 groups.The condition of skin sensitization of Cavia Cobaya was observed 24,48 and 72 h after sticking removed.Results Cell toxicity was graded as 0 grade in Hgroup and N group after 3,5 and 7 day's culture,while the cell toxicity of part of cells in P group was graded as 3 grade.Cell viability in H and N groups were higher than that in P group,the difference had statistical significance(P>0.05).OD in H group,P group and N groups was(0.004±0.001),(0.648±0.050)and(0.008 ±0.003)respectively.The rate of haemolysis was—0.6%in H group,and no hemolysis reaction was found.The skin had no obvious changes in H group 24,48 and 72 h after sticking removed,while moderate to severe cofluenterythema on the skin was found in P group.Conclusion Experimentalresults showed magnesium-aluminum alloy with HA coating has good biocompatibility in vitro.
Megnesium;Aluminum;Alloys;Hydroxyapatites;Bone substitutes;Biocompatible materials; Histocompatibility testing;In vitro
R318.08,R329.2
A
1674-666X(2014)03-0159-07
2014-03-28;
2014-05-14)
(本文编辑:白朝晖)
10.3969/j.issn.1674-666X.2014.03.006
国家自然科学基金资助(30872642),全军“十二五”计划课题重点项目(BWS11C065)
510010广州军区广州总医院骨科医院
尹庆水,E-mail:gz_yqs@126.com
