改性活性炭负载铈吸附剂的制备及其脱硫性能
2014-05-03王广建付信涛仙保震
王广建,刘 影,付信涛,仙保震,刘 辉
(1.青岛科技大学,山东 青岛 266042;2.北京化工大学 化工资源有效利用国家重点实验室,北京 100029)
柴油燃烧排放的废气对环境产生危害,不仅可形成酸雨,而且对NOx和颗粒物的产生有明显的促进作用[1]。目前,柴油的传统加氢脱硫技术对噻吩类硫化物及其衍生物的选择性很低且需在高温、高压的临氢条件下进行[2],故开发常温非氢化选择性脱硫技术备受关注。吸附脱硫因其常温及非氢化的特点成为最有发展前景的技术。吸附脱硫技术的核心是开发出选择性高、吸附容量大的高效吸附剂。
活性炭表面含有大量软酸活性位[3],而燃油中噻吩类硫化物大多为Lewis碱[4],依据Lewis酸碱理论机理,提高活性炭表面酸度,将有助于提高活性炭对噻吩类硫化物的吸附选择性。超声波作为一种能量体系,可影响体系的孔结构和负载离子的晶粒大小及分散度,有助于提高吸附能力。
铈元素的氧化态呈现Ce3+和Ce4+两种价态的相互转化,能促进氧化还原反应进行。近几年来,CeO2作为活性组分在催化剂和吸附剂方面的应用已受到广泛关注[5-11]。CeO2结合活性炭良好的吸附性能,有可能制备出低温下具有较高活性的脱硫吸附剂。
本工作以CeO2为活性组分、以椰壳活性炭为载体,通过多种改性方法制备具有高活性、大吸附容量和更易于脱附的高效吸附剂,考察Ce负载量对吸附脱硫的影响。
1 实验部分
1.1 吸附剂的制备方法
将粒径0.27~ 0.83 mm的颗粒椰壳活性炭用去离子水洗涤多次,放入干燥箱于110 ℃下干燥12 h,记作AC;分别用一定浓度的HCl,HNO3,H2O2,NH3·H2O对AC进行表面氧化改性,洗涤至中性,于110 ℃下干燥12 h备用,分别记作ACHCl,AC-HNO3,AC-H2O2,AC-NH3·H2O;经60 ℃和90 ℃ HNO3改性的AC分别记作60-ACHNO3,90-AC-HNO3。
称取两份等量的90-AC-HNO3,分别采用Ce(NO3)3溶液进行浸渍,一份在室温下采用普通浸渍法浸渍12 h;另一份在40 kHz频率的超声波条件下先超声浸渍6 h,之后放在室温下继续普通浸渍6 h。浸渍后过滤,在110 ℃下干燥12 h,然后在300 ℃氮气气氛下焙烧4 h即制得吸附剂。采用普通浸渍法和超声辅助浸渍法制备的吸附剂分别记作Ce/AC,Ce/AC-UI。
1.2 吸附剂的表征方法
采用Bruker公司TENSOR-27型傅里叶变换红外光谱仪对试样进行FTIR表征,KBr压片,扫描范围400~4 000 cm-1。采用日本电子公司JSM-6700F型冷场发射扫描电子显微镜进行试样形貌和颗粒大小的分析。采用麦克仪器公司AutoChem2920型全自动化学吸附仪进行H2-TPR实验:准确称取50 mg试样,以10%(φ)H2-90%(φ)Ar的混合气为还原气,气体流量30 mL/min,以10 ℃/min的速率从室温升至850 ℃进行还原,采用TCD检测H2消耗。采用麦克仪器公司ASAP 2020型比表面积和孔隙度分析测试仪测定试样的比表面积和孔结构。
1.3 吸附脱硫实验方法
将噻吩溶解在正辛烷中,配成硫含量为1 000 μg/g的模型柴油。在一定体积的模型柴油中加入一定质量的吸附剂进行静态吸附脱硫实验,剂油比为1∶8 g/mL,在25 ℃下静态吸附12 h,吸附后过滤并收集滤液。吸附脱硫模型柴油的硫含量采用山东鲁南瑞虹化工仪器有限公司SP-6890型气相色谱仪进行测定。
吸附平衡时的脱硫率(η)由下式计算:
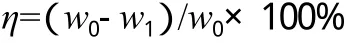
式中,w0为吸附前柴油中的硫含量,μg/g;w1为吸附平衡后柴油中的硫含量,μg/g。
2 结果与讨论
2.1 改性方式对AC及其表面性质的影响
氧化改性对AC脱硫性能的影响见图1。从图1可看出,AC-HNO3的脱硫率最高。

图1 氧化改性对AC脱硫性能的影响Fig.1 Effect of oxidative modi fi cation on the desulfurization rate of activated carbon(AC).
氧化改性AC的H2-TPR曲线见图2。

图2 氧化改性AC的H2-TPR曲线Fig.2 H2-TPR curves of the ACs modi fi ed by oxidation.
由图2可见,与AC相比, AC-HNO3的H2-TPR曲线在400 ℃和600 ℃附近出现两个耗氢峰,尤其是在600 ℃附近的耗氢峰较高,这与AC表面的含氧酸性基团有关。在较高的温度下AC表面的含氧酸性基团分解,表面的C原子处于不饱和状态,具有一定的吸氢能力,导致耗氢量增加[12]。这在一定程度上证明了AC表面的含氧酸性基团的含量与脱硫率之间存在一定关系,即AC表面含氧酸性基团越多,脱硫率越高。
改性温度对AC-HNO3脱硫率的影响图3。由图3可见,随改性温度的升高,脱硫率先增大后降低,当改性温度为90 ℃时脱硫率最高。这是因为随改性温度的升高,HNO3的氧化性增强,AC表面的含氧酸性基团(尤其是羧基、酯基、酚羟基等)的含量明显增加,从而提高了脱硫率;改性温度继续升高,脱硫率不增反降,这可能是因为AC的孔结构在过高的温度下遭到破坏[13-14]。因此,采用HNO3改性适宜的温度为90 ℃。

图3 改性温度对AC-HNO3脱硫率的影响Fig.3 Effect of modi fi cation temperatures on the desulfurization rate of AC-HNO3.
不同吸附剂的FTIR谱图见图4。由图4可知,1 500~1 800 cm-1处的吸收峰归属于羰基、羧基及内酯基CO键的伸缩振动[15],Ce/AC与90-ACHNO3的谱图相比,吸收峰有所增强,这可能是Ce4+具有较强的氧化能力,能在AC表面引入一些新的含氧酸性基团,形成了更多的羰基、羧基及内酯基CO键[16]。
CeO2可以形象比作氧的储存器,通过Ce4+/Ce3+氧化还原电对来存储和释放氧,从而改变AC表面的含氧酸性基团数量[17]。基于这种机理,能用氧化的方法将一个或两个氧原子连接到噻吩类化合物的硫原子上,增大其偶极矩,使其易溶于极性溶剂,再通过萃取或吸附等方法将柴油中的噻吩类化合物脱除[18]。从图4还可看出,与AC相比,AC-HNO3的吸收峰都有所增强,且随改性温度的升高,吸收峰增强,这说明随改性温度的升高,增加了AC表面的含氧酸性基团数量[19],即HNO3改性和负载CeO2改性都可使AC表面含氧酸性基团的数量增加;4个试样均出现以3 400 cm-1为中心的谱带,这一谱带应归属于AC表面OH、COOH和化学吸附水的OH伸缩振动[20],说明氧化改性及负载CeO2后没有改变AC表面OH和COOH基团的数量。

图4 不同吸附剂的FTIR谱图Fig.4 FTIR spectra of the different adsorbents.
2.2 浸渍条件和负载量对脱硫率的影响
Ce负载量对脱硫率的影响见图5。由图5可见,随Ce负载量的增大,脱硫率先增加后减小,当负载量为10%(w)时,脱硫率最高,达到95%;与Ce/AC相比,Ce/AC-UI的脱硫率更高。

图5 Ce负载量对脱硫率的影响Fig.5 Effects of Ce loading on the desulfurization rate.
Ce/AC对噻吩的吸附是化学吸附和物理吸附共同作用的结果。负载Ce及超声波辅助提高脱硫率的原因主要有以下几点:1)在AC表面Ce的单层覆盖量控制着化学吸附能力,超声波辅助能使活性组分晶粒更小更好地分散在AC表面,同时增加更多的活性位点,从而提高脱硫能力;2)微孔控制着物理吸附能力,而大孔和介孔起到通道作用;超声波辅助能使AC孔体积和比表面积增加[21-22],从而提高了脱硫率;3)当Ce负载量大于10%(w)时,活性组分凝聚在一起,导致部分微孔被堵,比表面积和孔体积减小[23-24],不利于噻吩的吸附,脱硫率降低。在负载量低于10%(w)时,AC表面覆盖的活性组分含量低,导致活性位点不够多,因此脱硫率随负载量的增加而增大。
不同吸附剂的比表面积及孔体积见表1。由表1可见,与AC相比,Ce/AC和Ce/AC-UI的比表面积、孔体积,尤其是微孔孔体积均减小。微孔孔体积是影响吸附剂物理吸附的重要因素,但Ce/AC和Ce/AC-UI的微孔孔体积减小并没有影响其脱硫率。这表明吸附容量不仅与物理吸附有关,还与噻吩中的硫原子与Ce4+形成S-M络合作用,产生化学吸附有关,利用这种络合作用以及金属阳离子与噻吩和芳烃成键强度的差异,可选择性地脱除噻吩类含硫化合物[25]。这就是Ce/AC脱硫性能优于AC的原因。

表1 不同吸附剂的比表面积及孔体积Table 1 Speci fi c surface area(S) and pore volume(V) of the adsorbents
由表1还可见,与Ce/AC相比,Ce/AC-UI的比表面积和孔体积均增大,这与田生友等[26]在微波-浸渍联合改性活性炭对CS2吸附性能的研究中得到的结果相一致。这可能是因为超声波的作用,使得金属微粒更细小且在活性炭表面更好地分布[23];超声波还具有空化作用,超声波在液体介质中传播时,液体中某些区域形成局部的暂时负压,产生空穴或气泡,这对活性炭的比表面积和孔体积有较大影响[27]。
更大的比表面积和孔体积有利于活性组分的负载,故Ce/AC-UI脱硫率较Ce/AC有所提高,具体的孔分布见图6。
Ce/AC-UI和Ce/AC的SEM照片见图7。由图7可见,与Ce/AC相比,Ce/AC-UI中的活性组分颗粒小且均匀。这是因为超声波产生的波动和振动使活性组分能更均匀地负载在载体上[28]。超声波产生的空化作用形成的高温高压的环境提供了形成微小颗粒所需要的能量,同时也减少了活性组分聚集在一起的现象。此外,超声波产生的高温和泡沫也能降低晶体形成的自由能,抑制晶体的生长。

图6 不同吸附剂的孔分布Fig.6 Pore-size distributions of the adsorbents.

图7 Ce/AC-UI(a)和Ce/AC(b)的SEM照片Fig.7 SEM images of Ce/AC-UI(a) and Ce/AC(b).
2.3 吸附等温线的测定
298.15 K下噻吩在Ce/AC上的吸附等温线见图8。按照Brunauer吸附等温线分类[29],噻吩在AC上的吸附等温线是向上凸的Langmuir型吸附曲线[30],与单佳慧等[31]在超声离子交换法制备的CuCeY吸附剂对噻吩的吸附动力学和热力学研究中得出的结论相一致。这表明在液相中噻吩浓度很低的情况下AC仍具有很高的吸附平衡量,说明AC对噻吩有较强的吸附作用。对AC进行氧化和负载改性能进一步增强其对噻吩的吸附能力。

图8 298.15 K下噻吩在Ce/AC上的吸附等温线Fig.8 Adsorption isotherms of thiophene on Ce/AC at 298.15 K.
3 结论
1)采用H2O2,HNO3,HCl,NH3·H2O对AC进行氧化改性,其中在90 ℃下用HNO3改性的AC,其表面含氧酸性基团的数量增加得最多,脱硫率最高。
2)以90-AC-HNO3为载体,采用超声波辅助浸渍法负载CeO2制备的Ce/AC-UI吸附剂的脱硫率最高达95%;与普通浸渍法相比,超声波辅助可使活性组分更好地分散在AC的表面,增加了活性位点的同时也增加了吸附剂的比表面积和孔体积,更有利于吸附脱硫。
3)对AC进行HNO3氧化改性和负载CeO2改性可明显增强AC对噻吩的吸附能力;298.15 K时吸附剂Ce/AC吸附噻吩的等温线可用 Langmuir模型进行描述。
[1]Song Chunshan,Ma Xiaoliang.New Design Approaches to Ultra-Clean Diesel Fuels by Deep Desulfurization and Deep Dearomatization[J].Appl Catal,B,2003,41(1):207-238.
[2]Ma Xiaolian,Sun Lu,Song Chunshan.A New Approach to Deep Desulfurization of Gasoline,Diesel Fuel and Jet Fuel by Selective Adsorption for Ultra-Clean Fuels and for Fuel Cell Applications[J].Catal Today,2002,77(1):107-116.
[3]Alfarra A,Frackowiak E,Beguin F.The HSAB Concept as a Means to Interpret the Adsorption of Metal Ions onto Activated Carbons[J].Appl Surf Sci,2004,228(1):84-92.
[4]Xue Mei,Chitrakar R,Sakane K,et al.Selective Adsorption of Thiophene and 1-Benzothiophene on Metal-Ion-Exchanged Zeolites in Organic Medium[J].J Colloid Interface Sci,2005,285(2):487-492.
[5]Huang G,Liaw B J,Jhang C J,et al.Steam Reforming of Methanol over CuO/ZnO/CeO2/ZrO2/Al2O3Catalysts[J].Appl Catal,A,2009,358(1):7-12.
[6]Qiao Dongsheng,Lu Guanzhong,Guo Yun,et al.Effect of Water Vapor on the CO and CH4Catalytic Oxidation over CeO2-MOx(M = Cu,Mn,Fe,Co,and Ni) Mixed Oxide[J].J Rare Earths,2010,28(5):742-746.
[7]Ma Xiaodong,Sun Hongwen,Sun Quan,et al.Catalytic Oxidation of CO and o-DCB over CuO/CeO2Catalysts Supported on Hierarchically Porous Silica[J].Catal Commun,2011,12(6): 426-430.
[8]Zeng Y,Kaytakoglu S,Harrison D P.Reduced Cerium Oxide as an Ef fi cient and Durable High Temperature Desulfurization Sorbent[J].Chem Eng Sci,2000,55(21):4893-4900.
[9]Trovarelli A,de Leitenburg C,Boaro M,et al.The Utilization of Ceria in Industrial Catalysis[J].Catal Today,1999,50(2):353-367.
[10]Boaro M,de Leitenburg C,Dolcetti G,et al.Oxygen Storage Behavior of Ceria-Zirconia-Based Catalysts in the Presence of SO2[J].Top Catal,2001,16(1/4):299-306.
[11]Aneggi E,Boaro M,Leitenburg C,et al.Insights into the Redox Properties of Ceria-Based Oxides and Their Implications in Catalysis[J].J Alloys Comp,2006,408:1096-1102.
[12]Menendez J A,Phillips J,Xia Bo,et al.On the Modi fi cation and Characterization of Chemical Surface Properties of Activated Carbon:In the Search of Carbons with Stable Basic Properties[J].Langmuir,1996,12(18):4404-4410.
[13]Yu Moxin,Li Zhong,Ji Qiaona,et al.Effect of Thermal Oxidation of Activated Carbon Surface on Its Adsorption Towards Dibenzothiophene[J].Chem Eng J,2009,148(2):242-247.
[14]Zhou Anning,Ma Xiaoliang,Song Chunshan.Effects of Oxidative Modi fi cation of Carbon Surface on the Adsorption of Sulfur Compounds in Diesel Fuel[J].Appl Catal,B,2009,87(3):190-199.
[15]于畅.炭基材料在燃油吸附-氧化脱硫中的应用研究[D].大连:大连理工大学,2007.
[16]Serrano-Ruiz J C,López-Cudero A,Solla-Gullón J,et al.Hydrogenation of α,β Unsaturated Aldehydes over Polycrystalline,(111) and (100) Preferentially Oriented Pt Nanoparticles Supported on Carbon[J].J Catal,2008,253(1):159-166.
[17]Kašpar J,Fornasiero P,Graziani M.Use of CeO2-Based Oxides in the Three-Way Catalysis[J].Catal Today,1999,50(2):285-298.
[18]李海燕,宋华,李锋,等.燃料油氧化脱硫的研究进展[J].石油化工,2006,35(11):1110-1114.
[19]Fan Xiaopeng,Li Caiting,Zeng Guangming,et al.Removal of Gas-Phase Element Mercury by Activated Carbon Fiber Impregnated with CeO2[J].Energy Fuels,2010,24(8):4250-4254.
[20]Pakula M,Biniak S,Swiatkowski A.Chemical and Electrochemical Studies of Interactions Between Iron(III) Ions and an Activated Carbon Surface[J].Langmuir,1998,14(11):3082-3089.
[21]Hamdaoui O,Djeribi R,Naffrechoux E.Desorption of Metal Ions from Activated Carbon in the Presence of Ultrasound[J].Ind Eng Chem Res,2005,44(13):4737-4744.
[22]Suslick K S,Choe S B,Cichowlas A A,et al.Sonochemical Synthesis of Amorphous Iron[J].Nature,1991,353(6343):414-416.
[23]Yan Zheng,Wang Jinping,Zou Ruqiang,et al.Hydrothermal Synthesis of CeO2Nanoparticles on Activated Carbon with Enhanced Desulfurization Activity[J].Energy Fuels,2012,26(9):5879-5886.
[24]沈伯雄,郭宾彬,史展亮,等.CeO2/ACF的低温SCR烟气脱硝性能研究[J].燃料化学学报,2007,35(1):125-128.
[25]谷涛,慕旭宏,杜冰.Cu(Ⅰ)Y分子筛吸附剂的制备及其脱硫性能[J].石油化工,2006,35(8):716-719.
[26]田生友,梅华,吴文艳.微波-浸渍联合改性活性炭对CS2吸附性能的研究[J].石油化工,2011,40(12):1348-1354.
[27]Xiao Jing,Bian Guoan,Zhang Wei,et al.Adsorption of Dibenzothiophene on Ag/Cu/Fe-Supported Activated Carbons Prepared by Ultrasonic-Assisted Impregnation[J].J Chem Eng Data,2010,55(12):5818-5823.
[28]Liao Junjie,Zhang Yanjun,Wang Wenbo,et al.Preparation of γ-Al2O3Sorbents Loaded with Metal Components and Removal of Thiophene from Coking Benzene[J].Adsorption,2012,18(3/4):181-187.
[29]Brunauer S,Emmett P H.Chemisorptions of Gases on Iron Synthetic Ammonia Catalysts[J].J Am Chem Soc,1940,62(7):1732-1746.
[30]Serrano-Ruiz J C,Ramos-Fernandez E V,Silvestre-Albero J, et al.Preparation and Characterization of CeO2Highly Dispersed on Activated Carbon[J].Mater Res Bull,2008,43(7):1850-1857.
[31]单佳慧,刘晓勤.超声离子交换法制备的CuCeY吸附剂对噻吩的吸附动力学和热力学[J].石油化工,2010,39(8):896-901.
