苯酚-硫酸法测定南瓜籽多糖含量的条件优化
2014-05-02王丽波
池 源 王丽波
CHI YuanWANG Li-bo
(东北农业大学理学院,黑龙江 哈尔滨 150030)
(College of Science,Northeast Agricultural University,Harbin,Heilongjiang 150030,China)
南瓜 (cucurbita moschata Duch),别名番瓜、饭瓜等,是葫芦科一年生草本植物。南瓜籽为南瓜的成熟种子,含有丰富的不饱和脂肪酸、蛋白质、植物甾醇、维生素、多糖及矿物质等[1,2]。目前市场上已出现的一些南瓜籽提取物保健产品[3],均含有一定多糖成分,并标注具有降血糖等生物活性。但未见有关南瓜籽中多糖含量及其生物活性的相关报道。南瓜籽多糖是否与南瓜果肉多糖一样具有抗氧化及降血糖的功能[4-6]还有待进一步研究。
目前多糖含量的测定方法常用的主要有蒽酮-硫酸法和苯酚-硫酸法两种。两种方法显色原理基本相同,都是在浓硫酸的作用下将多糖水解成单糖,并迅速脱水生成糠醛衍生物,其与蒽酮反应可生成蓝绿色糠醛衍生物,或与苯酚生成橙黄色化合物,但相比较苯酚-硫酸法具有试验操作步骤少,稳定性好及所用仪器简单等优势被广泛用于测定多糖含量[7-9]中。目前,尚未查到有关使用苯酚-硫酸法测定南瓜籽中多糖含量的报道。因为苯酚-硫酸法本身存在一定波动性,不同的含糖物质测定条件均有所不同等特点[10,11],如果只参考已有文献的测定条件来确定具体的试验参数将可能造成较大的误差,为提高南瓜籽多糖含量测定结果的准确性,本研究拟采用苯酚-硫酸法测定南瓜籽中多糖含量,通过优化浓硫酸用量、苯酚用量、显色温度和显色时间等试验条件,并对精密度、加标回收率等进行研究,旨在寻求南瓜籽多糖含量的最佳测定方法。
1 材料与方法
1.1 材料与设备
宝库1号裸仁南瓜籽:讷河市宝库良种繁育研究所;
浓硫酸:哈尔滨理工化学试剂有限公司;
苯酚:天津市河东区红岩试剂厂;
葡萄糖:天津市风船化学试剂有限公司;
双光束紫外可见分光光度计:UV-1901型,北京普析通用仪器有限责任公司;
可见分光光度计:WFJ7200型,尤尼科上海仪器有限公司;
电子恒温不锈钢水浴锅:HHS-2S型,上海必尔得实业有限公司;
循环水式多用真空泵:SHB-III型,郑州长城科工贸有限公司;
低速离心机:SC-3610型,安徽中科中佳科学仪器有限公司。
1.2 试验方法
1.2.1 南瓜籽粗多糖的制备 取南瓜籽,干燥后用万能粉碎机粉碎,以无水乙醚为提取剂,采用索氏提取器脱脂,脱完脂后的南瓜籽干粉呈白色。准确称取7.0 g南瓜籽干粉,加入140 m L的蒸馏水,50℃水浴提取1 h,浸提液5 000 r/min离心20 min,上清液浓缩后加入无水乙醇,至80%的乙醇浓度,静置过夜,沉淀冷冻干燥,得南瓜籽粗多糖1.1 g。精密称取一定量南瓜籽粗多糖配制成浓度为0.20 mg/m L的南瓜籽多糖溶液。置于冰箱中冷藏备用。
1.2.2 最大吸收波长的确定 分别吸取南瓜籽多糖溶液和葡萄糖标准溶液各2.0 m L于25 m L具塞试管中,分别加入6%苯酚溶液1.0 m L,摇匀后迅速加入5.0 m L浓硫酸,30℃水浴30 min,以相应试剂空白为参比,采用紫外可见分光光度计进行扫描,波长范围为400~600 nm,确定其最大吸收波长。
1.2.3 浓硫酸用量的确定 吸取2.0 m L南瓜籽多糖溶液于25 m L具塞试管中,加入6%苯酚溶液1.0 m L,摇匀后分别迅速加入浓硫酸4.0,5.0,6.0,7.0,8.0 m L,摇匀,30℃水浴30 min,测其吸光度值。平行测定3次。
1.2.4 6%苯酚溶液用量的确定 吸取2.0 m L南瓜籽多糖溶液于25 m L具塞试管中,分别加入6%苯酚溶液0.2,0.6,1.0,1.4,1.8 m L,摇匀后迅速加入5.0 m L浓硫酸,摇匀,30℃水浴30 min,测定吸光度值。平行测定3次。
1.2.5 显色温度的确定 吸取2.0 m L南瓜籽多糖溶液于25 m L具塞试管中,加入由1.2.4确定的苯酚溶液,摇匀后迅速加入5.0 m L浓硫酸,摇匀分别在0,25,30,50,100℃水浴条件下放置30 min,测定吸光度。平行测定3次。
1.2.6 显色时间的确定 吸取2.0 m L南瓜籽多糖溶液于25 m L具塞试管中,加入1.0 m L苯酚溶液,摇匀后迅速加入5.0 m L浓硫酸,摇匀于30℃水浴分别处理10,20,30,40,60 min,测定吸光度值。平行测定3次。
1.2.7 标准曲线的绘制 精密称取干燥的葡萄糖0.025 1 g于250 m L容量瓶中,加水至刻度,配制成0.100 4 mg/m L葡萄糖标准溶液。准确移取葡萄糖标准溶液0.4,0.6,0.8,1.0,1.2,1.4,1.6,2.0 m L于25 m L具塞试管中,各以水补至2.0 m L,加入1.0 m L苯酚溶液,摇匀后迅速加入5.0 m L浓硫酸,30℃水浴30 min,测定吸光度。空白对照以蒸馏水代替糖溶液。
1.2.8 换算因子的计算 精密称取南瓜籽多糖10.0 mg,加蒸馏水溶解,转移至50 m L容量瓶中,加蒸馏水稀释至刻度,摇匀,得南瓜籽多糖贮备液。取2.0 m L南瓜籽多糖溶液,按照1.2.7中测定条件测定吸光度,由回归方程计算出溶液中葡萄糖含量,按文献[12]的方法检测换算因子,其计算公式见式(1)。

式中:
f—— 换算因子;
W—— 多糖质量,mg;
C——多糖溶液中葡萄糖浓度,mg/m L;
D——多糖的稀释因子。
1.2.9 精密度试验 取上述南瓜籽多糖溶液样品按1.2.7中测定条件平行5次测定,计算相对标准偏差,并分析其重现性。
1.2.10 稳定性试验 按1.2.7中测定条件每隔10 min测定南瓜籽多糖溶液吸光度,1 h后每隔20 min测定一次,考查2 h内的稳定性。
1.2.11 加标回收率试验 分别吸取南瓜籽多糖溶液2.0 m L 3份于25 m L具塞试管中,按方法1.2.7测定吸光度值,由吸光度值平均值计算得南瓜籽多糖含量(以葡萄糖计)。另取3份南瓜籽多糖溶液1.0 m L于25 m L具塞试管中,分别加入1.0 m L葡萄糖标准溶液按方法1.2.7测定吸光度值,计算加标回收率[13]。
1.2.12 南瓜籽多糖含量测定 将市场上购得的裸仁南瓜籽按方法1.2.1制备南瓜籽多糖,再按方法1.2.7测定其吸光度值,根据标准曲线方程和换算因子计算出南瓜籽多糖的含量。
2 结果与分析
2.1 最大吸收波长的确定
最大吸收波长扫描结果见图1。由图1可知,葡萄糖标准溶液和南瓜籽多糖溶液均在486 nm处有最大吸收,说明以葡萄糖为标品测定南瓜籽多糖含量的方法可靠。因此以下试验均选取486 nm为测定波长。
2.2 浓硫酸用量的确定
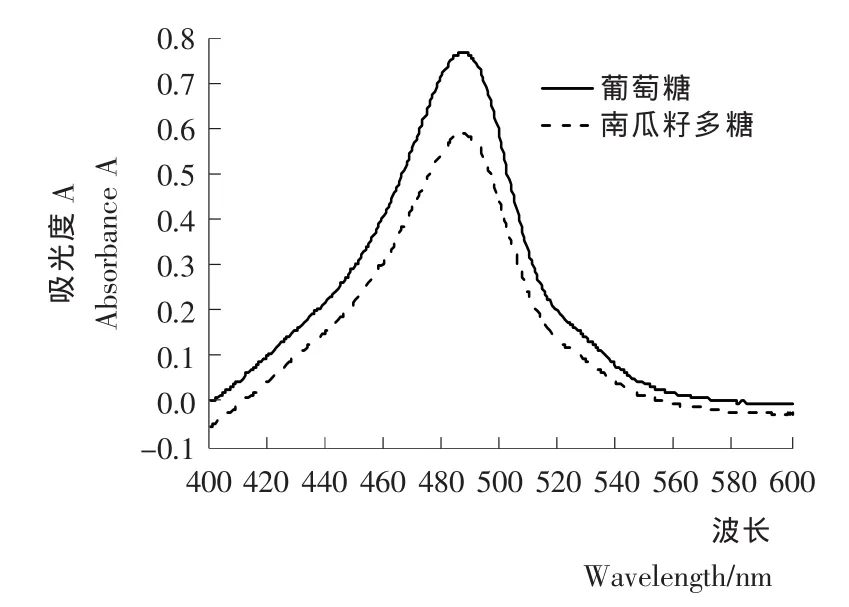
图1 最佳测定波长的选择Figure 1 Scanning spectra
浓硫酸用量对溶液吸光度的影响见图2。由图2可知,随着浓硫酸加入量的增加,溶液的吸光度先升高后下降,当浓硫酸加入量为5.0 m L时,吸光度达到最高值0.554,相对标准偏差RSD=0.26%(n=3)。 加入量超过5.0 m L后,吸光度大幅度下降,可能是由于浓硫酸过多会使多糖碳化严重。由此,在以下的试验中使用5.0 m L浓硫酸。
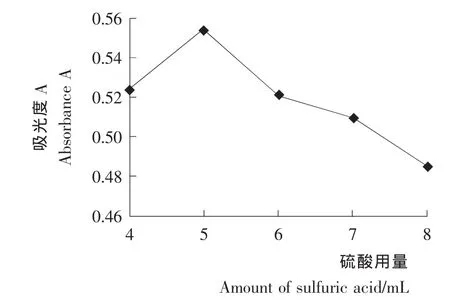
图2 不同硫酸用量的吸光度比较Figure 2 Effects of different sulfuric acid amounts on color results
2.3 6%苯酚溶液用量的确定
苯酚用量对溶液吸光度的影响见图3。由图3可知,随着苯酚溶液用量的增加,多糖溶液的吸光值也相应增加,并在1.0 m L时出现最大值0.500,相对标准偏差 RSD=0.60%(n=3),之后随着苯酚溶液用量继续增加吸光度下降,所以选取1.0 m L为最佳苯酚溶液用量。
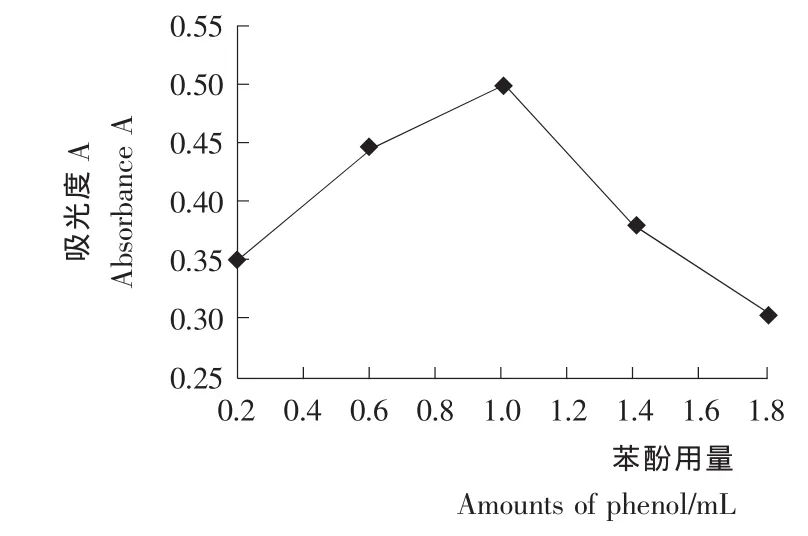
图3 不同苯酚用量的吸光度比较Figure 3 Effects of different phenol amounts on color results
2.4 显色温度的确定
显色温度对溶液吸光度的影响见图4。由图4可知,吸光度随着显色温度提高同样呈现先升后降的趋势。在30℃时,吸光度值最高,为0.547,相对标准偏差 RSD=0.62%(n=3)。试验中还发现,由于试管内浓硫酸与多糖反应剧烈放热,迅速放进冰水浴条件下显色,极易造成具塞试管底部破裂。所以,30℃水浴为本试验的最佳显色温度。
2.5 显色时间的确定
显色时间对溶液吸光度的影响见图5。由图5可知,在30 min内,随着显色时间的增加,吸光度逐渐升高,30 min时吸光度值为0.537,相对标准偏差RSD=0.32% (n=3),之后南瓜籽多糖溶液的吸光度趋于平稳,可能是水浴30 min时溶液恰好显色完全。所以,本试验中水浴30 min为最佳显色时间。
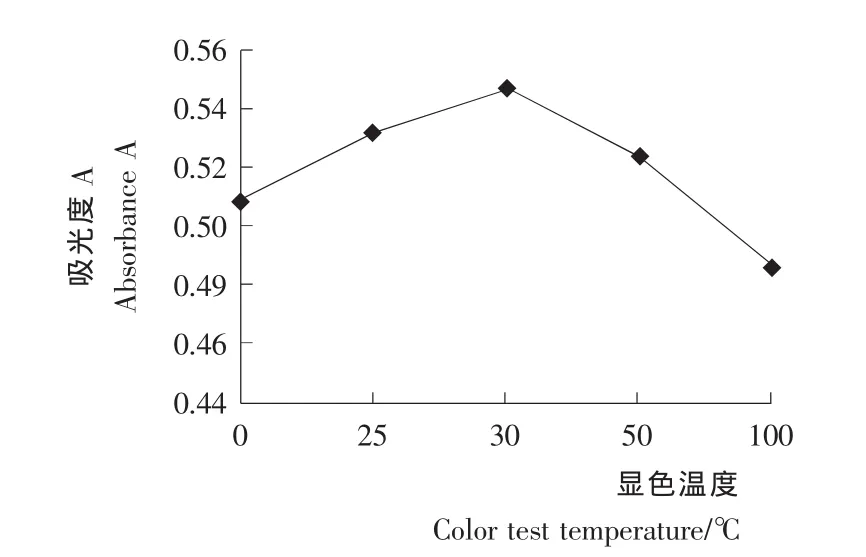
图4 不同显色温度的吸光度比较Figure 4 Effects of different temperatures on color results
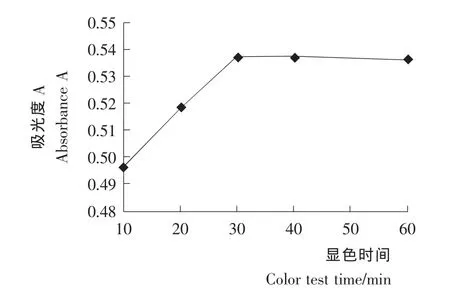
图5 不同显色时间的吸光度比较Figure 5 Effects of different developing time
2.6 标准曲线的绘制
以葡萄糖质量浓度为横坐标,吸光度A为纵坐标,绘制葡萄糖标准曲线见图6。由图6可知,葡萄糖浓度在0~100μg/m L的质量浓度范围内有良好的线性关系。其回归方程为y =0.012 3x-0.001 6,相关系数r为0.998 2。
2.7 换算因子的计算
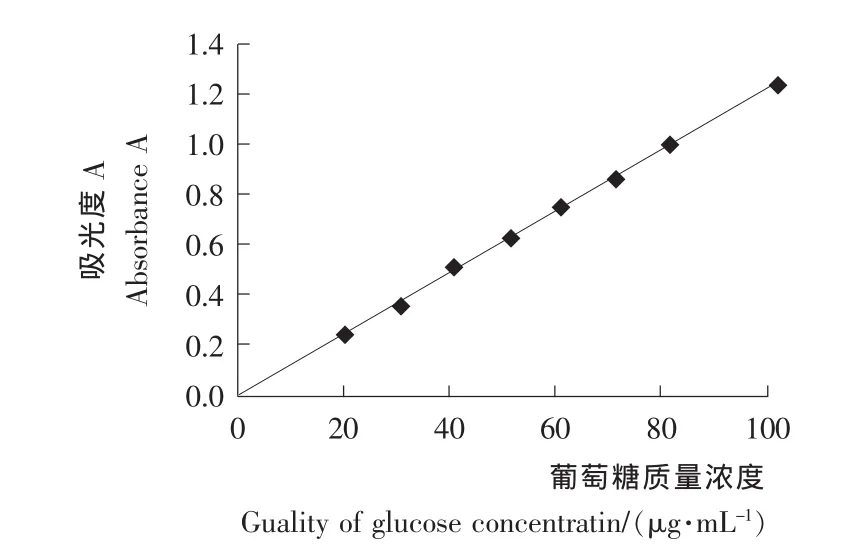
图6 葡萄糖标准曲线Figure 6 Glucose standard curve on color results
按1.2.7方法测定南瓜籽多糖溶液的吸光度值为0.455,经标准曲线回归方程计算得葡萄糖质量浓度为0.018 6 mg/m L,按照1.2.8中换算因子计算公式,计算得换算因子f=10.75。
2.8 精密度试验
同一多糖溶液,相同条件重复测定吸光度5次,计算所得吸光度平均值0.507,标准偏差0.004 69,相对平均偏差RSD=0.93% (n=5),表明重现性良好。
2.9 稳定性试验
由表1可知,南瓜籽多糖溶液在120 min内稳定性良好,随着时间的增加,吸光度值略有下降,尤其在前60 min内吸光度值由最初0.504只降至0.501,120 min时降至0.496。相对平均偏差RSD=0.66%。
2.10 加标回收率试验
经计算南瓜籽多糖含量为20.66μg/m L(以葡萄糖计)。由表2可知,经测定该方法的平均加标回收率100.75%,相对平均偏差RSD=0.83%(n=3),说明该测定方法准确可信。

表1 稳定性测定结果Table 1 Results of stability experiments
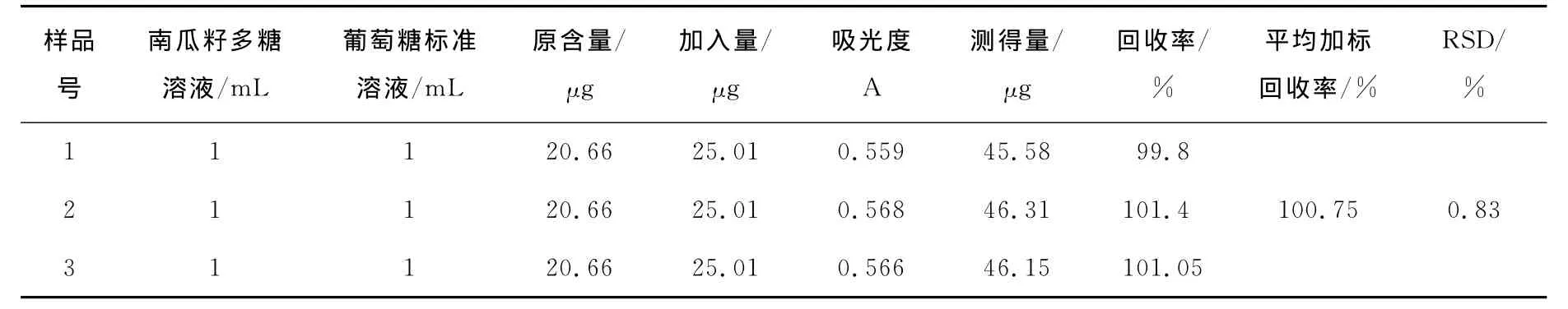
表2 加标回收率试验结果Table 2 The addition recovery result
2.11 南瓜籽多糖含量测定
按方法1.2.7测定南瓜籽多糖溶液吸光度值为0.439,从而计算出南瓜籽粗多糖中总糖含量为17.9%。
3 结论
使用苯酚-硫酸法测定南瓜籽多糖含量,浓硫酸用量、苯酚溶液用量、显色时间、显色温度等因素对南瓜籽多糖溶液的吸光度均有不同程度的影响,通过优化上述试验条件,得出较优条件为波长486 nm,6%苯酚溶液1.0 m L,浓硫酸5.0 m L,在30℃水浴30 min的条件下显色,平均加标回收率为100.75%,RSD为0.83%,测得样品中多糖的含量为17.9%。该方法稳定性和重复性较好,简便快速,适用于南瓜籽中多糖含量的定量测定。
本试验结果也证实在南瓜籽中的确含有一定量的多糖成分,以此为基础,笔者正在进一步展开对南瓜籽中多糖的生物活性及其功能的研究,研究成果将有望弥补国内外在该领域的研究空白。
1 刘玉梅,高智明,王建,等.裸仁南瓜籽及南瓜籽油的营养成分研究[J].食品工业科技,2010,31(6):313~316.
3 Marianna N Xanthopoulou,Tzortzis Nomikos,Elizabeth Fragopoulou,et al.Antioxidant and lipoxygenase inhibitory activities of pumpkin seed extracts[J].Food Research International,2009,42(5~6):641~646.
4 宗玉丽,李鑫,付英梅,等.南瓜籽活性成分研究及应用[J].微生物学杂志,2011,31(2):109~112.
5 赵一秀,王烜,赵占义.南瓜多糖特征官能团检测及其与抗蛋白质非酶糖基化关系的研究[J].哈尔滨医科大学学报,2013,47(2):122~125.
6 刁文超,吴昊,杨绍兰,等.南瓜多糖的分离、纯化及抗氧化活性研究[J].中国食品学报,2012,12(11):24~30.
7 周浓,刘亚,曹湛慧.贝类中可溶性糖的提取及含量测定[J].食品与机械,2013,29(4):133~136.
8 郭金龙,陈有君,孙国琴,等.苯酚-硫酸法测定杏鲍菇多糖方法的研究[J].食品科学,2008,29(12):555~558.
9 何新益,刘仲华.苦瓜多糖的改良苯酚-硫酸法测定和提取工艺[J].食品与机械,2007,23(4):72~75.
10 程素娇,邓璐璐,章海燕,等.乌饭树树叶多糖提取及纯化工艺优化研究[J].食品与机械,2012,28(6):142~146.
11 陈杨琼,伍春莲,侯怡铃,等.松乳菇多糖含量的苯酚硫酸法检测研究[J].西华师范大学学报(自然科学版),2012,33(2):135~138.
12 赵虹桥,朱炯波,董爱文,等.麦冬种子多糖的提取及含量测定[J].种子世界,2004(12):24~26.
13 佟海菊,张志胜,孙克岩,等.苯酚-硫酸法测定海湾扇贝多糖方法的研究[J].食品工业科技,2011,32(10):447~448,452.
