磁性纳米多孔复合支架材料的细胞相容性研究*
2014-05-02黄江鸿段莉陈洁琳熊建义朱伟民王大平
黄江鸿段莉陈洁琳熊建义朱伟民王大平*
论著·实验研究
磁性纳米多孔复合支架材料的细胞相容性研究*
黄江鸿1,2,3段莉1,2,3陈洁琳1,2,3熊建义1,2,3朱伟民1,2,3王大平1,2,3*
目的研究磁性纳米多孔复合 (n-HA/PLLA/Fe2O3)材料的细胞相容性,探讨细胞在材料表面黏附、增殖、表达等生物学行为,为其医学应用提供实验依据。方法 将大鼠成骨细胞与磁性纳米多孔复合材料共培养,采用CCK-8法检测细胞增殖、扫描电镜观察细胞在材料上的黏附、RT-PCR检测I型胶原和骨钙素基因的表达。结果CCK-8检测显示实验组磁性纳米多孔复合材料上细胞的增殖与空白对照组没有差异性 (>0.05);扫描电镜观察到细胞在磁性纳米多孔复合材料的表面和孔隙内大量黏附、增殖和生长,随着共培养时间的增加,材料表面的细胞数量明显增多;RT-PCR显示随着共培养时间的增加,I型胶原基因的表达增强 (<0.05),骨钙素的表达无明显差异(>0.05)。结论磁性纳米多孔复合支架材料适于成骨细胞的黏附、生长和分化,具有良好的细胞相容性。
磁性;多孔;成骨细胞;细胞相容性
医用生物材料,如n-HA、PLLA等,已经广泛用于骨科领域并取得了显著的临床疗效。近年来,随着生物工程和生物医学的发展,生物复合材料是研究的一个热点,经常需要一些功能性材料的加入构建出更完美,更理想的生物医用复合材料。如单分散、微米级、功能性的磁性粒子 Fe2O3,由于其具有比表面积大、吸附性强、凝集作用大以及表面具有反应能力等特异性质而得到了广泛的应用[1,2]。Fe2O3是一种磁性纳米粒子,它具有磁响应性及超顺磁性,可以在恒定磁场下聚集和定位、在交变磁场下吸收电磁波产热。由于磁性纳米粒子具有和细胞表面结合的能力,这就使在外加磁场的条件下控制和调节细胞的功能成为可能[3]。Akirafto等[4]研究了磁性纳米粒子对骨髓间充质干细胞的作用:磁性纳米粒子以平均每个细胞20pg的浓度聚集在间充质干细胞内,在外加磁场的作用下,磁性纳米粒子可显著促进骨髓间充质干细胞的增殖。Kazunorl Shimizu研究[5]表明:人间充质干细胞在磁性纳米粒子和外加磁场的作用下具有分化为成骨细胞,脂肪细胞和软骨细胞的能力,磁性纳米粒子和磁场联合作用能够促进骨修复。本研究通过低温快速成型仪将n-HA、PLLA、Fe2O3这三种材料复合制备得到磁性纳米多孔复合(n-HA/PLLA/Fe2O3)支架材料。拟体外研究大鼠成骨细胞与磁性纳米多孔复合支架材料共培养,探讨细胞在材料表面黏附、增殖、表达等生物学行为,为其医学应用提供实验依据。
1 材料与方法
1.1 主要实验材料、试剂及仪器
-MEM、胎牛血清、500U/ml青霉素和500 g/ml链霉素 (美国Gibco公司),CCK-8细胞增殖及细胞毒性检测试剂盒(凯基生物)。TRIzol@Reagent(invitrogen公司,美国),低温快速成型仪 (中国科学院深圳先进技术研究院),扫描电子显微镜 (MIRA3 TESCAN,深圳清华大学研究院)。
1.2 材料的制备方法
按一定的质量比例将n-HA、PLLA、Fe2O3材料混合成溶液状,采用低温快速成型技术制备成磁性纳米多孔复合(n-HA/PLLA/Fe2O3)材料 (25mm×25mm×25mm)(图1,彩图见插页)。具体步骤如下:
将PLLA溶解于有机溶剂溶剂(1,4-二氧六环),均匀混合,60℃水浴中搅拌配制一定浓度的PLLA/1,4-二氧六环均相溶液;将一定质量比例的n-HA,Fe2O3加入上述溶液中,超声波震荡各15分钟、电磁搅拌12小时后至n-HA,Fe2O3完全分散均匀。
将制得的生物材料溶液转入低温快速成型仪中在-4℃条件下进行低温快速成型,通过RIPF工艺成形具有一定间隔的平行的冰线,将配制好的生物材料溶液填入冰线间的间隔,将填了生物材料后的表面刮平,使得冰线和生物材料交替排列。在正交方向成形下一层冰线,重复以上步骤。
成形后,将冰和生物材料构成的实体拿到冷藏室,冰融化剩下的空间即为磁性人工骨支架材料的纵横交错、彼此连通的大孔。得到的样品置于真空冷冻干燥机去除有机溶剂;风干2天后取出样品,有机溶剂升华后支架材料留下了大量更为微细的孔洞,表面喷金后经电镜扫描,并测量孔隙率。
该材料为三维多孔立体结构,孔隙率80%~85%,扫描电镜观察可见孔隙均匀,孔间相互贯通,局部放大后,材料表面凹凸不平,较粗糙(见图2)。多孔n-HA/PLLA/Fe2O3材料先用紫外线照射半小时,经 PBS液浸泡、清洗,75%乙醇侵泡消毒后干燥备用。

图1 多孔n-HA/PLLA/Fe2O3材料
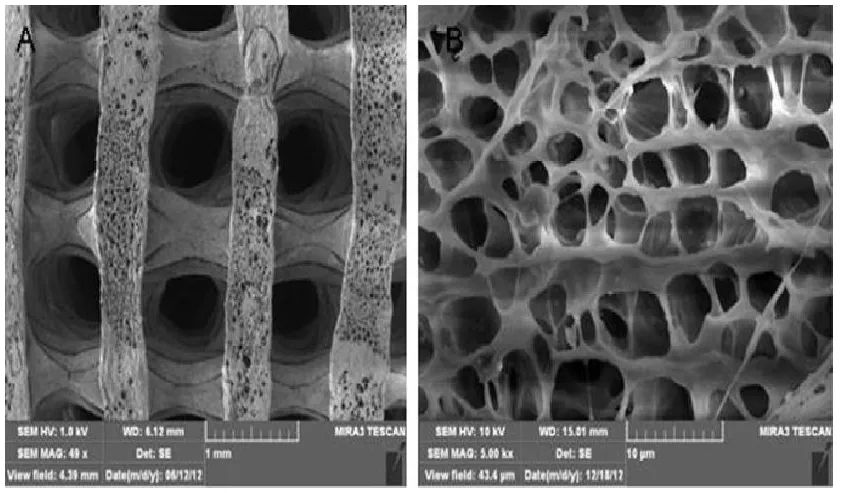
图2 A多孔n-HA/PLLA/Fe2O3材料的扫描电镜观(50×):孔隙均匀,孔间相互贯通,孔径达500um;B多孔 n-HA/PLLA/Fe2O3材料的扫描电镜观(5000×):多孔网状结构,孔内壁粗糙,孔间以微孔相通,孔隙率85%
1.3 大鼠成骨细胞 (osteoblasts,OB)分离培养
采用酶消化法分离小鼠成骨细胞。将3只24小时内胎鼠夹颈处死,在75%酒精中浸泡消毒;然后剪开头部皮肤,取头盖骨,在PBS中,剔除脑组织、血液,刮去周围结缔组织,得到白色头盖骨;用剪刀剪成泥状,加入5ml胰酶,37℃水浴消化30分钟;吸弃胰酶消化液,PBS洗1次,加入5mlII型胶原酶,37℃水浴消30分钟,同时轻轻震荡促进消化;吸取胶原酶,1000r/min离心5分钟,弃上清液,加入适量 -MEM培养液,轻轻吹打,制得细胞悬液,移入细胞培养瓶中;向剩余骨片中再加入5mlII型胶原酶,37℃水浴消化30分钟,重复以上操作,制得细胞悬液。收集细胞悬液,接种于细胞培养瓶中,然后置入37℃、5%CO2饱和湿度的细胞培养箱中进行培养,第2天换液,以后隔天换液。大鼠成骨细胞 (见图3,彩图见插页)贴壁良好,呈椭圆形、梭形、三角形或不规则多边形,细胞间通过伪足相互黏附,胞浆透亮,胞核呈圆形或椭圆形,居中或偏于细胞一侧,有1~3个细胞核,核中存在1或多个核仁。第3代OB用于与多孔n-HA/PLLA/Fe2O3材料共培养实验。
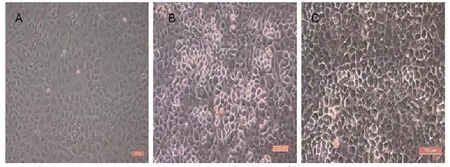
图3 大鼠成骨细胞显微镜下形态呈椭圆形、梭形、三角形或不规则多边形,A:P0;B:P1;C:P3
1.4 OB与多孔n-HA/PLLA/Fe2O3材料共培养
将多孔 n-HA/PLLA/Fe2O3材料无菌条件下在含10%胎牛血清的 -MEM培养液中接种OB。实验分为两组:实验组(A组),OB与多孔 n-HA/PLLA/Fe2O3共培养;对照组 (B组),OB单独培养;实验在24孔板内进行,细胞接种密度为5×105/孔;并在5%CO2、37℃孵箱中培养,每3天换液。
1.5 检测指标
1.5.1 细胞增殖活性检测
采用CCK-8法。A、B两组,每组5个复孔,在细胞培养第1、3、5、7、9天,于每孔中加入CCK-8液50 L,在37℃孵箱中孵育4小时,将各孔液体转移到96孔板中,使各孔内液体量相等,用酶标仪在490nm波长下测其光吸收值 (A值),绘制细胞增殖曲线。
1.5.2 扫描电子显微镜观察
分别于共培养1、2、3周后取出多孔n-HA/PLLA/Fe2O3材料,将材料用 PBS清洗2次,2.5%戊二醛4℃固定2小时,乙醇逐级脱水,二氧化碳临界点干燥,喷金,扫描电镜观察细胞黏附情况。
1.5.3 RT-PCR检测
参照Saqomonyants等[6]的研究方法,分别收集A组共培养1、2、3周后的大鼠成骨细胞1×106个,原代大鼠成骨细胞(P0)生长到90%融合时提取总RNA作为空白对照。每1×106个细胞用1ml Trizol(Invitrogen)提取细胞总RNA,紫外分光光度计定量 (WPAUV1101),A260/280>1.8。应用两步法RT-PCR进行分析,第一链cDNA合成方法及条件参照Fermentas公司的试剂盒说明书进行。25 L反应体系中包含:10xTaq buffer 2.5 L,25 mmol/L MgCl23.0 L,(10mmo/ L)dNTP2.0 L,Taq DNAPolymerase(1U/L)1.0 L,ddH20 18.5 L,模板cDNA 1.0 L正向引物和反向引物 (20 L)各1.0 L,PCR仪设置为95℃预变性3分钟,1个循环;30个循环,退火45秒(参照下面的退火温度),72℃延伸1分钟;72℃,7分钟总延伸。Ⅰ型胶原 (type-I collagen,Col-I)引物上游:5'-CACTGGCGATAGTGGTCCTG-3',下游:5'-CGGCCACCATCTTGAGACTT-3',退火温度为53℃,扩增片段为132 bp;骨钙素 (osteocalcin,OCN)引物上游:5'-TGCCAGGTCACCAAATACCA-3',下游:5'-TGAGTACTGAGAGGCCCCAA-3’,退火温度58℃,扩增片段为112 bp;内参 -actin引物上游:5’-TGAGACCTTCAACACCCC-3’,下游:5'-GCCATCTCTTGCTCGAAGTC-3',退火温度为56℃,扩增片段为316bp。分别取5 L I型胶原、骨钙素及 -actin反应产物用2%琼脂凝胶电泳,GelRed染色,在QuantityOne软件下测定不同条带的灰度值,行半定量比较。
1.6 统计学分析
2 结果
2.1 CCK-8
成骨细胞在多孔n-HA/PLLA/Fe2O3材料上面的增殖情况见图4(彩图见插页)。在实验组和对照组中,细胞增殖无明显差异 (>0.05)。
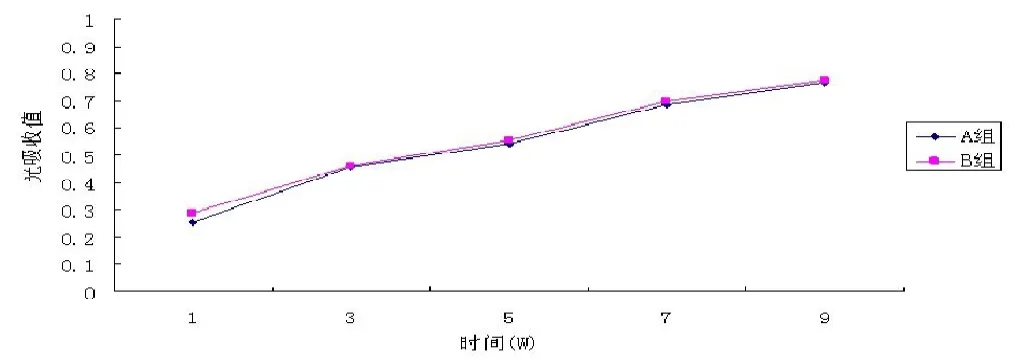
图4 大鼠成骨细胞在支架材料表面的增殖率(A组)与组织培养塑料平板上的细胞增殖率(B组)无明显差别(>0.05)
2.2 扫描电镜观察
成骨细胞与多孔n-HA/PLLA/Fe2O3材料共培养的扫描电镜照片见图5。形态学分析显示出细胞在多孔 n-HA/PLLA/ Fe2O3表面上均伸展良好,呈梭形或鳞片状,伪足伸展充分,并且相互连接成片。随着共培养时间的增加,材料上的细胞增多并逐渐融合。

图5 A,B,C分别为多孔n-HA/PLLA/Fe2O3材料与大鼠成骨细胞共培养1、2、3周后的扫描电镜观(5000×)。随着培养时间增加,支架材料上细胞的黏附数量明显增多
2.3 RT-PCR检测Ⅰ型胶原及骨钙素的表达
在共培养1、2、3周后,Ⅰ型胶原的表达增加,差异有统计学意义 (<0.05),骨钙素的表达无明显差异 (>0.05)。其中1周时Ⅰ型胶原的表达与P0无明显差异(>0.05),2周及3周时Ⅰ型胶原的表达均强于P0(<0.05),1、2、3周时骨钙素的表达与P0无明显差异。见图6。
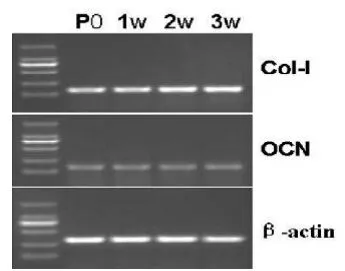
图6 在共培养1、2、3周后,Ⅰ型胶原(Col-Ⅰ)的表达增加,差异有统计学意义(<0.05),骨钙素(OCN)的表达无明显差异(>0.05)。1周时Ⅰ型胶原的表达与P0无明显差异(>0.05),2周及3周时Ⅰ型胶原的表达均强于P0(<0.05),1、2、3周时骨钙素的表达与P0无明显差异。 -actin为内参引物
3 讨论
3.1 三维连通多孔结构的意义
近年来,生物材料在矫形外科及相关领域虽然得到广泛应用,但是材料植入物与骨组织之间的有效整合这一难题尚未得到较好解决。目前,对提高材料生物稳定性和生物相容性的研究多集中在改善材料的理化性质或表面形态(多孔性)上。实验证明粗糙的表面有利捕获纤维素,具有粗糙和多孔表面结构的内植物扩大了细胞黏附的范围,纤维素的大量集中可以诱导成骨细胞的聚集,有利于骨组织的“长入”,加快早期的骨整合,提高骨与内植物的结合强度[7],通过骨与假体的“绑定”达到植入物远期稳定的目的[8]。实验研究显示,当把多孔与螺纹表面的两种假体植入宿主骨并承受载荷时,发现具有多孔表面结构的假体周围骨接触面积较螺纹表面更大,“骨长入”更快[9]。更有研究发现,三维多孔表面形态促进成骨细胞的增殖及成骨能力[10]。
3.2 多孔结构孔径及孔隙率对“骨长入”的影响
材料的孔径和孔隙率对“骨长入”多孔材料内部起着重要作用。一个成熟的骨细胞直径约20 m,所以材料孔径小于此值,骨组织无法“长入”。一个骨单位 (骨细胞核周围的骨基质)约60~80 m,因此为了利于骨组织“长入”多孔结构,孔径应大于80 m。研究显示,具有连通多孔结构、孔径在430~650 m间的孔径均利于“骨长入”[11]。孔隙率代表了单位体积内孔的数量,适合“骨长入”的孔隙率是75%~85%。本实验研制的三维连通多孔n-HA/PLLA/Fe2O3孔径约500 m,孔隙率80%~85%,达到“骨长入”条件,但存在孔的一定的闭塞率,某种程度上影响了“骨长入”的效果。
3.3 与前期相似研究中的实验结果差异
一直以来,不同支架材料之间的细胞相容性比较以组织培养塑料平板作为“金标准”[12]。本研究利用成骨细胞与多孔n-HA/PLLA/Fe2O3共培养,细胞在多孔n-HA/PLLA/Fe2O3材料上的增殖与“金标准”无明显差别,本实验RT-PCR结果Col-Ⅰ在3周时的表达水平增高;OCN的表达无明显差异。本研究中使用的半定量PCR测定,得到的数据本身变异较大,即使mRNA表达有显著差别也很难测定,且骨基质蛋白类mRNA的表达在同种异体之间可能会有差异[13]。也可能是因为支架材料的理化性质不同而造成的实验结果差异。总的说来,本实验研究中多孔n-HA/PLLA/Fe2O3材料对成骨细胞的黏附、生长和分化均没有不良作用,是一种细胞相容性良好的支架材料。
4 结论
本实验研究制备的多孔 n-HA/PLLA/Fe2O3孔径约500 m,孔隙率80%~85%,达到了“骨长入”的条件,通过将多孔n-HA/PLLA/Fe2O3材料与大鼠成骨细胞复合,细胞的增殖率(A组)与组织培养塑料平板上的细胞增殖率 (B组)无明显差别(>0.05)。随着培养时间增加,支架材料上细胞的黏附数量明显增多。在共培养1、2、3周后,Ⅰ型胶原 (Col-Ⅰ)的表达增加,差异有统计学意义 (<0.05),骨钙素 (OCN)的表达无明显差异 (>0.05)。实验结果表明,多孔 n-HA/ PLLA/Fe2O3材料对成骨细胞的黏附、生长和分化均没有不良作用,是一种细胞相容性良好的支架材料。
[1] Jiang H,Li Y,Zuo Y,et al.Physical and chemical properties of superparamagnetic Fe-incorporated nano hydroxyapatite[J].J Nanosci Nanotechnol,2009,9(12):6844-6850.
[2] Gaihre B,Khil MS,Kang HK,et al.Bioactivity of gelatin coated magnetic iron oxide nanoparticles:in vitro evaluation[J].J Mater Sci Mater Med,2009,20(2):573-581.
[3]Wu Y,Jiang W,Wen X,et al.A novel calcium phosphate ceramicmagnetic nanoparticle composite as a potential bone substitute[J]. Biomed Mater,2010,5(1):15001.
[4] Akira Ito,Eri Hibino,Hiroyuki Honda,et al.A new methodology of mesenchymal stem cell expansionusing magnetic nanoparticles [J].Biochemical Engineering Journal,2004,20(2-3):119-125.
[5] Shimizu K,Ito A,Yoshida T,et al.Bone tissue engineering with human mesenchymal stem cell sheets constructed using magnetite nanoparticles and magnetic force[J].Tissue Engineering,2004,11 (9-10):1553-1561.
[6] Sagomonyants KB,Hakim-Zargar M,Jhaveri A,et al.Porous tantalum stimulates the proliferation and osteogenesis of osteoblasts from elderly female patients[J].J Orthop Res,2011,4:609-616.
[7] Oshima S,Ishikawa M,Mochizuki Y,et al.Enhancement of bone formation in an experimental bony defect using ferumoxide-labelled mesenchymal stromal cells and a magnetic targeting system [J].J Bone Joint Surg Br,2010,92,(11):1606-13.
[8] Tran N,Webster TJ.Increased osteoblast functions in the presence of hydroxyapatite-coated iron oxide nanoparticles[J].Acta Biomater,2011,7(3):1298-306.
[9] Bock N,Riminucci A,Dionigi C,et al.A novel route in bone tissue engineering:magnetic biomimetic scaffolds[J].Acta Biomater,2010,6(3):786-96.
[10]C.Delabarde,C.J.G.Plummer,P.-E.Bourban,et al.Biodegradable polylactide/hydroxyapatite nanocomposite foamscaffolds for bone tissue engineering applications.Journal of Materials Science, 2012,23,(6):1371-1385.
[11]L Varila,T Lehtonen,J Tuominen.In vitro behaviour of three biocompatible glasses in composite implants.Journal of Materials Science,2012,23,(10):2425-2435.
[12]L M Ehrenfried,M H Patel,R E Cameron.The effect of tri-calcium phosphate(TCP)addition on the degradation of polylactideco-glycolide(PLGA).Journal of Materials Science,2008,19,(1): 459-466.
[13]Z Zhou,Q Yi,X Liu,et al.In vitro degradation behaviors of poly-L-lactide/bioactive glass composite materials in phosphate-buffered solution.Polymer Bulletin,2009,63,(4):575-586.
Cytocompatibility research in magnetic nano-porous composite scaffold
Huang Jianghong1,2,3,DuanLi1,2,3,Chen Jielin1,2,3,et al.1 National Key Orthopedic Department,Shenzhen Second People's Hospital;2 Shenzhen Tissue Engineering Key Laboratory;3 Shenzhen Digital Orthopaedic Engineering Laboratory,Shenzhen GuangDong,518035,China
Objective Tostudy the magnetic nano-porous composite(n-HA/PLLA/Fe2O3)cell compatibility of materials to explore the cell surface adhesion,proliferation,expression and other biological behavior,and provide experimental evidence for its medical applications.Methods Rat osteoblasts and magnetic nano-porous composite co-cultured using CCK-8 cell proliferation assay,scanning electron microscopy of cell adhesion on the material,RT-PCR to detect the expression of typeI collagen and osteocalcin genes.Results CCK-8 assay showed the experimental group on magnetic nanoporous composite cell proliferation and there was no difference between the control group(>0.05);scanning electron microscope to a large number of cell adhesion and pores in the surface magnetic nano-porous composite material,proliferation and growth,with increasing time of co-culture,the number of cell surface was significantly increased;RT-PCR shows that with the increase of culture time,type I collagen gene expression enhanced(<0.05),the expression of osteocalcin no significant difference(>0.05).Conclusion Magnetic nano-porous composite scaffolds for osteoblast adhesion, growth and differentiation,has good biocompatibility.
Magnetic;Porous;Osteoblasts;Cell compatibility
R318.08
A
10.3969/j.issn.1672-5972.2014.05.004
swgk2014-01-0014
黄江鸿(1982-)男,硕士,助理研究员。研究方向:骨组织工程,骨生物材料。
*[通讯作者]王大平(1963-)男,教授,主任医师,博士生导师,研究方向:创伤骨科,运动医学,骨组织工程,数字骨科。
2014-01-26)
1深圳市科技研发资金项目(编号:CXZZ20120614160234842);2深圳市科技研发资金项目(编号:JCYJ20130401113330839);3深圳市科技研发资金项目(编号:CXZZ20130321152713220);4深圳市重点实验室提升项目(编号:CXB201104220049A);5广东省自然科学基金(编号:S2012010008129)5深圳市第二人民医院育苗计划
1深圳市第二人民医院国家重点骨科,广东深圳518035;2深圳市组织工程重点实验室,广东深圳518035;3深圳市数字骨科技术工程实验室,广东深圳518035
